万古霉素对金黄色葡萄球菌生物膜黏附能力的影响
黄 强,费 军,余洪俊,黄显凯
随着对细菌生物膜相关感染的重视,近年来我院创伤外科报道的内植物金黄色葡萄球菌生物膜相关感染发生率显著增加[1],93.5%的创伤慢性难愈合创面检测出金葡菌生物膜感染[2]。细菌黏附在生物体或者植入物表面,分泌胞外基质,组成一个具有高度结构性的膜状复合物,呈现与浮游菌不同的表型,导致感染反复发作难以控制,即细菌生物膜相关感染,目前临床对其治疗手段有限[3]。生物膜内的金葡菌对抗菌素的耐药能力比浮游的金葡菌高10~1000倍,有些抗菌素如氨基糖甙类抗菌素甚至可以诱导细菌形成生物膜[4]。研究抗菌素对金葡菌形成生物膜的过程中的影响对临床预防和治疗金葡菌生物膜相关感染以及了解生物膜引起的细菌耐药有重要意义。万古霉素是对于浮游的金葡菌,包括甲氧西林耐药金葡菌(methicillinresistant staphylococcus aureus,MRSA)都敏感的重要的杀菌药物,但在细菌形成生物膜后其疗效也明显下降[5-6]。万古霉素是否也会诱导生物膜的形成,其在金葡菌形成生物膜过程中的作用如何国内外无文献报道。因此我们选择了万古霉素,对加入万古霉素的金葡菌菌液在玻片上形成生物膜的过程进行了研究,探讨万古霉素对金葡菌形成生物膜早期黏附能力的影响。
材料与方法
1 实验材料
菌株:金黄色葡萄球菌标准菌株ATCC 25923(第三军医大学野战外科研究所大坪医院检验科提供)。药物:万古霉素(日本礼来公司),参照2005版“实验室标准化协会(CLSI)”公布的最低抑菌浓度(minimum inhibitory concentration,MIC)范围,为1.0mg/L[7]。试剂、仪器:LIVE/DEAD Bacterial Viability Molecular Probes试剂盒(Europe BV公司,荷兰);荧光增白剂(Sigma公司,美国);激光扫描共聚焦显微镜(Leica公司,德国)。
2 方法
2.1 金葡菌孵育 将1.0cm×1.0cm大小盖玻片经121°C高温高压消毒25分钟,烘干后放入无菌6孔培养板内备用;用胰胨大豆培养琼脂平板转金葡菌过夜(20小时),再挑单菌落于10ml胰胨大豆培养肉汤中,摇匀约20小时后,将菌液用生理盐水稀释至约1.0×108cfu/L;于备用的无菌6孔板中,每孔加入2μl稀释的菌液及50μl胰胨大豆培养液,于37°C 恒温箱培养3、6、8、12、24、48 小时观察金葡菌生物膜的形成。
2.2 观察万古霉素对金葡菌胞外多糖基质及玻片上黏附的细菌菌落的影响 (1)金葡菌孵育(方法同前)。(2)在金葡菌孵育开始,实验分组按照0.5、1.0、2.0、4.0mg/L 的浓度梯度(分为 1/2MIC、1MIC、2MIC和4MIC组)分别加入万古霉素,于37°C恒温箱培养;3、6小时后取出玻片。(3)观察黏附的细菌胞外多糖基质胞外多糖用荧光增白剂染色[8-9]。取出玻片经灭菌生理盐水多次充分漂洗,去掉浮游菌,加入75μg/ml荧光增白剂,室温下作用40分钟,再漂洗3~5次,甘油溶液封片,湿润状态下用激光共聚焦显微镜(confocal laser scanning microscopy,CLSM)观察。镜下蓝色荧光部分为荧光增白剂染色的黏附细菌自身分泌的多糖基质。(4)在避光条件下,将玻片培养液去除,去离子水轻轻洗涤,除去未黏附细菌;在表面滴加50μl配制好的LIVE/DEAD Bacterial Viability Molecular Probes荧光染液,37°C避光条件下作用15分钟,置CLSM进行检测。试剂盒含有2种染液:SYT09和 PI,其中SYT09可使活菌发出绿色荧光,而PI则使死菌发出红色荧光,从而可以观察到玻片上的金葡菌菌落。(5)图像处理:使用 Image-Pro Plus Version6.0(Media Cybernetics公司,美国)图像分析软件处理图片,每组重复3张,每张取3个随机视野,分别测出黏附金葡菌分泌的多糖基质被染色的面积和累积光密度(integrated optical density,IOD)以及细菌菌落的IOD值。
3 统计分析
采用SPSS 17.0软件对数据进行单因素方差分析,以P<0.05为差异有显著性。
结 果
1 金葡菌生物膜的形成
为了确定实验菌株能形成生物膜以及实验药物作用于生物膜的合适时间,我们观察了金葡菌标准菌株ATCC 25923生物膜的形成过程。金葡菌培养4~6小时处于黏附阶段、6~8小时开始分泌胞外多糖基质(聚集阶段)、18~24小时生物膜就初步形成(成熟阶段)。金葡菌在培养24小时,多糖基质呈团块状、云雾状,之间已经连合在一起,表面生物膜已经形成(图1)。
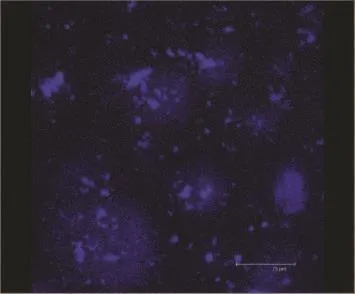
图1 金葡菌培养24小时形成的生物膜
2 早期黏附阶段万古霉素对金葡菌胞外多糖基质的影响
从IPP软件处理后的面积和IOD的数据来看,万古霉素作用3小时,4MIC组的多糖基质的面积和IOD值与空白对照组比较出现了显著性差异,P<0.05;6小时,各实验组所测得的面积及IOD值均与空白对照组明显增多,有显著性差异,P<0.05。显示万古霉素早期能明显刺激金葡菌多糖基质的增多(表1、2 及图2、3)。
3 早期黏附阶段万古霉素对金葡菌与玻片黏附的影响
对CLSM图像肉眼观察发现,加入万古霉素各组的黏附金葡菌落数都比同时相点的空白对照组多(图4、5)。我们进一步计算了金葡菌菌落的IOD值发现:金葡菌菌液加入万古霉素3小时后对黏附在玻片上金葡菌菌落的IOD值虽然有所增加,但没有显著性差异;6小时后1/2MIC组、1MIC和2MIC组的金葡菌菌落的IOD值明显增多,与空白对照组比较有显著性的差异,P<0.05;只有4MIC组的金葡菌菌落的IOD值与空白对照组差异不显著。提示1/2MIC组、1MIC和2MIC的万古霉素明显刺激了金葡菌在玻片的黏附(图6)。
4 金葡菌生物膜形成阶段万古霉素对胞外多糖基质的影响
金葡菌继续孵育至12小时,加入万古霉素各组的金葡菌多糖基质与空白对照组相比才出现了减少,各实验组的面积及IOD值与空白对照组有显著性差异,P<0.05。24小时后,1MIC及以上各组的面积和IOD值比空白对照组明显减少,P<0.05,而低于抑菌浓度(1/2MIC组)的万古霉素组的面积和IOD值与空白对照组比较则差异不显著,这提示只有加入大于1MIC的万古霉素才能抑制金葡菌生物膜的形成(表1、2)。
表1 万古霉素对金葡菌多糖基质面积的影响(±s)
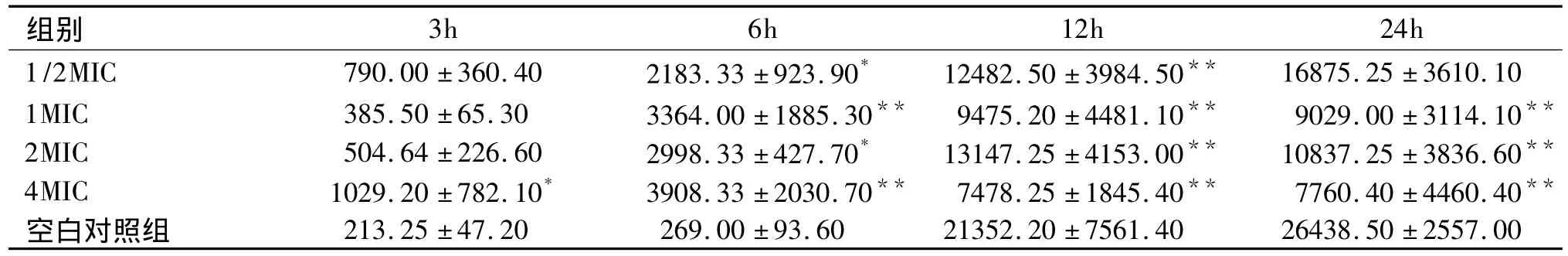
表1 万古霉素对金葡菌多糖基质面积的影响(±s)
与空白对照组比较:*P <0.05,**P <0.001
组别3h 6h 12h 24h 1/2MIC 790.00 ±360.40 2183.33 ±923.90* 12482.50 ±3984.50**16875.25 ±3610.10 1MIC 385.50 ±65.30 3364.00 ±1885.30** 9475.20 ±4481.10** 9029.00 ±3114.10**2MIC 504.64 ±226.60 2998.33 ±427.70* 13147.25 ±4153.00** 10837.25 ±3836.60**4MIC 1029.20 ±782.10* 3908.33 ±2030.70** 7478.25 ±1845.40** 7760.40 ±4460.40**空白对照组 213.25 ±47.20 269.00 ±93.60 21352.20 ±7561.40 26438.50 ±2557.00
表2 万古霉素对金葡菌多糖基质IOD的影响(±s)

表2 万古霉素对金葡菌多糖基质IOD的影响(±s)
与空白对照组比较:*P <0.05,**P <0.001
组别3h 6h 12h 24h 1/2MIC 1695.62 ±1023.50 3510.56 ±1482.10* 20057.21 ±6414.80**27133.60 ±5810.90 1MIC 618.86 ±111.10 5400.09 ±3026.40** 15237.78 ±7204.20** 14586.04 ±5094.80**2MIC 816.30 ±153.70 4815.24 ±689.10* 9843.86 ±5619.10** 11900.63 ±7195.10**4MIC 4193.90 ±3875.10** 6273.83 ±3259.90** 12005.63 ±2964.00** 12458.70 ±7161.10**空白对照组 312.22 ±30.00 403.84 ±140.30 34290.07 ±12125.20 42774.90 ±4126.10
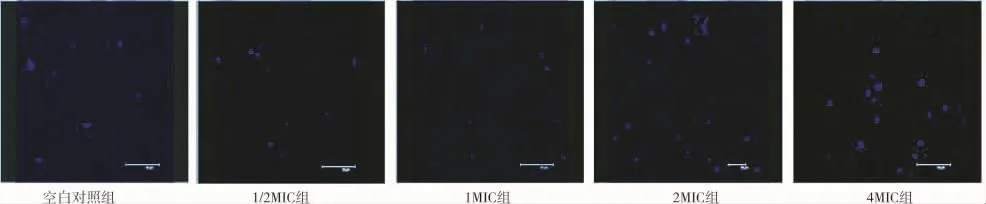
图2 3小时黏附金葡菌产生的胞外多糖基质
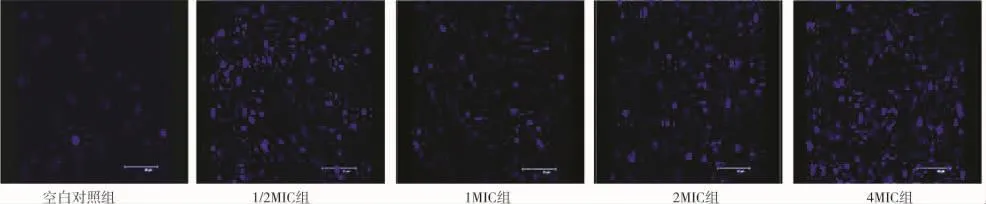
图3 6小时黏附金葡菌产生的胞外多糖基质

图4 3小时黏附金葡菌

图5 6小时黏附金葡菌
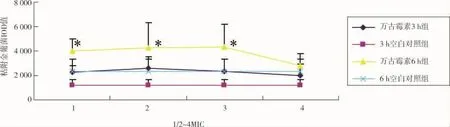
图6 早期黏附阶段万古霉素对黏附金葡菌IOD值的影响
讨 论
本研究采用间接测定和直接观察的手段,使用多糖及DNA染料,通过CLSM成像、IPP图像软件测量黏附细菌菌落及胞外多糖基质,观察加入万古霉素的金葡菌菌液在玻片上形成生物膜的过程,初步了解了万古霉素对金葡菌形成生物膜过程中各个阶段的影响。
研究结果显示,在加入万古霉素组的玻片上3小时即可看到荧光增白剂染色的金葡菌分泌的胞外多糖,而文献报道在初始黏附阶段,细菌一般不分泌多糖基质,细菌在黏附到表面后才大量分泌[10],而金葡菌一般孵育6~8小时才开始分泌胞外多糖基质,是万古霉素的加入使金葡菌菌分泌多糖基质时间提前;从染色的胞外多糖的面积和IOD值看,金葡菌孵育3小时后4MIC浓度的万古霉素即刺激了金葡菌胞外多糖基质的增多,其他各个浓度的万古霉素在6小时后也都促进了金葡菌分泌多糖基质的增加,这些都表明万古霉素能够刺激金葡菌分泌胞外多糖基质。对于黏附在玻片上的金葡菌,1/2MIC组、1MIC组和2MIC组的万古霉素均能明显刺激菌落数增多。只有4MIC组没有出现黏附的细菌菌落数增多,这与药物浓度升到4MIC后6孔板孔内金葡菌浮游的活菌数量过少有关。作为高效的金葡菌杀菌剂,万古霉素在加入到培养液后,使金葡菌黏附在玻片上的数量反而增多,形成的多糖基质面积增大,细菌分泌多糖基质时间提前;也就是说在金葡菌生物膜形成的早期黏附阶段,万古霉素能促进金葡菌与材料表面的黏附,并刺激金葡菌分泌胞外多糖基质,促使金葡菌与材料表面的黏附能力增强。
细菌从最初在生物体或者多聚物表面黏附到逐渐形成生物膜是一个动态的过程[11]。万古霉素促进金葡菌与材料表面的黏附能力增强,是否会促进金葡菌形成生物膜呢?我们进一步的观察发现万古霉素在早期促进了金葡菌的黏附和胞外多糖的形成,但随着药物浓度的增加以及时间的延长,杀菌效应开始显现:孵育初始加入了>1MIC浓度的万古霉素的金葡菌菌液在玻片上最终形成的生物膜还是减少的。但加入的万古霉素浓度<1MIC时,金葡菌形成的生物膜则没有明显减少。提示万古霉素作为一个对金葡菌高效的杀菌剂,虽然在早期会促进金葡菌与材料表面的黏附并形成胞外多糖基质,但其能够依赖强大的杀菌效应来抵消这个影响并最终减少生物膜的形成,而一旦其杀菌作用不占优势,则不能有效减少生物膜的形成。
细菌对宿主表面的黏附是细菌形成生物膜的的第一步[12],细菌的黏附能力普遍被认为是评价细菌生物膜形成能力的重要指标[13]。我们首次发现了万古霉素能促使金葡菌与材料表面的黏附能力增强,表明在金葡菌形成生物膜的早期黏附阶段万古霉素起到促进作用。虽然万古霉素能够依靠其对金葡菌强大的杀菌能力能最终减少生物膜的形成,但毕竟其对金葡菌的早期黏附还是起促进作用的,不能避免某些特定条件下金葡菌形成生物膜的可能风险。生物膜也是细菌产生耐药的机制之一,万古霉素对成熟金葡菌生物膜是没有抑制作用的[14-15],一旦生物膜形成,万古霉素的效能将大大降低,并可能出现金葡菌对其耐药。因此,对于容易形成慢性难愈合创面以及需要使用医用内植物的创伤病人,万古霉素使用必须保持大于1MIC的有效浓度,否则有促进细菌形成生物膜和可能产生对万古霉素耐药的危险。我们认为如果药物浓度有低于1MIC可能时,万古霉素不适宜作为预防用抗菌素。
另外,与金葡菌形成生物膜过程相关的基因位点中:dlt基因通过磷壁酸影响了细菌与材料表面的黏附;ica基因编码了细胞外生物膜的多聚糖成分。万古霉素是否通过刺激dlt及ica基因的上调,加强了金葡菌的黏附能力,促进了细菌胞外多糖的分泌,值得进一步研究。
[1] Sohail MR,UslanDZ,KhanAH,et al.Risk factor analysis of permanent pacemaker infection[J].ClinInfect Dis,2007,45(2):166 -173.
[2] Bjarnsholt T,Kirketerp-Moller K;JensenPO,et al.Why chronic wounds will not heal:a novel hypothesis[J].Wound Repair Regen,2008,16(1):2 -10.
[3] CostertonJW,Stewart PS,Greenberg EP.Bacterial biofilms:a commoncause of persistent infections[J].Science,1999,284(5418):1318 -1322.
[4] HoffmanLR,D’Argenio DA,MacCoss MJ,et al.Aminoglycoside antibiotics induce bacterial biofilm formation[J].Nature,2005,436(7054):1171 -1715.
[5] Raad I,AlrahwanA,RolstonK.Staphylococcus epidermidis:emerging resistance and need for alternative agents[J].ClinInfect Dis,1998,26(5):1182 -1187.
[6] Lee CK,RubinLG,MoldwinRM.Synergy betweenprotamine and vancomycininthe treatment of Staphylococcus epidermidis biofilms[J].Urology,1995,45(4):720 -724.
[7] Institute CA.Performance standards for antimicrobial susceptibility testing:fifteenth InformationalSupplement M100 - S15[M].CLSI,Wayne,PA,USA,2005.
[8] Stewart PS,SrinivasanR,De Beer D,et al.Biofilm structural heterogeneity visualized by three microscopic methods[J].Water Res,1995,29(8):2006 -2009.
[9] Neut D,Hendriks JG,vanHornJR,et al.Pseudomonas aeruginosa biofilm formationand slime excretiononantibiotic - loaded bone cement[J].Acta Orthop,2005,76(1):109-114.
[10] Sutherland IW.Exopolysaccharides inbiofilms,flocs and related structures[J].Water Sci Technol,2001,43(6):77-86.
[11] FuW,Forster T,Mayer O,et al.Bacteriophage cocktail for the prevention of biofilm formationby Pseudomonas aeruginosa oncatheters inaninvitro model system[J].Antimicrob Agents Chemother,2010,54(1):397 -404.
[12] vander Plas MJ,Jukema GN,Wai SW,et al.Maggot excretions/secretions are differentially effective against biofilms of Staphylococcus aureus and Pseudomonas aeruginosa[J].J Antimicrob Chemother,2008,61(1):117 -122.
[13] Harraghy N,Seiler S,Jacobs K,et al.Advances ininvitro and invivo models for studying the staphylococcal factors involved inimplant infections[J].Int J Artif Organs,2006,29(4):368 -378.
[14] HajduS,Lassnigg A,Graninger W,et al.Effects of vancomycin,daptomycin,fosfomycin,tigecycline,and ceftriaxone onStaphylococcus epidermidis biofilms[J].J Orthop Res,2009,27(10):1361 -1365.
[15] vander Plas MJ,Dambrot C,Dogterom - Ballering HC,et al.Combinations of maggot excretions/secretions and antibiotics are effective against Staphylococcus aureus biofilms and the bacteria derived therefrom[J].J Antimicrob Chemother,2010,65(5):917 -923.

