噬菌体浓缩方法的比较
韩传银 ,张飞雄 ,童贻刚
1.首都师范大学,北京 100048;
2.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071
近年来,日益增加的抗生素耐药性使我们对细菌性感染疾病的治疗越来越困难,而且新型抗生素研发的速度远远不及耐药细菌出现的速度,耐药菌对人类健康构成严重威胁,耐药问题已成为全球共同关注的重大难题之一[1],迫使人类重新审视抗生素的使用,寻找其替代品已刻不容缓。噬菌体因具有严格的专一性和对宿主菌的裂解能力,再次获得科学家的重视[2]。噬菌体有十分严格的宿主特异性,这使噬菌体产品对人、动物、植物和环境(包括细菌生态环境)具有较高的安全性[3]。由于噬菌体可以采用活噬菌体制剂,这些活的噬菌体会在合适的宿主细菌中大量繁殖,因此噬菌体产品往往只需很小的使用剂量,并且只需要一次性用药,即可经过增殖放大杀灭所有敏感细菌。目前关于噬菌体治疗的报道也越来越多[4-6],但有关噬菌体分离与浓缩方法的报道相对较少。我们从PEG沉淀、PEG反透析、阴阳离子结合树脂、超滤等5种方法[7-8]入手,对实验室现有的T4、N4、T7等3类噬菌体进行了浓缩对比试验,并对浓缩效果较好的PEG反透析进行了进一步的分析。
1 材料与方法
1.1 材料
IMEO8(T4类噬菌体)、IME11(N4类噬菌体)由本实验室分离[9],T3噬菌体(T7类噬菌体)标准株购自ATCC;上述噬菌体均经罗氏454测序鉴定。阴阳离子结合树脂(QSepharoseXL、SPSepharoseXL)购自GE公司;半透膜(MW8000~14000,77 mm)购自Sig⁃ma公司;Amicon Ultra-15离心超滤管(截留分子量100kD)、PEG8000购自AMRESCO公司。
LB培养基:胰蛋白胨1%,酵母抽提物0.5%,NaCl 1%,pH7.0(固体培养基加1.5%琼脂粉,半固体培养基加0.8%琼脂粉);121℃高压灭菌20 min。
SM 缓冲液:NaCl 5.8 g,MgSO42.0 g,1 mol/L Tris-HCl(pH7.5)50 mL,2%明胶5 mL,加水至1 L。
1.2 噬菌体浓缩
1.2.1 离子结合树脂浓缩 噬菌体表面有很多蛋白,呈现兼性离子的特征,故可与带电荷的树脂进行交换吸附,再用高浓度的NaCl进行洗脱。向1 L样本中加入100 μL阴离子结合树脂QSepharoseXL或阳离子结合树脂SPSepharoseXL,于磁力搅拌器上低速搅拌0.5 h,使噬菌体与树脂充分结合,然后静置0.5 h,10 000 ×g离心10 min,小心地将上清液倒掉,用1 mL 1 mol/L的NaCl将沉淀吹打悬浮,转移至1.5 mL的Eppendorf管内,4℃保存备用。
1.2.2 PEG沉淀 PEG8000是一种很黏稠的高度网状聚合物,可将病毒沉淀下来。向样本中加固体PEG至终浓度为10%,室温下用磁力搅拌器慢慢搅拌溶解PEG,将噬菌体/PEG溶液转移至聚丙烯离心管中冰浴,至少放置1 h,以便使噬菌体颗粒发生沉淀;4℃、11 000 ×g离心10 min,去上清,将离心管倒置倾斜放5 min,以便使剩余液体充分流干,用移液器吸去残余液体,用带橡皮球的宽口吸管将噬菌体沉淀轻轻地重悬于SM缓冲液中,将离心管倾斜放置,使SM缓冲液完全覆盖并浸泡噬菌体沉淀,室温放置1 h;加入等体积的氯仿抽提噬菌体悬浮液中的PEG和细胞碎片,温和振荡30 s;4℃、3000 ×g离心15 min,回收含噬菌体颗粒的亲水相。
1.2.3 PEG反透析 对透过的物质具有选择性的薄膜称为半透膜,可利用半透膜这一特性将样本浓缩。①土壤样本的处理:取10 g干燥土壤,加入200 mL 10 mmol/L 焦 磷 酸 钠 、200 μL 5 mmol/L EDTA,在涡旋仪上剧烈涡旋20 min,4℃、11 000 ×g离心10 min,回收上清液;②污水的处理:用50目的过滤筛进行简单过滤,去除样本中的大颗粒杂质,加入NaCl(终浓度为1 mol/L)使水体中的噬菌体与带电荷杂质解离;③将①中的上清液或②处理后的水样倒入半透膜中,扎紧袋口,做好标记,置盒子中,并用PEG粉末将上述装满样品的半透膜覆盖,过夜反透析;④待半透膜中的液体渗透剩余1 mL左右时,反复用这1 mL液体洗涤半透膜,最后用移液器将液体转移至1.5 mL的Eppendorf管内。
1.2.4 超滤 将噬菌体液加入超滤管,4℃、11 000×g离心10 min,用SM缓冲液洗脱超滤管中的噬菌体,加入等体积的氯仿抽提噬菌体悬浮液中的细胞碎片,温和振荡30 s,4℃、3000 ×g离心15 min,回收含噬菌体颗粒的亲水相。
1.3 噬菌体滤液效价的测定
噬菌体效价指噬菌体的滴度,即每毫升样品含噬菌体的个数。通常是在含指示菌的平板上形成噬菌斑后进行计数,以每毫升含有的噬菌斑形成单位(pfu/mL)表示其效价。将噬菌体滤液梯度稀释9个滴度(10-1~10-9),取100 μL分别与200 μL指示菌一起加入半固体LB培养基中,铺双层平板,37℃培养过夜,按照平板中噬菌斑的个数计算噬菌体的效价。
2 结果
分别取IEM08、IEM11与T3噬菌体标准株进行梯度稀释并滴板,经计数确定T4(IEM08)、N4(IEM11)、T3的滴度分别为5×106、107和106pfu/mL,为确保后续实验中噬菌体浓度的一致性,分别取200 μL N4、T4噬菌体上清液,700 μL T3噬菌体上清液,加到1 L空LB培养液中,混匀,使噬菌体的终浓度为103pfu/mL数量级。将所得的1 L噬菌体液分成200 mL的5等份,分别用PEG沉淀,PEG反透析,阴、阳离子结合树脂,超滤对上述3种噬菌体进行浓缩,并铺双层板计数,结果见表1、图1。5种方法处理后比较噬菌体活性,超滤效果最好,其次是PEG反透析;PEG沉淀效果相对较差,树脂的吸附没有出现很好的浓缩效果。尽管5种方法对3种噬菌体的浓缩效果表现出相同的趋势,但浓缩效果因噬菌体的不同而出现差异,PEG沉淀与反透析中T7表现出相对其他噬菌体较低的浓缩效果。综合考虑浓缩效果、成本与时间等因素,我们将T4、N4、T7类噬菌体加到医院的环境污水或河道淤泥中,然后利用PEG反透析进行噬菌体的提取与活性测定,结果见表2、图2,可以看到PEG反透析对淤泥与污水中噬菌体的浓缩效果较好,浓缩倍数达70倍。

表1 5种方法的浓缩结果原始数据
3 讨论
图1表明超滤效果最好,分析其原因,可能是超滤时可利用横切力快速将大部分噬菌体截留,很少造成额外损失。但因超滤管处理样品较少且滤膜易堵塞,故其使用有一定的局限性。虽然PEG反透析结果比超滤效果差一些,但仍可满足试验对噬菌体活性的要求,故可弥补超滤处理样品少的缺点,且其操作简单,建议处理大量样本时可考虑PEG反透析。PEG沉淀浓缩后的噬菌体活性相对较弱,原因可能是浓缩中高浓度PEG影响噬菌体活性,且在离心过程中会因未沉淀完全而丢失部分噬菌体。PEG反透析效果比超滤差,除了少量小分子PEG透过半透膜对噬菌体活性产生抑制外,还有可能是反透析耗时较长使活性丢失。如果浓缩只是单纯为获得噬菌体的基因组而不考虑活性,PEG沉淀则不失为一种好的方法;若须获得活性较高的高浓度噬菌体,则建议用PEG反透析或超滤或者两者相结合,具体选择哪一种则可根据处理的样本量来决定。
表2 土壤、湖水样本的反透析结果
图2表明PEG反透析可很好地浓缩污水与淤泥中的噬菌体,能够满足大多数研究的浓缩要求。
理想的噬菌体浓缩方法必须满足高效、简便、快速等几个条件,同时又可处理大体积水样且能浓缩不同种类的噬菌体,不受样本中有机质和其他杂质的影响,添加的絮凝剂和洗脱液不对后续检测结果造成影响。上面介绍的5种浓缩方法各有优劣,应根据处理样品和实验目的来选择。

图1 5种方法的浓缩结果
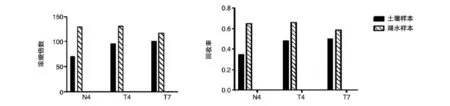
图2 土壤、湖水样本的反透析结果
[1]Levin B R,Bull J J.Phage therapy revisited:the population biology of a bacterial infection and its treatment with bacterio⁃phage and antibiotics[J].Am Nat,1996,147:881-898.
[2]Davies S J,Ogg C S,Cameron J S,et al.Staphylococcus au⁃reus nasal carriage,exit-site infection and catheter loss in pa⁃tientstreated with continuousambulatory peritonealdialysis(CAPD)[J].Periton Dialysis Int,1989,9(1):61-64.
[3]CapparelliR,Parlato M,Borriello G,etal.Experimental phage therapy against Staphylococcus aureus in mice[J].Anti⁃microb Agents Chemothery,2007,51(8):2765-2773.
[4]Wagenaar J A,Van Bergen M A P,Mueller M A,et al.PhagetherapyreducesCampylobacterjejunicolonization in broilers[J].Vet Microbiol,2005,109(3):275-283.
[5]Leverentz B,Conway W S,Camp M J,et al.Biocontrol of Listeria monocytogenes on fresh-cutproduce by treatment with lytic bacteriophages and a bacteriocin[J].Appl Environ Microbiol,2003,69(8):4519-4526.
[6]Smith H W,Huggins M.Successful treatment of experimental Escherichia coli infections in mice using phage:its general su⁃periority overantibiotics[J].J Gen Microbiol,1982,128(2):307-318.
[7]Sambrook J,Russell D W.Molecular cloning:a laboratory manual[M].2nd ed.New York:CSHL press,2001.
[8]Clokie M,Kropinski A.Bacteriophages:methods and proto⁃cols,volume 1:isolation,characterization,and interactions[M].New York:Humana,2009.
[9]Jiang Huanhuan,Jiang Xiaofang,Wang Sheng,et al.The com⁃plete genome sequence ofa novelT4-like bacteriophage,IME08[J].Arch Virol,2011,156(8):1489-1492.

