人造血转录因子GATA-1的克隆、表达及其对间质细胞的生物学作用
南雪,曾泉,王静雪,张文成,房芳,王思涵,岳文,周军年,裴雪涛
军事医学科学院 野战输血研究所,全军干细胞与再生医学重点实验室,北京 100850
GATA-1发现于1991年,被称为红系特异核蛋白的转录因子,与此后陆续发现的GATA-2~GATA-6一起构成GATA家族,该家族为锌指结构家族的转录因子。GATA-1是研究最为充分的造血转录因子。在小鼠模型研究中,GATA-1敲除的小鼠在E10死于严重贫血[1-3]。此前的研究表明,GATA-1主要表达于成熟细胞,对红细胞、巨核细胞、肥大细胞、嗜酸粒细胞的终末分化起重要作用[3-8]。也有报道指出,其对于巨核-红系祖细胞(MEP)的维持和分化起重要作用[9-10]。甚至有报道称GATA-1还表达于睾丸基质Sertoli细胞及非造血胚胎干细胞中[11],这提示我们,GATA-1有可能在非造血细胞中亦发挥着不为人们所知的生物学功能。
此外,自1991年发现GATA-1蛋白以来,虽然在小鼠模型中进行的大量生物学研究[1-9]为全面揭示其功能奠定了基础,但相对于小鼠GATA-1功能的研究,有关人GATA-1蛋白功能的研究报道还较少。在本研究中,我们将从人脐带血cDNA中克隆人GATA-1全长CDS序列,对其进行过表达,并初步探讨其在人非造血细胞(人脐静脉内皮细胞、人成纤维细胞)中的生物学功能。
1 材料与方法
1.1 材料
无菌条件下取产后新鲜脐带,剪去夹痕和血块,长度不少于15 cm,标本来自解放军总医院;无菌条件下取手术后20岁左右成人包皮组织,于含5%双抗的高糖DMEM培养基中运送,48 h内完成分离,标本来自解放军307医院。293T细胞由本室保存;pGEM-T Easy载体购自Promega公司;pBpLV质粒由意大利Vita Salute San Raffaele大学的Luigi Naldiai博士惠赠,保存于本室;小量质粒提取试剂盒及凝胶回收试剂盒购自爱思进生物技术公司;高糖DMEM培养基(HDMEM)、胎牛血清(FBS)购自GIBCO公司;EGM-2培养基购自Lonza公司;bFGF、EGF购自Peprotech公司;非必需氨基酸(NEAA)、L-谷氨酰胺、丙酮酸钠购自Hyclone公司;G418、胶原酶Ⅰ和Ⅳ、明胶、Polybrene购自Sigma公司;CD31-APC、KDR-PE及其同型对照购自Ebioscience公司;LipofectAMINE 2000、TRIzol、琼脂糖购自 Invi⁃trogen公司;限制性内切酶、dNTP、分子量标记及快速连接试剂盒购自TaKaRa公司;Taq DNA聚合酶购自NEB公司;抗人GATA-1抗体购自CST公司;HRP-IgG购自中杉金桥公司;引物合成、测序由上海英骏公司完成。
1.2 人脐静脉内皮细胞(HUVEC)的分离、培养与鉴定
用PBS缓冲液冲洗脐带至无血细胞流出,用止血钳夹紧脐带一端,灌入浓度为1 mg/mL的胶原酶Ⅰ/Ⅳ混合液,充满血管,夹闭另一端,于37℃、5%CO2孵箱中消化15~20 min;将脐静脉内的消化液以及用PBS冲洗1~2次的冲洗液一并注入离心管,室温下1600 r/min离心10 min,收集下层细胞,加入EGM-2培养基,于37℃、5%CO2孵箱中培养,次日更换培养基,随后每2~3 d换液,待细胞生长至80%汇合,按1∶3的比例传代;扩增至第6代后进行流式细胞术,检测细胞表面抗原KDR-PE、CD31-APC的表达。
1.3 人包皮成纤维细胞(HFF)的分离与培养
用手术器械将清洗干净的包皮组织剔除真皮下层的结缔组织和血管组织后,剪为2~3 mm的组织块,将其均匀贴附于10 cm平皿(提前用明胶包被处理)上,于37℃、5%CO2孵箱中倒置培养8~10 h,添加5 mL HDMEM完全培养基(含15%FBS),正置培养3~4 d,换液,1周左右即可见成纤维细胞在组织块周围爬出;待细胞生长至40%汇合,消化细胞,1∶1重铺于新培养瓶中,正常培养,3~4 d传代。
1.4 pBpLV-GATA1载体的构建
1.4.1 PCR扩增GATA-1 CDS序列 用Primer 5软件,根据人GATA-1序列设计引物GATA-1 sense(GCTAGCACCatggagttccctggcctggggt)和 GATA-1 an⁃tisense(TCTAGAtcatgagctgagcggagccaccacagt)( 其 中GCTAGCACC为NheⅠ酶切位点,TCTAGA为XbaⅠ酶切位点),引物合成及测序由上海英骏公司完成。从人全血单个核细胞中提取总RNA,反转录,然后以人cDNA为模板进行PCR扩增(反应条件:95℃5 min,以 95℃ 30 s、58℃ 30 s、72℃ 30 s行 30 个循环,72℃ 7 min)。
1.4.2 pBpLV-GATA1载体的构建 将GATA-1 CDS序列的PCR产物与pGEM-T Easy载体连接,连接产物经转化及克隆扩大培养后提取质粒,用限制性内切酶NheⅠ、XbaⅠ酶切鉴定并测序。将测序正确的重组质粒和pBpLV分别用NheⅠ和XbaⅠ双酶切,1%琼脂糖凝胶电泳分离并分别回收1242 bp和8.4 kb的条带后连接,此后进行连接产物的转化、克隆扩大培养及质粒提取,重组质粒酶切鉴定,测序鉴定。获得正确的pBpLV-GATA1重组质粒。
1.5 pBpLV-GATA1质粒的瞬时转染
转染前一天,以3×105~4×105/mL的细胞密度将293T细胞接种到6孔培养板上,细胞要达到90%~95%的融合。第2 d按每孔10 μL LipofectAMINE 2000、4 μg pBpLV-GATA1 质粒进行瞬时转染,培养基采用Opti-MEM。在37℃、5%CO2培养箱中孵育6 h后更换含血清的全培养基,在37℃、5%CO2培养箱中培养48~72 h后检测外源蛋白表达情况。
1.6 pBpLV-GATA1慢病毒包装
293T包装细胞培养于HDMEM完全培养基中,并添加0.1 mmol/L NEAA、2 mmol/L L-谷氨酰胺、500 mg/L G418,至90%汇合时用胰酶消化收集约6×106细胞,重悬于5 mL培养基中;分别将pBpLVGATA1(或空载体质粒)与包装质粒pLP1、pLP2、pLP/VSVG,在无血清Opti-MEM培养基中与Lipo⁃fectAMINE 2000混合,室温孵育20 min,然后加入293T细胞悬液中,充分混合,置10 cm细胞培养皿中,37℃、5%CO2孵箱中培养过夜,次日用含1 mmol/L丙酮酸钠的完全培养基换液,转染48~72 h后收集上清,4℃、3000 r/min离心20 min去除细胞碎片,病毒液用0.45 μm滤膜过滤后加入细胞中或分装冻存于-80℃冰箱。
1.7 HUVEC和HFF细胞转染及流式细胞分选
分别取第6代HUVEC和第6代HFF,以适当密度接种于6孔板中,第2 d每孔加入2 mL毒液,同时加入6 mg/L的Polybrene促进病毒转染,转染过夜后更换新鲜培养基,次日于荧光显微镜下观察转染效率,扩大培养后进行流式分选(FACS),获得高表达GATA-1的HUVEC-GATA-1和HFF-GATA-1细胞。
1.8 HUVEC-GATA-1和HFF-GATA-1细胞的扩大培养
将流式分选获得的HUVEC-GATA-1细胞培养于EGM-2培养基中,并添加5 ng/mL bFGF、5 ng/mL VEGF、1%NEAA、1%丙酮酸钠,每48 h换液,80%汇合时按1∶2传代。将流式分选获得的HFFGATA-1细胞培养于HDMEM完全培养基中,并添加1%NEAA、1% 丙酮酸钠,每48 h换液,80%汇合时按1∶3传代。
1.9 HUVEC-GATA-1和HFF-GATA-1细胞的生物学分析
1.9.1 细胞生长曲线测定 取扩大培养的对数生长期HFF-GATA-1细胞,按每孔100 μL培养基含1000个细胞的密度接种于7块96孔板,每天在固定时间取一板细胞,将培养基更换为含CCK-8溶液的培养液(100 μL培养液中加入10 μL CCK-8液体),每孔加110 μL,继续培养3 h后检测D450nm值,连续检测7 d。
1.9.2 细胞流式分析 取扩大培养的HFF-GATA-1和HFF-con细胞,分别按照说明书加入适量的PE-小鼠抗人CD90或PE-小鼠抗人CD29抗体,以PE-小鼠IgG作为同型对照,4℃孵育30 min后,PBS洗涤3次,重悬于500 μL PBS中,避光上机进行流式细胞检测。
1.9.3 Western印迹 用胰酶分别消化收集各种瞬时转染或慢病毒感染的稳转细胞株的细胞蛋白,用RIPA裂解过夜,各取100 μg,加入5×上样缓冲液,煮沸5 min,经10%SDS-PAGE后转移至PVDF膜,用5%脱脂奶粉室温封闭1 h,再加入兔抗人GATA-1抗体(1∶500),4℃过夜,用TBST洗涤3次,每次10 min,加入HRP-山羊抗兔二抗(1∶2000),室温孵育2 h,用TBST洗涤3次,每次10 min,ECL显影;以β-actin为内参。
在这一案例中,学生最初猜测“钉子板上围占2格的图形,可以围多少个”的时候,多数学生认为可以围2~3种,猜可以围4种或4种以上的学生不足20%。学生最初围出的图形大致如图1所示。
1.9.4 数据统计 数据以x±s表示,采用t检验比较两组间差异的显著性,用Origin 6.0软件包进行统计学分析,P<0.05为差异具有统计学意义。
2 结果
2.1 原代HUVEC与HFF的分离、培养、扩增与表型分析
分离获得的HUVEC早期细胞为小多角形、球形,簇状生长,经传代后呈单细胞生长,细胞体积增大,呈铺路石样并有旋祸状排列,少数细胞伸展,生长速度稳定,核清晰,圆形或椭圆形,核分裂相多见,胞浆丰富(图1A),可稳定传代至少至18代。取第6代HUVEC进行流式细胞术检测(图2),其中CD31表达比例为100%,KDR和CD31双阳性细胞表达比例为48%,CD34和CD31双阳性细胞表达比例为42.4%,CD133和CD31双阳性细胞表达比例为1.4%。CD34和CD133均为文献所报道的人内皮祖细胞标志[12-13],提示我们分离的HUVEC细胞在商品化EGM-2培养条件下状态良好,其中仍存有一定量的内皮祖细胞样细胞。
分离获得的HFF细胞形态均一,呈典型长梭形,生长状态良好,增殖能力旺盛,2~3 d即可进行传代培养(图1B)。
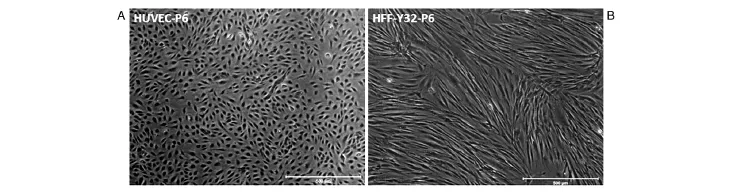
图1 原代分离的细胞
2.2 pBpLV-GATA1载体的构建及鉴定
RT-PCR扩增人GATA-1 CDS序列,琼脂糖凝胶电泳表明在约1242 bp的位置出现与预期结果一致的电泳谱带(图3A),然后将其克隆入T载体进行扩增和酶切鉴定并测序(序列略),测序正确后再将其CDS序列连入pBpLV载体,构建pBpLV-GATA1载体。用NheⅠ、XbaⅠ双酶切后进行琼脂糖凝胶电泳,出现约8.4 kb和1242 bp的条带(图3B),符合预期结果,同时将酶切鉴定正确的克隆进一步测序,挑取测序结果与NCBI报道的人GATA-1序列(NM_002049,CDS序列1242 bp)一致的克隆进行扩增和慢病毒包装。获得GATA-1慢病毒表达载体后,为确定GATA-1蛋白是否能成功过表达,我们首先在293T细胞里进行了质粒瞬时转染实验,对转染3 d后的293T细胞进行了Western印迹检测,结果表明构建的pBpLV-GATA1载体可成功过表达GATA-1蛋白(图3C)。
2.3 稳定过表达GATA-1细胞株的建立
在此基础上,我们在293T细胞里进行了慢病毒的包装,在病毒攻击后的第3 d,在荧光显微镜下可以看到大量293T细胞发出绿色荧光(图4A)。收集毒液,经40%PEG浓缩后,重悬至所攻击靶细胞的完全培养基中。HFF细胞或HUVEC细胞提前一天接种至6孔板中,HFF细胞接种密度为30%~40%,HUVEC细胞接种密度为80%~90%(HUVEC细胞增殖能力相对HFF细胞较弱,且HUVEC细胞对于慢病毒的感染不够耐受,细胞死亡较多,故须增加接种细胞密度)。加入慢病毒毒液攻击过夜后,换为正常培养基培养,待细胞密度适当后采用胰酶进行传代,待细胞达到合适数量后消化细胞成单细胞悬液,上机进行流式分选,获得纯化的GFP+目的细胞。图4B所示为HFF-GATA1和HFF-con细胞流式分选结果,前者阳性率约为3%,后者为13.5%。与对照组HFF-con细胞相比,HFF-GATA1细胞感染效率较低,可能与插入了1242 bp的外源基因有关。图4C所示为经流式分选后,HFF-GATA1和HFF-con细胞的明场、荧光及merge的照片。对流式分选后的HFF-GATA1和HFF-con细胞进行Western印迹检测,结果表明成功构建了过表达GATA-1的稳转HFF细胞株及其对照细胞株(图4D)。
2.4 GATA-1对细胞增殖的影响
2.5 GATA-1对HFF细胞间质特性的影响
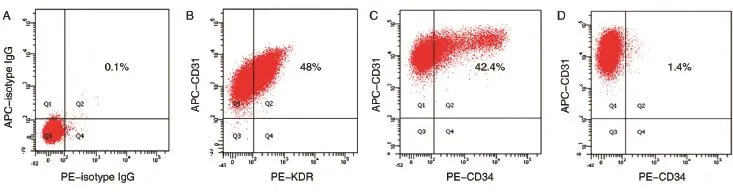
图2 人脐静脉内皮细胞的双色流式鉴定

图3 pBpLV-GATA1重组慢病毒质粒的构建及鉴定
进一步我们要问,GATA-1是一个造血细胞特异性转录因子,其转染至非造血细胞中影响了细胞增殖,这是否是通过影响靶细胞本身的细胞特性所致呢?为此我们对HFF-GATA1和HFF-con细胞进行了流式检测(图7)。CD90和CD29是典型的间质细胞(包括成纤维细胞和间充质干细胞)表面标志,检测结果表明,与对照组细胞相比,GATA-1在HFF细胞中的过表达未影响CD90和CD29的表达。
3 讨论
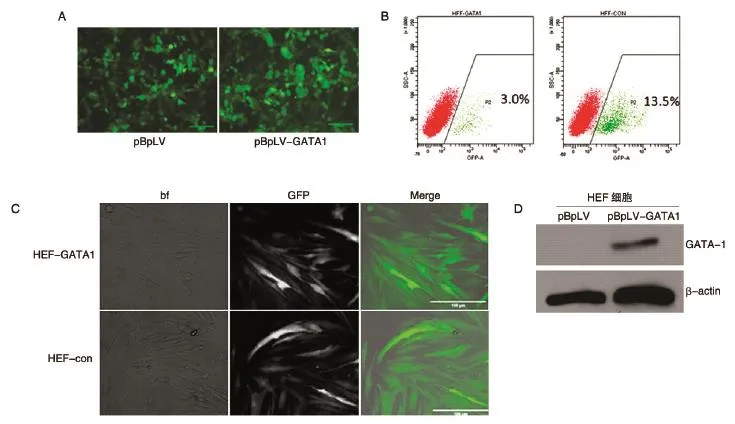
图4 慢病毒包装及HFF-GATA1稳转株的构建和鉴定

图5 HUVEC-GATA1稳转细胞明场(bf)及荧光图(GFP和merge)标尺:100 μm
自1991年发现至今,人们对小鼠GATA-1在造血中的功能进行了很多研究,但直接在人来源的细胞模型中对其进行研究相对较少。研究者往往采取间接研究的方式。如Yang等[14]在研究FOG-1(也称为ZFPM1,是GATA-1的相互作用分子之一)在人CD34+造血干细胞中的功能及其对GATA-1的调控作用时,将小鼠的FOG-1过表达载体导入人CD34+造血干细胞中。虽然小鼠FOG-1与人FOG-1有一定的同源性,但在结构域上还存在差别,同样小鼠GATA-1和人GATA-1的同源性也只有84%,因此不能简单地将小鼠GATA-1在人细胞中过表达来进行研究。Miccio等[15]在研究GATA-1/FOG-1/NuRD信号通路在人β样珠蛋白基因中的作用时仍采用了一种间接模式,即以携带人β样珠蛋白基因的转基因鼠作为研究模型,同时对FOG-1基因进行敲入操作,虽然构思巧妙,但在动物模型体内仍然存在着这样一种可能性,即不能完全反映人细胞中GATA-1等分子完全、真实的功能及其与其他分子的相互作用。总之,目前成功克隆人GATA-1全长的报道很少,在非商业化的载体共享网站Addgene上检索不到人GATA-1的共享信息,只有小鼠GATA-1的共享信息,据我们的检索,只有法国Chretien等在2009年发表的文章中使用了人GATA-1过表达载体[16]。为此,我们采用高保真PCR,从人脐带血cDNA中克隆了GC含量高达61%的人GATA-1全长CDS序列,并实现了其在293T细胞和成纤维细胞中的过表达,从而为进一步研究其功能奠定了基础。
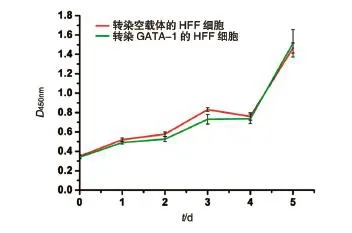
图6 HFF-GATA1稳定转染株的生长曲线测定
在此基础上,我们对人GATA-1在人间质细胞中的功能进行了深入探讨。我们的研究表明,在不表达GATA-1的人原代包皮成纤维细胞中,GATA-1对于HFF细胞的增殖有一定的抑制作用,即早期抑制增殖,后期被成纤维细胞克服。在我们实验室此前的蛋白分子功能的研究中,我们也发现了这种早期抑制增殖现象。例如在大鼠肝干细胞样细胞WB-F344中,我们发现Epimorphin蛋白在早期抑制增殖,但随后被细胞克服[17],有意思的是在人肝癌细胞系中这种抑制现象则观察不到了[18]。同样地,在研究GATA-1的功能时较多采用白血病细胞株[19],可能导致观察不到这种增殖抑制现象。我们还发现将人GATA-1导入HUVEC细胞,严重抑制了该细胞进一步的增殖和扩增,但限于难以大量获得过表达GATA-1的HUVEC细胞,因此未做进一步的生长曲线分析。总之,我们的研究首次表明人GATA-1蛋白对于人间质细胞的增殖有一定的抑制作用,从而在Rylski等[20]的研究基础上进一步拓宽了GATA-1的功能,他们在2003年发现GATA-1在红系成熟过程中抑制细胞的增殖。
对过表达GATA-1的HFF细胞的进一步分析表明,间质细胞形态未发生改变,表达CD90、CD29的比例亦未发生改变。考虑到造血、间质在胚胎发育和造血发育过程中具有密切关系[21-23],我们实验室此前的研究也首次表明在胚胎发育过程中,CD41+的永久造血细胞具有向成纤维细胞分化的潜能[24],因此我们推测,GATA-1可能在造血早期发育过程中,抑制与造血细胞存在密切关系的非造血细胞(如内皮细胞和间质细胞)的增殖和产生,但在造血发育后期,则抑制成熟血细胞的进一步增殖和扩增[20]。但GATA-1抑制间质细胞增殖的机制仍然需要我们进一步深入研究。

图7 HFF-GATA1稳定转染细胞的流式检测
[1]Pevny L,Simon M C,Robertson E,et al.Erythroid differentia⁃tion in chimaeric mice blocked by a targeted mutation in the gene fortranscription factorGATA-1[J].Nature,1991,349(6306):257-260.
[2]Fujiwara Y,Browne C P,Cunniff K,et al.Arrested develop⁃ment of embryonic red cell precursors in mouse embryos lack⁃ing transcription factor GATA-1[J].Proc Natl Acad Sci USA,1996,93(22):12355-12358.
[3]Weiss M J,Keller G,Orkin S H.Novel insights into ery⁃throid development revealed through in vitro differentiation of GATA-1 embryonic stem cells[J].Genes Dev,1994,8(10):1184-1197.
[4]Stachura D L,Chou S T,Weiss M J.Early block to erythro⁃megakaryocytic development conferred by loss of transcription factor GATA-1[J].Blood,2006,107(1):87-97.
[5]Weiss M J,Orkin S H.Transcription factor GATA-1 permits survival and maturation of erythroid precursors by preventing apoptosis[J].Proc Natl Acad Sci USA,1995,92(21):9623-9627.
[6]Yu C,Cantor A B,Yang H,et al.Targeted deletion of a high-affinity GATA-binding site in the GATA-1 promoter leads to selective loss of the eosinophil lineage in vivo[J].J Exp Med,2002,195(11):1387-1395.
[7]Shivdasani R A,Fujiwara Y,McDevitt M A,et al.A lin⁃eage-selective knockout establishes the critical role of tran⁃scription factor GATA-1 in megakaryocyte growth and plate⁃let development[J].EMBO J,1997,16(13):3965-3973.
[8]Migliaccio A R,Rana R A,Sanchez M,et al.GATA-1 as a regulator of mast cell differentiation revealed by the pheno⁃type of the GATA-1low mouse mutant[J].J Exp Med,2003,197(3):281-296.
[9]Iwasaki H,Mizuno S,Wells R A,et al.GATA-1 converts lymphoid and myelomonocytic progenitors into the megakaryo⁃cyte/erythrocyte lineages[J].Immunity,2003,19(3):451-462.
[10]Doré L C,Crispino J D.Transcription factor networks in ery⁃throid cell and megakaryocyte development[J].Blood,2011,118(2):231-239.
[11]金呈强,刘仿.转录因子GATA-1的研究进展[J].国际免疫学杂志,2009,32(1):47-51.
[12]Paprocka M,Krawczenko A,Dus D,et al.CD133 positive progenitor endothelial cell lines from human cord blood[J].Cy⁃tometry A,2011,79(8):594-602.
[13]Lippross S,Loibl M,Hoppe S,et al.Platelet released growth factors boost expansion of bone marrow derived CD34(+)and CD133(+)endothelial progenitor cells for autologous grafting[J].Platelets,2011,22(6):422-432.
[14]Yang H Y,Kim S H,Kim S H,et al.The suppression of zf⁃pm-1 accelerates theerythropoieticdifferentiation of human CD34+cells[J].Biochem Biophys Res Commun,2007,353(4):978-984.
[15]Miccio A,Blobel G A.Role of the GATA-1/FOG-1/NuRD pathway in the expression of human β-like globin genes[J].Mol Cell Biol,2010,30(14):3460-3470.
[16]Kadri Z,Shimizu R,Ohneda O,et al.Direct binding of pRb/E2F-2 to GATA-1 regulates maturation and terminal cell divi⁃sion during erythropoiesis[J].PLoS Biol,2009,7(6):e1000123.
[17]Zhou J,Zhao L,Qin L P,etal.Epimorphin regulates WB-F344 cells,rat liver epithelial(stem-like)cells,in duct formation via effects on the cells'mitosis orientation[J],PLoS One,2010,5(3):e9732.
[18]Jia Y L,Shi L,Zhou J N,et al.Epimorphin promotes hu⁃man hepatocellular carcinoma invasion and metastasis through activation of focal adhesion kinase/extracellular signal-regulat⁃ed kinase/matrix metalloproteinase-9 axis[J].Hepatology,2011,54:1808-1818.
[19]Yamaguchi Y,Zon L I,Ackerman S J,et al.Forced GA⁃TA-1 expression in the murine myeloid cell line M1:induc⁃tion of c-Mpl expression and megakaryocytic/erythroid differen⁃tiation[J].Blood,1998,91(2):450-457.
[20]Rylski M,Welch J J,Chen Y Y,et al.GATA-1-mediated proliferation arrest during erythroid maturation[J].Mol Cell Bi⁃ol,2003,23:5031-5042.
[21]Dominici M,Pritchard C,Garlits J E,et al.Hematopoietic cells and osteoblasts are derived from a common marrow pro⁃genitor after bone marrow transplantation[J].Proc Natl Acad Sci USA,2004,101(32):11761-11766.
[22]LaRue A C,Masuya M,Ebihara Y,et al.Hematopoietic ori⁃gins of fibroblasts:I.In vivo studies of fibroblasts associated with solid tumors[J].Exp Hematol,2006,34(2):208-218.
[23]Ebihara Y,Masuya M,Larue A C,et al.Hematopoietic ori⁃gins of fibroblasts:II.In vitro studies of fibroblasts,CFU-F,and fibrocytes[J].Exp Hematol,2006,34(2):219-229.
[24]Zhou J,Chen H,Li S,et al.Fibroblastic potential of CD41+cells in the mouse aorta-gonad-mesonephros region and yolk sac[J].Stem Cells Dev,2012;21(14):2592-2605.

