芽胞杆菌菌体蛋白提取方法的比较
胡桂萍 ,贾宪波 ,刘波 ,尤民生
1.福建农林大学 应用生态研究所,福建 福州 350002;2.福建省农业科学院 农业生物资源研究所,福建 福州 350003
芽胞杆菌(Bacillus spp.)为好氧或兼性厌氧的杆菌,一般为革兰染色阳性,对高温、放射线和有毒有害化学物质等外界有害因子有很强的抵抗力,广泛分布于土壤、水、空气及动物肠道等处。芽胞杆菌处于不良环境时,细菌细胞质高度浓缩脱水形成芽胞,这是一种抗逆性很强的球形或椭圆形的休眠体,休眠体内富含大量耐热的小分子酶类、特殊的吡啶二羧酸钙和带有二硫键的蛋白质,且具有多层次厚而致密的芽胞壁,代谢作用缓慢,却具有潜在的萌发力,是抗逆性最强的生命体[1]。
研究表明,芽胞杆菌芽胞的形成、强抗逆性及高抗病性都与其胞内相关蛋白的调控表达有关。如SpoIIE蛋白在芽胞隔膜形成的主要作用因子通过激活转录因子Sigma F,诱导特异性前孢子的表达[2]。炭疽芽胞杆菌(B.anthracis)中的Spo0B具有组氨酸激酶和ATP酶活性,通过核苷二磷酸激酶表达诱导核苷三磷酸核苷二磷酸脱磷酸,从而调控芽胞初始形成过程及抗病作用[3]。嗜冷芽胞杆菌(B.psychro⁃saccharolyticus)中的Hsp33蛋白具有调控有机溶剂降解基因的作用[4]。通过低温诱导高温厌氧细菌嗜热脂肪芽胞杆菌(B.stearothermophilus)TLS33可得到葡糖基转移酶、抗Sigma B因子、Mrp蛋白质同簇体、二氢乳清酸酶、FeuA-SigW基因转录调节器、RibT蛋白质、磷酸腺苷磷酰硫酸还原酶和特异性前孢子转录RsfA激酶共8个相关蛋白,但其中6个参与了芽胞杆菌芽胞形成信号转导途径[5]。重组苏云金芽胞杆菌(B.thuringiensis)中SLH-Ap36融合蛋白的表达可增强其抗病性[6]。芽胞杆菌产芽胞过程中还伴随产生大量代谢物、酶类、伴胞晶体等,这些物质对环境中的污染物[7]、有机物和害虫等具有降解和毒害作用[8,13-15]。因此,加大对芽胞杆菌蛋白质的研究力度和深度,有助于芽胞杆菌资源的开发和利用。
芽胞杆菌胞壁较厚,易形成芽胞,蛋白提取过程中存在细胞壁破碎困难、破碎不完全、蛋白提取率低等问题,故应进行蛋白破碎提取方法的摸索。我们以具有农药降解和生物修复功能的巨大芽胞杆菌(B.megaterium)、球形芽胞杆菌(B.sphaericus)和弯曲芽胞杆菌(B.flexus)为材料,比较了沸水浴、超声波和机械破碎作用下提取的菌体蛋白的含量和质量,建立了芽胞杆菌菌体蛋白高效破碎提取方法,为进一步深入研究上述3种芽胞杆菌的农药降解机理奠定了基础,也可为类似革兰阳性菌菌体蛋白的提取提供参考。
1 材料与方法
1.1 材料
巨大芽胞杆菌、球形芽胞杆菌、弯曲芽胞杆菌是本实验室研究人员从菊酯类农药土中筛选到的菊酯类农药降解菌。SDS(十二烷基磺酸钠),丙烯酰胺,Bis(N,N'-亚甲基双丙烯酰胺),Tris(三羟甲基氨基甲烷),甘氨酸,盐酸,过硫酸氨,TEMED(四甲基乙二胺),蛋白分子量标准,溴酚蓝,甘油,冰醋酸,乙醇,β-巯基乙醇,考马斯亮蓝R250,甲醇,乙醇。iMark680酶标仪、Bio-Rad小垂直板电泳仪(Bio-Rad公司);ImageScannerIII扫描仪(GE公司);SPW-10TJ型超低细菌型超纯水器(上海赛鸽电子科技有限公司)。
1.2 菌体培养
从-80℃冰箱中取出巨大芽胞杆菌和球形芽胞杆菌菌种,在含农药甲黄隆(MSM)的基础培养基上活化[9],置30℃恒温培养箱中培养24 h,挑取单菌落转入含农药MSM的液体培养基中,30℃、170 r/min培养10 h,4℃、6000 r/min离心10 min,收集菌体;用10倍体积的0.85%生理盐水悬浮菌体,10 000 r/min、4℃离心10 min,清洗培养基中的杂蛋白,重复3次。
1.3 蛋白破碎提取
1.3.1 沸水浴破碎提取法 取2 mL细菌悬液,加入0.1 g/mL SDS溶液2 mL,沸水浴10 min,10 000 r/min离心10 min,取上清液贮存于-20℃。
1.3.2 超声波破碎提取法 取2 mL细菌悬液,置冰浴中超声波破碎,超声波功率为500 W,工作3 s、间歇2 s,破碎30 min,10 000 r/min离心10 min,取上清液贮存于-20℃。
1.3.3 机械破碎提取法 取1 g湿菌体中加入10 mL裂解液并使其悬浮,加入少量玻璃珠,采用QIA⁃GEN tissuselyserⅡ破碎仪破碎5 min,频率为30/s,10 000 r/min离心10 min,取上清液贮存于-20℃。
1.4 细菌裂解程度观察
分别取破碎后的菌悬液,稀释,涂片,固定,进行革兰染色,于100倍油镜下观察,并采集观察结果。
1.5 蛋白的SDS-PAGE
采用Bio-Rad小垂直板电泳仪对蛋白样品进行SDS-PAGE,分离胶浓度为12%,浓缩胶浓度为4%。采用银染法进行凝胶染色,凝胶用Epson Ex⁃pression 10000XL扫描仪扫描,用Quantity One软件进行图像分析。
1.6 蛋白含量测定
用改良型Bradford法蛋白质浓度测定试剂盒测定可溶性全细胞蛋白。采用酶标法,分别配置蛋白含量为0、100、150、200、250、300 μg/L时,考马斯亮蓝G-250与蛋白结合物的D595nm值与蛋白质含量呈线性关系,故可用于测定蛋白质含量。考马斯亮蓝法测定蛋白质含量的标准曲线方程为A=0.0022C+0.3136(r2=0.9912),其中A为吸光度值,C为蛋白浓度。可溶性全细胞蛋白提取量用单位体积(mL)菌液中所含的蛋白质质量(mg)表示。
2 结果
2.1 不同破碎方法下芽胞杆菌的破碎程度分析
与对照相比,巨大芽胞杆菌、球形芽胞杆菌和弯曲芽胞杆菌经沸水浴、玻璃珠机械破碎和超声波破碎后,都出现了不同程度的菌体碎片,但破碎程度差异明显。玻璃珠机械破碎对3种芽胞杆菌细胞的破坏程度最强,完整形态细胞最少;超声波破碎对细胞的破坏程度稍弱;而沸水浴对细胞形态的破坏最差,完整结构的细胞数量最多。
2.2 不同破碎方法获得的芽胞杆菌菌体蛋白的SDS-PAGE分析
芽胞杆菌菌体蛋白的SDS-PAGE图谱见图2,用不同破碎方法得到的蛋白图谱存在差异。机械破碎提取的蛋白图谱条带最多,最为清晰,着色较深,菌株重复性很好。巨大芽胞杆菌的蛋白谱带为30~32条,相对分子质量(Mr)为16×103~200×103;球形芽胞杆菌蛋白谱带为 24~26条,Mr为 18×103~190×103;弯曲芽胞杆菌蛋白谱带为 28~31 条,Mr为 18×103~180×103。超声波破碎提取的蛋白条带较模糊,效果不稳定,重复性不好。用该方法提取的巨大芽胞杆菌的蛋白谱带为 15~20 条,Mr为 15×103~180×103;球形芽胞杆菌蛋白谱带为13~15条,Mr为18×103~160×103;弯曲芽胞杆菌蛋白谱带为 13~15 条,Mr为 20×103~150×103。沸水浴提取的蛋白图谱不仅条带少、很模糊,同时重复性很差。
2.3 不同破碎方法获得的芽胞杆菌菌体蛋白的浓度比较
将D600nm为2.0的3种细菌菌液各取50 mL,比较不同破碎方法获得的菌体蛋白的浓度,结果见表1。机械破碎方法得到的3种细菌的蛋白浓度均为最高,巨大芽胞杆菌、球形芽胞杆菌、弯曲芽胞杆菌蛋白浓度分别为20.247、19.902和18.893 mg/mL;其次是超声波破碎提取的菌体蛋白浓度,依次分别为10.572、9.438和 10.424 mg/mL;沸水浴破碎提取的效果最差,蛋白提取率很低,蛋白浓度依次仅分别为1.366、1.119和1.136 mg/mL。
3 讨论
虽然已有很成熟的蛋白提取方法,但从极端环境中分离的芽胞杆菌具有抗逆和易产芽胞的特点,实验室常规方法不一定适用。因此,针对产芽胞这一类革兰阳性菌,直接使用某一常规方法提取蛋白常得不到理想结果[17-18]。蛋白提取的关键步骤是细胞破碎和蛋白质溶解,不同破碎方法提取的蛋白质效果不同[10]。细菌裂解后释放至胞体内及膜上的蛋白质比例与裂解程度相关,裂解率越高,释放的蛋白质页越多,此时细胞结构越不完整,可通过细胞染色电镜观察来指示细胞的破碎程度[11]。
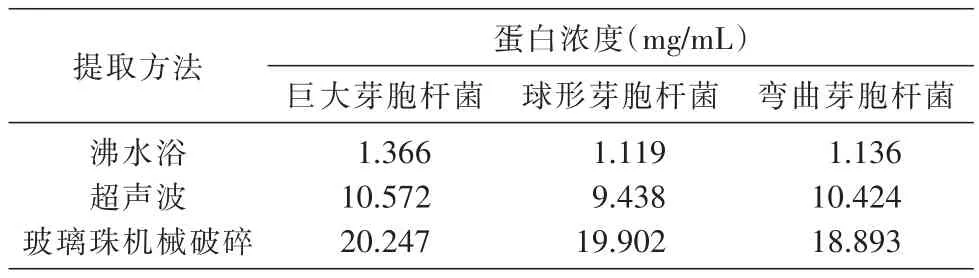
表1 不同破碎方法所得菌体蛋白的浓度

图1 不同破碎方法处理的芽胞杆菌革兰染色(×1000)
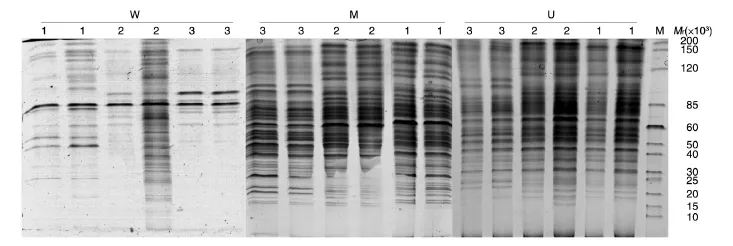
图2 不同破碎方法提取的芽胞杆菌蛋白质的SDS-PAGE
细菌细胞破碎方法主要有超声波、高压匀浆、研磨、高速珠磨、酶溶、有机溶剂渗透、低渗裂解等[16-18],各具优劣。酶溶、有机溶剂渗透、低渗裂解主要是加入一些降解细胞壁成分的物质,如溶菌酶等,有很好的裂解作用,但容易将外源蛋白引入样本,影响样本蛋白质的后期分析;而超声波、高压匀浆、研磨、高速珠磨方法主要通过机械方式破坏细胞壁,不会将外源物质引入样本,有利于蛋白质组的研究,但裂解程度一般[12]。巨大芽胞杆菌和球形芽胞杆菌为革兰阳性菌,细胞壁难以破碎,因此宜采用较为剧烈的方法裂解。本实验分别采用超声波、沸水浴和玻璃珠机械破碎法提取芽胞杆菌蛋白,通过SDS-PAGE分析和Bradford法定量,发现用玻璃珠机械破碎方式提取的蛋白浓度高,重复性好。与其他方法相比,用玻璃珠机械破碎方式得到的蛋白条带多,谱图全,提取率高。用超声波破碎芽胞杆菌,存在超声声频和声能及超声时间的影响,频率太低超声空化引起的冲击波和剪切力不足,芽胞杆菌细胞壁破碎不彻底,蛋白提取不充分;超声强度太大,容易使溶液产生泡沫,易导致蛋白质变性。沸水浴易使蛋白变性,即使细胞破碎完全,蛋白的提取率还是很低。因此,通过玻璃珠机械破碎提取芽胞杆菌的蛋白质效果最好,可用于芽胞杆菌等革兰阳性菌的蛋白质组学研究。
[1]Ivanova E P,Vysotskii M V,Svetashev V I,et al.Character⁃ization of Bacillus strains of marine origin[J].Internatl Micro⁃bial,1999,2:267-271.
[2]Barák I,Behari J,Olmedo G,et al. Structure and function of the Bacillus SpoIIE protein and its localization to sites of sporulation septum assembly[J]Mol Microbiol, 1996,19(5):1047-1060.
[3]Mattoo A R,Saif Zaman M,Dubey G P,et al.Spo0B of Ba⁃cillus anthracis- a protein with pleiotropic functions[J].FEBS J,2008,275(4):739-752.
[4]Kang H J,Heo D H,Choi S W,et al.Functional character⁃ization of Hsp33 protein from Bacillus psychrosaccharolyticus;additional function of HSP33 on resistance to solvent stress[J].Biochem Biophys Res Commun,2007,358(3):743-750.
[5]Supachai T,Supachok S,Boonyaras S,et al.Functional pro⁃teomics and correlated signaling pathway of the hermophilic bacterium Bacillus stearothermophilus TLS33 under cold-shock stress[J].Proteomics,2005,5:4456-4471.
[6]Peng D,Zhou C,Qiu D,et al.Expressing activator protein Ap36 in Bacillus thuringiensis and the function of the recom⁃bined strain on disease resistance[J].Chin J Agr Biotechnol,2008,5(2):121-126.
[7]于婷,尚玉珂,李艳芳,等.短小芽胞杆菌BSH-4抗菌物质的提取及其特性[J].植物保护学报,2009,36(1):65-69.
[8]黄曦,许兰兰,黄荣韶,等.枯草芽胞杆菌在抑制植物病原菌中的研究进展[J].生物技术通报,2010,(1):24-29.
[9]Shaohua C,Meiying H,Jingjing L,et al.Biodegradation of be⁃ta-cypermethrin and 3-phenoxybenzoic acid by a novel Ochro⁃bactrum lupini DG-S-01[J].J Hazardous Materials,2011,187:433-440.
[10]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000.
[11]鲁子贤.蛋白质和酶学研究方法[M].北京:科学出版社,1989.
[12]成海平,钱小红.蛋白质组研究的技术体系及其进展[J].生物化学与生物物理进展,2000,27(6):584-588.
[13]陈雪丽,王光华,金剑,等.多粘类芽胞杆菌BRF-1和枯草芽胞杆菌BRF-2对黄瓜和番茄枯萎病的防治效果[J].中国生态农业学报,2008,16(2):446-450.
[14]周雪莹,李辉,连宾.胶质芽胞杆菌胞外多糖在肥料矿物分解转化中的作用[J].矿物岩石地球化学通报,2010,29(1):63-66.
[15]Ralf M,Ignacija V,Günther R,et al.Nicholson Role of al⁃tered rpoB alleles in Bacillus subtilis sporulation and spore resistance to heat,hydrogen peroxide,formaldehyde,and glutar⁃aldehyde[J].Arch Microbiol,2012,194(9):759-767.
[16]夏其昌,曾嵘.蛋白质化学与蛋白质组学[M].北京:科学出版社,2004.
[17]张国强,樊明涛,刘晓娇,等.酒酒球菌蛋白质提取方法研究[J].中国酿造,2010,29(9):39-41.
[18]袁亚宏,刘晓珂,岳田利,等.酸土脂环酸芽胞杆菌可溶性全细胞蛋白提取工艺优化[J].农业机械学报,2010,43(6):139-146.

