敲低GATA1慢病毒表达载体的构建及敲低效果检测
张亚楠,刘婕,林娅红,周蕾,丁丽华,叶棋浓
军事医学科学院 生物工程研究所,北京 100850
GATA1是转录因子GATA蛋白家族成员,1991年被首次发现报道。GATA1可以与[T/A(GATA)A/G]序列结构特异结合,随后GATA2~GATA6逐一被报道,形成GATA家族。GATA1是造血系统特有的转录因子,为正常红细胞发育所必需,不仅存在于红系细胞中,在巨核细胞系和肥大细胞系中也有很高的含量[1-2]。GATA1调控红细胞的分化和成熟,在巨核细胞分化发育过程中具有多功能性,可影响细胞生长发育和成熟。同时,GATA1的点突变可导致白血病的发生,GATA1与伴有严重贫血的多发性骨髓瘤也有密切关系[3]。由此可见,GATA1在造血细胞系中有很高的含量,与很多血液系统疾病的发生有着密切的联系,也与人类身体健康息息相关[4]。我们的研究表明,GATA1在除了造血系统和免疫系统细胞中表达外,在其他类型的细胞中(如本文的人胚肾细胞)也有表达,提示GATA1在实体肿瘤中也有作用。由于GATA1在实体瘤中的作用只在乳腺癌中有所报道,因此深入研究GATA1在实体肿瘤中的功能及其分子机制具有十分重要的意义。
我们用构建慢病毒载体的小发夹RNA(shRNA)技术抑制GATA1的表达,与普通转染方法相比能获得更高的感染效率,以便为GATA1的后续研究奠定一定的基础。
1 材料与方法
1.1 材料
人胚肾293T细胞由本实验室保存;大肠杆菌DH5α感受态细胞、转染试剂LipofectAMINE 2000、TRIzol均购自Invitrogen公司;DMEM培养基和胎牛血清购自GIBCO公司;慢病毒表达载体购自SBI公司,包含pSIH1-H1-Puro载体和pPack Packaging Plasmid Mix载体;限制性内切酶、DNA连接酶、反转录酶、实时定量PCR试剂均购自TaKaRa公司;质粒提取试剂盒为Promega公司产品;兔抗人GATA1抗体购自Abcam公司;兔抗人GAPDH和辣根过氧化物酶偶联的IgG均购自Santa Cruz公司;引物由北京赛百盛生物有限公司合成;质粒测序分析由北京博迈德科技发展有限公司完成;实时定量PCR仪为ABI PRISM 7000型。
1.2 shRNA慢病毒载体的构建
根据shRNA靶序列筛选设计原则,结合人GATA1的基因序列和网站分析,选择确定一条特异性shRNA靶序列。利用NCBI数据库对确定的靶序列进行Blast分析,证明与其他已知基因没有同源性,然后设计合成寡核苷酸的正义链和反义链进行退火处理,即先将其分别溶于双蒸水中,等摩尔数混合后95℃加热5 min,自然降温至37℃,形成双链的寡核苷酸。将退火的shRNA序列插入经酶切的pSIH1-H1-Puro载体,连接产物转化大肠杆菌DH5α感受态细胞,挑取单克隆测序验证。GATA1 shRNA的上游序列为5'-TAGTG CTTATGGGGGCCCTGACTTT-3',下游序列为5'-AA AGTCAGGGCCCCCATAAGCACTA-3'。
1.3 质粒瞬时转染293T细胞
细胞用含10%新生牛血清和双抗的DMEM培养基培养,用不含双抗、含10%胎牛血清的DMEM培养基将人胚肾293T细胞接种于12孔板中,接种量以转染时细胞密度达到80%为宜,培养24 h后进行转染。将总量2 μg的质粒与50 μL无血清无抗生素的DMEM培养基混合,再将1 μL Vigorous与50 μL无血清无抗生素的DMEM培养基混合,然后将上述2种溶液轻轻混合,室温放置15 min,加入12孔板中,37℃、5%CO2常规培养48 h后收获细胞。
1.4 Western印迹
人胚肾293T细胞转染48 h后收集细胞,加入SDS-PAGE加样缓冲液,煮沸15 min,离心后取上清液进行SDS-PAGE,电泳结束后转移至硝酸纤维膜上,用5%脱脂奶粉于4℃封闭过夜,然后用以5%脱脂奶粉稀释的抗GATA1多克隆抗体室温轻摇1 h,TBST洗膜3次,每次6 min;加入用5%脱脂奶粉稀释的辣根过氧化物酶偶联的羊抗兔IgG,室温轻摇1 h,TBST洗膜3次,每次6 min;用化学发光法显色5 min,压片显影。
1.5 细胞RNA提取和RT-PCR检测
转染48 h后收集人胚肾293T细胞,加入TRIzol提取细胞总RNA,取2 μg进行反转录,得到cDNA第一链,以之为模板,用实时定量PCR仪分别扩增GATA1 cDNA[引物为 Forward(5'-TGGAGACTTTG AAGACAGAGCGGCTGAG-3')和 Reverse(5'-GAAG CTTGGGAGAGGAATAGGCTGCTGA-3')]和 β-actin内参基因[引物为Forward(5'-ATCACCATTGGCA ATGAGCG-3')和 Reverse(5'-TTGAAGGTAGTTTC GTGGAT-3')],并收集荧光信号,用 2-ΔΔCt方法进行基因相对表达分析。
2 结果
2.1 GATA1 siRNA慢病毒载体的构建
将合成的2条引物进行退火处理后,将退火产物和2条引物一起进行琼脂糖凝胶电泳(图1),结果显示退火产物的条带水平位置位于2条引物的上方,证明退火成功。转化后挑取GATA1 siRNA慢病毒载体克隆,DNA测序结果显示GATA1 siRNA序列已插入pSIH1-H1-Puro载体,序列与预期完全一致(图2),证明GATA1 siRNA表达载体构建成功。
2.2 GATA1 siRNA对GATA1基因表达的影响
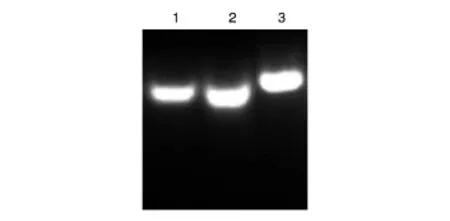
图1 GATA1 siRNA退火结果

图2 GATA1 siRNA慢病毒载体的测序结果
在有内源性GATA1表达的293T细胞中,分别转染GATA1 siRNA及对照siRNA,48 h后收集蛋白,用GATA1抗体进行Western印迹(图3)。结果表明,与对照组相比,GATA1 siRNA能明显抑制内源性GATA1的表达,而同时用GAPDH抗体检测并没有明显的改变。由此可见,所设计的GATA1 siRNA能够有效降低GATA1基因的表达。
2.3 GATA1 siRNA对GATA1基因转录水平的影响
在有内源性GATA1表达的293T细胞中,分别转染GATA1 siRNA及对照siRNA,48 h后收取细胞提取细胞总RNA,利用RT-PCR鉴定GATA1 siRNA的抑制效果(图4)。RT-PCR结果表明,与对照组相比,GATA1 siRNA转染组的mRNA水平显著降低,说明构建的GATA1 siRNA能够有效抑制293T细胞GATA1基因的转录水平。

图3 Western印迹检测GATA1 siRNA的敲低效果

图4 RT-PCR检测GATA1 siRNA的敲低效果
3 讨论
RNA干扰(RNAi)是近年发现的在生物体内普遍存在的一种古老的生物学现象,是由双链RNA介导的、由特定酶参与的特异性基因沉默现象,它在转录水平、转录后水平和翻译水平上阻断基因的表达。慢病毒载体是源于人免疫缺陷病毒1(HIV-1)的一种病毒载体,包含了包装、转染、稳定整合所需要的遗传信息。携带外源基因的慢病毒载体在慢病毒包装质粒、细胞系的辅助下,经过病毒包装成为有感染力的病毒颗粒,通过感染细胞或活体组织,实现外源基因在细胞或活体组织中的表达。将慢病毒载体作为siRNA的携带者,不但具备特异性的使基因表达沉默的能力,还能充分发挥自身所具备的优势。实验证实,我们所构建的GATA1 siRNA慢病毒表达载体具有显著的干扰效果。
转录因子GATA1在正常红细胞增殖、分化过程中起重要的生物学作用,且控制着巨核细胞、肥大细胞核嗜酸性细胞的分化。GATA1可以和许多生物大分子相互作用[5],在血小板减少症、多发性骨髓瘤、白血病等疾病中发挥重要的生物学效应[6-7]。实验证实,我们构建的GATA1 siRNA慢病毒表达载体可以降低GATA1基因的表达水平,同时也能有效抑制GATA1的转录水平。GATA1作为一个潜在的癌基因,在诸多血液疾病中发挥重要作用,可能成为肿瘤基因治疗的靶标[8-9]。但是,GATA1在实体肿瘤中的作用还很不清楚。综上,GATA1 siRNA慢病毒载体的成功构建,为进一步研究GATA1多方面的功能打下了坚实的基础。
[1]Joan B,Peter B,Yoshihiro N,et al.Regulation of activity of the transcription factor GATA-1 by acetylation[J].Nature,1998,396(6711):594-598.
[2]冯雪梅,祝彼得.GATA-1的研究现状[J].四川医学,2006,27(2):132-134.
[3]吴秀丽,李扬秋.转录因子GATA-1在造血系统中的作用(综述)[J].暨南大学学报(医学版),2002,23(6):21-26.
[4]Benjamin D,Joanna K,Laura G,et al.Vegf regulates embry⁃onic erythroid development through Gata1 modulation[J].Blood,2010,116(12):2141-2151.
[5]Christiane L B,Milton A E,Jagman C,et al.Differential re⁃quirement for Gata1 DNA binding and transactivation between primitive and definitive stages of hematopoiesis in zebrafish[J].Blood,2009,114(25):5162-5172.
[6]Boidot R,Vegtan F,Jacob D,et al.The transcription factor GATA-1 is overexpressed in breast carcinomas and contrib⁃utes to survivin upregulation via a promoter polymorphism[J].Oncogene,2010,29(17):2577-2584.
[7]Rena Z,Gerd A.GATA transcription factors and cancer[J].Genes Cancer,2011,1(12):1178-1188.
[8]Rita F,Kinuko O,Masayuki Y,et al.GATA1 function,a par⁃adigm for transcription factors in hematopoiesis[J].Mol Cell Bi⁃ol,2005,25(4):1215-1227.
[9]Wendy A C,Wendy H R,Melissa A K.Human phenotypes associated with GATA-1 mutations[J].Genes,2008,427(1-2):1-6.

