检测HSA-GLP-1融合蛋白双抗体夹心ELISA方法的建立
王秋实 ,刘运龙 ,张玉民 ,陈知航 ,钱爱东 ,程远国
1.吉林农业大学,吉林 长春 130118;2.军事医学科学院 微生物流行病研究所,北京 100071;3.延边大学,吉林 延吉 133000
糖尿病已成为世界上继肿瘤、心脑血管病之后第三位严重危害人类健康的慢性疾病。糖尿病主要分为1型和2型,90%以上为2型糖尿病。2型糖尿病患者多存在胰岛素抵抗和胰岛素分泌不足两方面异常[1]。胰高血糖素样肽-1(glucagon-like peptide 1,GLP-1)是回肠内分泌细胞分泌的一种肽类激素,由30个氨基酸残基组成[2],具有多种生理功能[3-6],如延迟胃排空及延缓小肠蠕动;促进糖原合成,抑制脂肪的形成;血糖依赖性地促进胰岛素的释放,促进胰岛素原合成,抑制胰高血糖素合成,促进β细胞修复与增殖;抑制食欲产生饱腹感等。目前,GLP-1及其类似物是研究非胰岛素依赖糖尿病治疗的热点。
然而,GLP-1在人体血循环中易被二肽酶Ⅳ降解而失去活性,导致GLP-1的体内半衰期不足2 min,因而限制了其在临床中的直接应用。为此,阻断或延缓GLP-1类药物的降解,延长其半衰期,是GLP-1类似物药物应用于临床的研发关键点之一。目前已建立的改善蛋白质药物半衰期的技术包括蛋白药物的化学修饰、蛋白质融合、微囊化/纳米粒、糖基化、构建抗蛋白酶突变体等[7]。人血清白蛋白(hu⁃man serum albumin,HSA)融合技术是一种新型的长效给药平台技术。HSA在人体中的半衰期达20 d,将GLP-1与HSA融合后获得的融合蛋白保留了GLP-1的生物活性,其在体内的半衰期也显著延长。
本课题旨在建立一种高灵敏的双抗夹心酶联免疫吸附测定(ELISA)法,能精确检测HSA-GLP-1融合蛋白的浓度。这种测定方法安全、高效、简便,可应用于融合蛋白药代动力学检测及分析。
1 材料和方法
1.1 材料
HSA-GLP-1(20111103-1,江苏泰康生物医药有限公司);GLP-1单抗(HYB147-12,Antibodyshop公 司);anti-HSA-biotin(ab31898,Abcam 公 司);HRP-Strep(DY998,RD公司);TMB单组分显色液(PR1200,上海索莱宝有限公司);96孔板(Costar公司);酶标仪(M550,BIO-RAD公司);微量移液器(Eppendorf公司);涡旋震荡器(上海海门仪器)等。
1.2 检测方法
①包被:用pH7.4的PBS缓冲液包被GLP-1单克隆抗体,4℃过夜;②封闭:用洗液洗板3次,拍干酶联板,加3%BSA封闭液200 μL,室温封闭2 h;③加样:用洗液洗板4次,拍干酶联板,每孔加100 μL用20%猴空白血清稀释至不同浓度的HSA-GLP-1融合蛋白和待测样品,室温孵育1 h;④加二抗:用洗液洗板4次,拍干酶联板,每孔加100 μL anti-HSA-biotin,室温孵育 1 h;⑤免疫放大:用洗液洗板4次,拍干酶联板,每孔加100 μL HRPStrep,室温孵育20 min;⑥显色:用洗液洗板6次,拍干酶联板,每孔加100 μL TMB,室温孵育20 min;⑦终止:加终止液,30 min内读取D450nm值。
2 结果
2.1 抗体配对
鼠抗人 GLP-1单抗 ABS033-10、ABS046-03、HYB147-12分别作为捕捉抗体,anti-HSA-biotin作为检测抗体。经过筛选捕捉抗体工作浓度和检测抗体工作浓度,进而选择最佳浓度;将HSA-GLP-1融合蛋白稀释至2 μg/mL,然后按1/4梯度稀释至0.5 ng/mL,设空白孔作为本底。结果见表1、图1,最终GLP-1单抗选择HYB147-12包被酶标板。
2.2 抗体滴度的选择
GLP-1(HYB147-12)一抗选择 5、8 μg/mL,an⁃ti-HSA-biotin选择 1∶2000、1∶5000,HRP 标记的亲和素选择1∶200的免疫信号放大,比较2个抗体滴度的配对效果,结果见表2,最终GLP-1单抗选择8μg/mL包被酶标板,anti-HSA-biotin选择1∶2000。
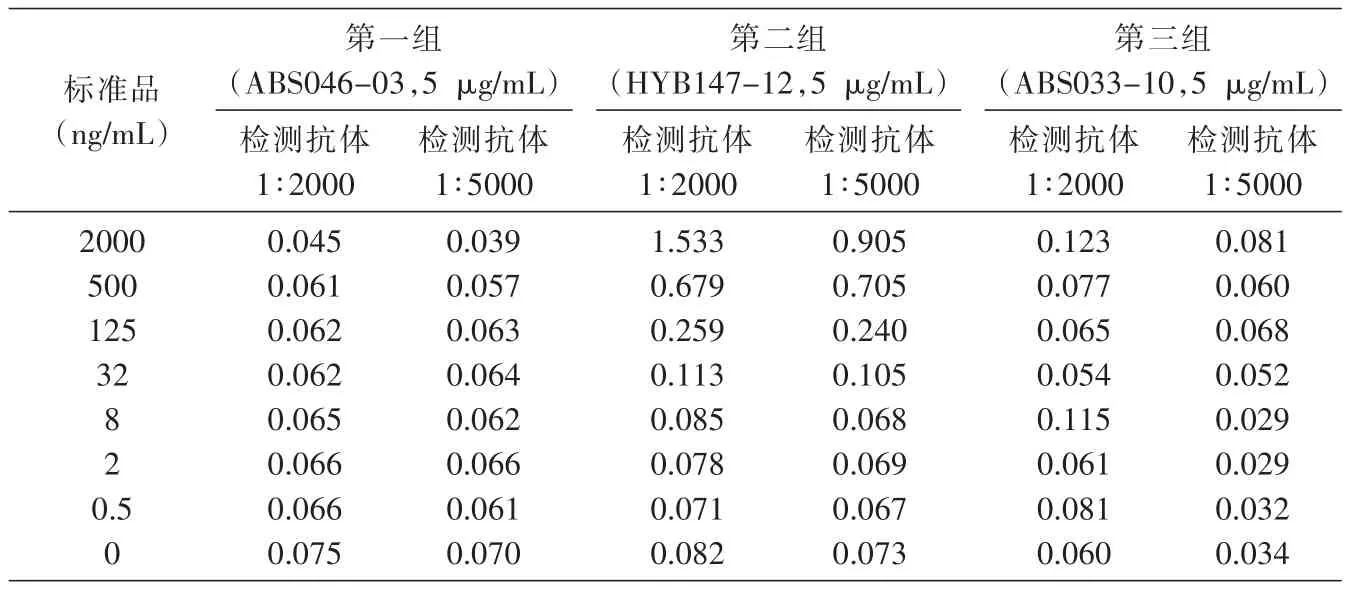
表1 抗体配对结果(D450nm)
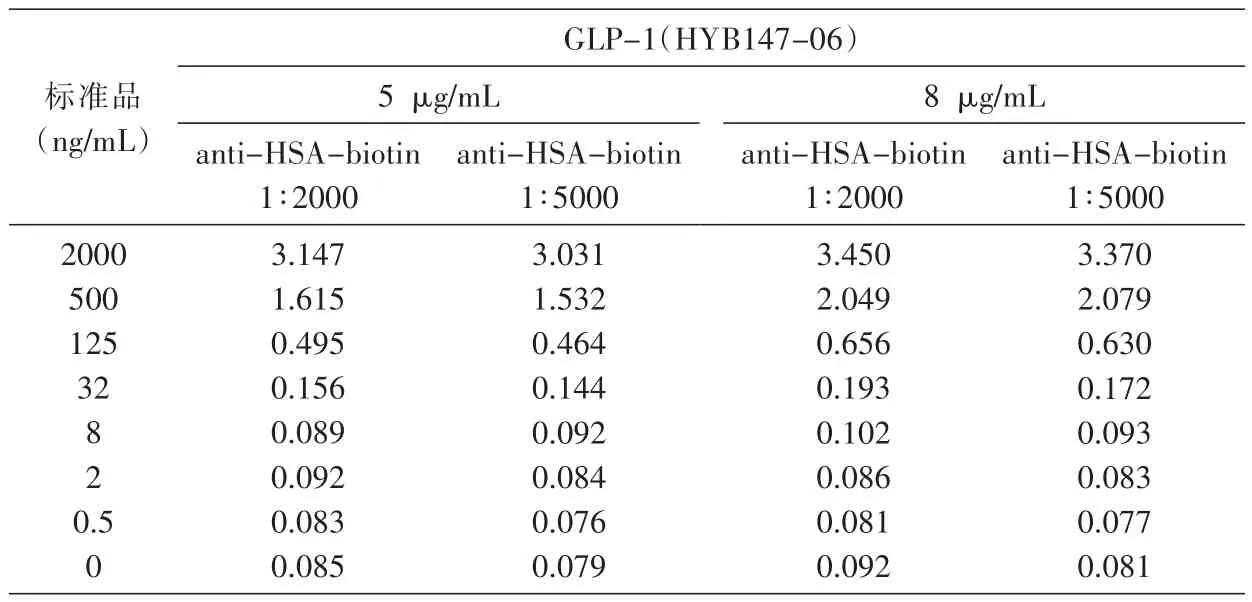
表2 GLP-1单抗与anti-HSA-biotin检测抗体的抗体滴度(D450nm)
2.3 标准曲线的建立
将标准品HSA-GLP-1融合蛋白用20%猴血清稀释至 1000、500、250、125、62.5、31.25 及 15.6 ng/mL,取100 μL样品,按上述测定方法检测。以D450nm值为纵坐标、各标准浓度为横坐标,对其进行四参数回归,所得回归方程即为HSA-GLP-1融合蛋白的标准曲线(表3、图3)。经四参数Logistic函数模型拟合,求得曲线斜率、IC50及上下端渐进线间的近线性范围。其数学模型为:

其中A1为S状曲线下端渐进线的估计值,A2为S状曲线上端渐进线的估计值,P为校正曲线的斜率,X0(IC50)为50%吸光度所对应的样品浓度值。含量超出上下端渐进线间的近线性范围的样品须适当稀释至校正曲线最佳测量浓度范围进行测定。未知血清样品均用同一板上各自的标准校正曲线计算浓度。
2.4 方法的特异性

图1 不同抗体组检测HSA-GLP-1融合蛋白的校正曲线
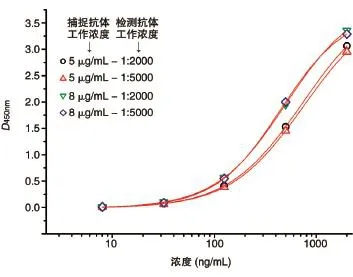
图2 不同抗体工作浓度及检测HSA-GLP-1融合蛋白的校正曲线
选择分子结构类似于HSA-GLP-1融合蛋白的药物 GLP-1、HSA、IL-2-HSA 和 PEG-INF-α2b等,分别制备成与HSA-GLP-1融合蛋白相同浓度的标准品,进行交叉反应,结果见图 4,GLP-1、HSA、IL-2-HSA和PEG-INF-α2b均不与HSA-GLP-1融合蛋白发生交叉反应,不干扰血清样本中的抗HSA-GLP-1融合蛋白检测,呈现较高的特异性。
2.5 基质效应
分别以10%、20%、50%血清和全猴血清为稀释液制备标准曲线,结果见图5。10%、20%、50%血清和全猴血清稀释液等4条标准曲线比较重合,标准曲线没有明显右移或左移,可以判定没有基质效应存在。为了在后续样品检测中更具有代表性,我们选用20%血清作为稀释液。

表3 ELISA方法的标准曲线与线性范围(D450nm)
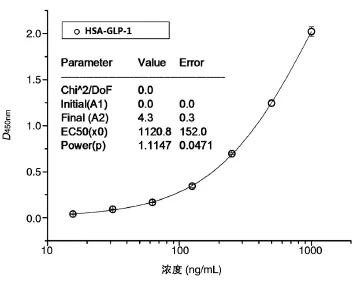
图3 HSA-GLP-1融合蛋白的四参数校正曲线

图4 方法的特异性考察
2.6 方法的回收率
按照制备标准曲线的方法制成500、125、31.25 ng/mL等3个浓度,按上述方法进行测定,每个浓度重复5次,用随行标准曲线计算其测定浓度,与理论浓度比较得到相对回收率,结果见表4。每个浓度质控样品回收率均为95.4%~104.5%,变异系数为3.6%~7.4%,符合方法学确证的要求。
2.7 方法的灵敏度
按照制备标准曲线的方法制成15.6 ng/mL的HSA-GLP-1融合蛋白,按上述方法进行测定,重复5次,由同一板上的标准曲线回归方程计算出的浓度为HSA-GLP-1融合蛋白的检出量。结果如表5所示,标准品15.6 ng/mL的5次重复检测准确度为-2.5%,精密度为4.3%,符合方法学确证的要求。
2.8 方法的精密度
按照制备标准曲线的方法制成500、125、31.25 ng/mL等3个浓度,按上述方法进行测定,每个浓度重复5次,检测3次,计算板间与板内的精密度。结果见表6、7,板内精密度为3.1%~10.0%,板间精密度为3.9%~7.8%,符合方法学确证要求。
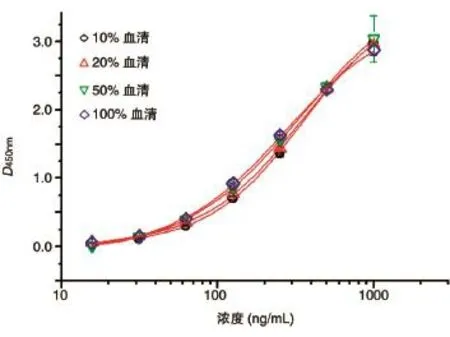
图5 不同浓度稀释液制备的四参数校正曲线

表4 ELISA方法检测HSA-GLP-1融合蛋白在血清中的回收率
2.9 方法学稳定性的考察
血清中HSA-GLP-1融合蛋白稳定性研究结果见表8、9、10。HSA-GLP-1融合蛋白在血清中-80℃冻融1次、室温放置4 h、-80℃保存90 d均不影响其稳定性,符合方法学确证要求。
2.10 稀释率的影响

表5 ELISA方法检测HSA-GLP-1融合蛋白在血清中的灵敏度
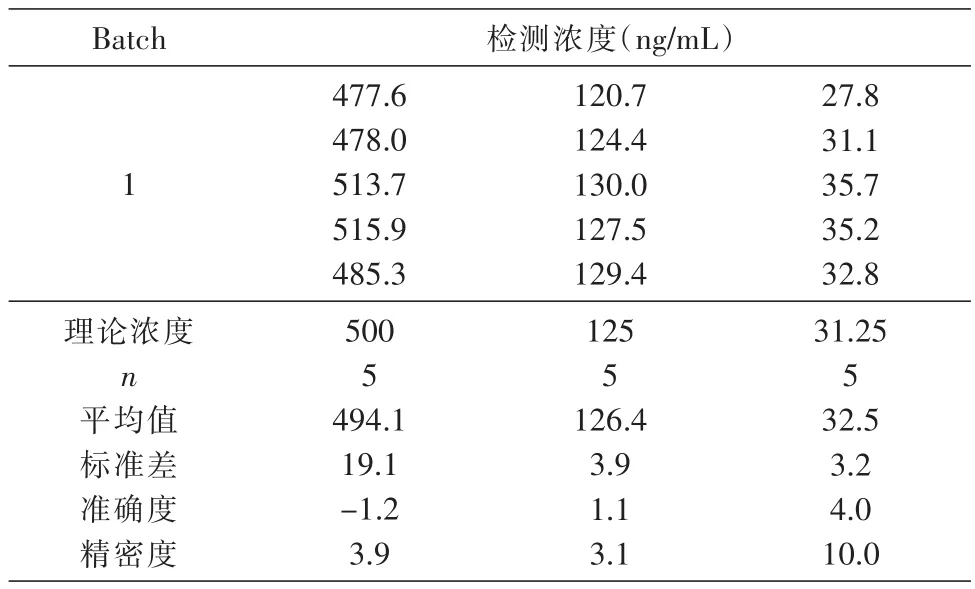
表6 ELISA方法检测HSA-GLP-1融合蛋白在血清中的板内精密度

表7 ELISA方法检测HSA-GLP-1融合蛋白在血清中的板间精密度
将浓度为1000 ng/mL的HSA-GLP-1融合蛋白分别稀释至 500、250、125、100、50、25 ng/mL,测定结果见表11,准确度为-16.4%~4.4%,符合方法学确证要求。
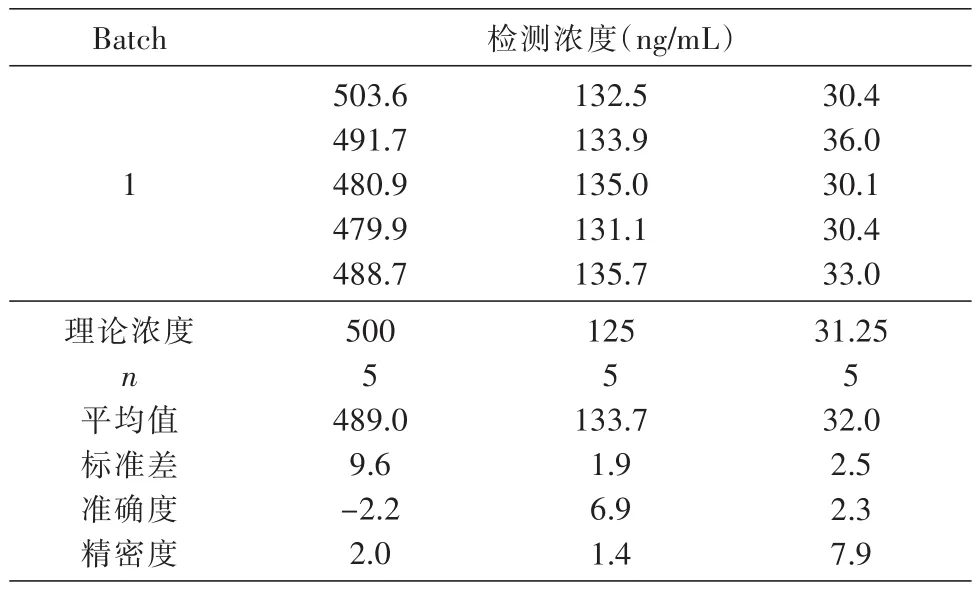
表8 方法的冻融稳定性验证

表9 方法的室温4 h稳定性验证

表10 方法的长期稳定性验证
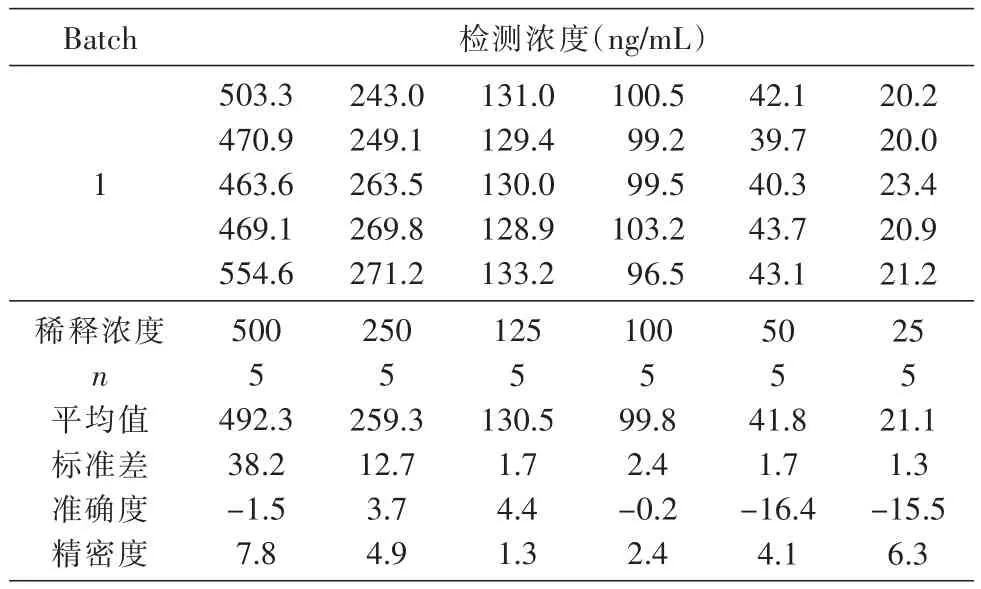
表11 稀释率的影响
3 讨论
目前测定生物体内蛋白质多肽药物的方法主要有同位素标记示踪法、生物测定法及免疫分析法[8]。生物检定法虽然可直接反映蛋白药物在生物体内产生的生物学活性,但操作复杂,费时费力,影响因素较多,其变异较大[9-10]。同位素标记法检测灵敏度高,但试验操作相对复杂并可能存在放射性污染[11],不能识别原型药物和降解产物,给准确测定原型药物的浓度变化带来困难,不能获得准确的药物动力学参数。免疫分析方法是一类快速、经济、灵敏和适用的测定方法,常用的免疫分析法有ELISA[12-13]、放射免疫分析法(RIA)和免疫放射分析法(IRMA)等。ELISA是免疫测定法的代表,通过特异性地识别蛋白质或多肽分子上的抗原决定簇部位的单克隆抗体或多克隆抗体来测定目标物。由于ELISA方法具有灵敏度高、特异性强、操作简便、检测迅速、非放射性及可以批量测定等诸多优点,已成为药代动力学研究常用的免疫测定方法[14-16]。建立可靠和可重复的定量分析方法是进行药代动力学研究的前提之一。定量分析方法验证的目的是证明采用的含量测定方法适于相应分析要求,在进行定量分析方法学研究或起草药品质量标准时,分析方法须经验证[17]。
在本实验中,我们选用与GLP-1特异性结合的GLP-1抗体作为捕获抗体。由于GLP-1分子较小,通过HSA融合技术将其与白蛋白连接以增大相对分子质量,同时在ELISA方法检测中,GLP-1抗原决定簇容易被屏蔽,通过筛选不同特异性抗原决定表位的单克隆抗体,得到抗GLP-1鼠单克隆抗体,可满足ELISA方法建立的需求,而抗原决定表位在N端和C端的GLP-1单克隆抗体均未与HSA-GLP-1融合蛋白发生免疫反应,说明GLP-1的N端和C端的抗原决定簇被屏蔽,或者HSA-GLP-1融合蛋白在反应中发生空间位阻使其失去结合抗体的能力。用20%空白血清稀释融合蛋白配制校正曲线,以提高试验的准确度和精密度。
结果表明,我们建立的双抗夹心ELISA检测方法灵敏度高,特异性及重现性好,完全符合药代动力学检测要求,可用于食蟹猴血清中HSA-GLP-1融合蛋白的检测,为进行临床前HSA-GLP-1融合蛋白药代动力学研究奠定了基础,并为其他融合蛋白类药物的药代动力学研究提供了借鉴思路。
[1]Kahn S E.The importance of the beta-cell in the pathogene⁃sis of type 2 diabetes mellitus[J].Am J Med,2000,108(Suppl 6a):2S-8S.
[2]Drucker D J.Enhancing incretin action for the treatment of type 2 diabetes[J].Diabetes Care,2003,26:2929-2940.
[3]Geelhoed-Duijvestijin P H.Incretins:a new treatment option for type 2 diabetes[J].Neth J Med,2007,65:60-64.
[4]Bose A K,Mocanu M M,Carr R D,et al.Glucagon-like pep⁃tide 1 can directly protect the heart against ischemia/reperfu⁃sion injury[J].Diabetes,2005,54:146-151.
[5]Nystr M T,Gutniak M K,Zhang Q,et al.Effects of gluca⁃gon-like peptide-1 on endothelial function in type 2 diabetes patients with stable coronary artery disease[J].Am J Physiol Endocrinol Metab,2004,287:E1209-1215.
[6]Nikolaidis L A,Mankad S,Sokos G G,et al.Effects of gluca⁃gon-like peptide-1 in patients with acute myocardial infarc⁃tion and left ventricular dysfunction after successful reperfusion[J].Circulation,2004,109:962-965.
[7]Subramanian M G,Fiscella M,Lamouse-Smith A,et al.Al⁃binterferonα-2b:a genetic fusion protein for the treatment of chronic hepatitis C[J].Nat Biotechnol,2007,25(12):1411-1419.
[8]王军志,主编.生物技术药物研究开发和质量控制[M].北京:科学出版社,2008:370.
[9]严洁,胡蓓,江骥.生物制品药动学研究中的药物分析方法[J].中国药学杂志,2005,40(13):967-970.
[10]曾经泽,黄仁玉.药物分析方法的质量控制[J].中国药学杂志,1996,31(12):707.
[11]叶晓霞,俞雄.多肽药物分析方法研究进展[J].中国医药工业杂志,2003,34(7):357-361.
[12]Shin B S,Kim C H,Jun Y S,et al.Dose-liner pharmacoki⁃netics,tissue distribution,and excretion of a recombinant fu⁃sion protein125I-GST-TatdMt possessing potent anti-obesity ac⁃tivity[J].Regulatory Peptides,2005,129(1-3):25-30.
[13]Osborn B L, Sekut L, Corcoran M,et al. Albutropin:a growth hormone-albumin fusion with improved pharmacokinet⁃icsand pharmacodynamicsin ratsand monkeys[J].EurJ Pharmacol,2002,456:149-158.
[14]van weeman B K,Schuurs A H W M.Immunoassay using an⁃tigen-enzyme conjugates[J].FEBS Lett,1971,15(2):232-235.
[15]焦奎,张书圣.酶联免疫分析技术及应用[M].北京:化学工业出版社,2004:84-141.
[16]李文敏.酶联免疫吸附反应的技术进展及应用[J].湖北职业技术学院学报,2003,4(6):65-69.
[17]张立操.双抗体夹心ELISA定量检测IFNβ-HSA融合蛋白分析方法的建立[D].无锡:江南大学,2008.

