甲基营养菌MP688胞外多糖合成的影响因素研究
葛欣 ,韩月梅 ,,熊向华 ,汪建华 ,刘党生 ,张惟材
1.军事医学科学院 生物工程研究所,北京 100071;2.沈阳药科大学,辽宁 沈阳 110016
合成分泌胞外多糖是许多微生物具有的一种能力,特别是在致病菌和根瘤菌中更常见[1]。胞外多糖是一种相对分子质量不定的单糖多聚物,包括附着在细胞表面的脂多糖和荚膜多糖,以及释放到胞外环境中的可溶性多糖[1-2]。微生物合成的胞外多糖具有多种生理功能,如保护其免受环境压力的损伤、防止细胞脱水、免疫响应等[3]。除此以外,微生物合成的胞外多糖在食品、添加剂和生物医药等方面还具有重要的应用价值[4-5]。因此,有关微生物合成多糖的研究意义重大。
甲基营养菌是能够以甲醇为惟一碳源生长并合成多种代谢产物的一类细菌,已有文献报道甲基营养菌能够分泌胞外多糖[6]。在工业生产中,甲醇成本低廉且来源广泛,因此通过微生物的一碳代谢途径来生产食品添加剂、氨基酸、辅酶和其他药物前体具有很大潜力[7]。MP688是本实验室从土壤中分离到的一株好氧甲基营养菌,曾用来发酵合成吡咯喹啉醌。基因组测序结果表明,MP688中含有一个胞外多糖合成的基因簇,具有合成多糖的潜力[8]。改变培养条件后发现该菌在以甲醇为碳源生长时也能分泌较高水平的荚膜多糖和可溶性多糖,因此MP688有望成为一株具有多糖生产潜力的工业菌。
为了提高甲基营养菌MP688的胞外多糖合成能力,使之最终成为一株具有生产多糖的菌株,对MP688发酵培养过程中影响多糖合成的因素进行研究,进而找到突破口至关重要。在本研究中,我们首先通过一系列单因素实验考察了不同氮源、培养温度、培养基初始pH值和通氧量等条件对MP688合成胞外多糖的影响,确定了每个因素的最适范围;进而通过Plackett-Burman实验筛选到MP688合成多糖的最主要影响因子,为进一步优化多糖合成的条件奠定了基础。
1 材料和方法
1.1 材料
甲基营养菌MP688(Methylovorus sp.MP688)由本实验室保存,30℃恒温培养,摇床转速200 r/min。
基础培养基:MgSO4·7H2O 0.2 g/L,(NH4)2SO41.5 g/L,KH2PO41.4 g/L,Na2HPO4·12H2O 3 g/L,柠檬酸铁 0.03 g/L,CaCl20.03 g/L,MnCl2·4H2O 0.005 g/L,ZnSO4·7H2O 0.005 g/L,CuSO4·5H2O 0.005 g/L。初始pH值为6.5,115℃灭菌30 min。单因素考察时根据条件分别替换基础培养基中的氮源、改变初始pH值、改变培养温度。
所有试剂均购自国药集团化学试剂有限公司,为分析纯级别。
1.2 Plackett-Burman设计
在Plackett-Burman实验设计中,我们将MP688合成多糖时所用的培养基组分和培养条件共8个因素作为考察变量(X1~X8),每个变量设置2个水平,分别为高水平(-1)和低水平(+1)。为了对实验结果进行误差分析,分别设置 3 个虚拟变量(X9~X11)[9]。实验设计见表1,共12组实验,每组实验中细菌培养5 d后测定发酵液中的多糖含量。将12组实验结果和8个变量根据以下方程进行线性回归:

其中Y为多糖含量,β0为线性回归方程的截距,βi为每个变量的系数,Xi为每个变量的实际水平。
1.3 统计学分析

图1 甲基营养菌MP688在6种不同氮源条件下多糖的合成量
实验设计、结果计算和方差分析等都采用De⁃sign-Expert软件完成。通过计算相关系数(R2)评估多元线性回归的结果,通过F检验和t检验评估结果的统计学显著性[10]。
1.4 胞外多糖测定方法
在不同条件下将MP688培养5 d,收集100 mL培养物,12 000 r/min、4℃离心 10 min,收集上清液,加入2倍体积的低温预冷的无水乙醇,放置10 min后12 000 r/min、4℃继续离心 10 min,收集沉淀,用无水乙醇洗涤2次,加入10 mL去离子水溶解,用苯酚-硫酸法测定多糖含量[7],每组数值测定3次,计算平均值和标准差。
2 结果
2.1 氮源对MP688胞外多糖合成的影响
由于甲基营养菌MP688在以甲醇为碳源的培养基中生长最好,因此碳源种类对多糖的合成不做研究。为考察培养基中氮源成分对多糖合成的影响,我们将等量种子液分别接种到以1.5%的硫酸铵、氯化铵、硝酸钠、硝酸钾、胰蛋白胨和尿素为惟一氮源的培养基中,30℃培养5 d后测定发酵液中的多糖含量,结果见图1。用于研究MP688合成吡咯喹啉醌的氮源是硫酸铵,并不是多糖合成的最优氮源;当硝酸钠和硝酸钾作为氮源时多糖含量高,72 h后的多糖产量均在400 mg/L以上;而2种测定的有机氮源胰蛋白胨和尿素都不利于多糖的大量合成。
2.2 培养温度对MP688胞外多糖合成的影响
为了研究温度对甲基营养菌MP688合成多糖的影响,我们将等量种子液接种到初始pH值为6.5的以1%甲醇为碳源、1.5%硝酸钠为氮源的培养基中,30℃培养5 d后测定发酵液中的多糖含量,结果见图2。20℃和25℃均不利于MP688合成多糖,而30℃和37℃条件下多糖合成能力较高。
2.3 初始pH值对MP688胞外多糖合成的影响
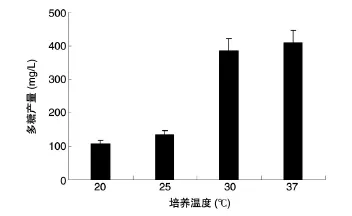
图2 甲基营养菌MP688在不同培养温度条件下多糖的合成量
为了研究培养基初始pH值对甲基营养菌MP688合成多糖的影响,我们将等量种子液接种到初始pH值分别为5.5、6.0、6.5、7.0、7.5的以1%甲醇为碳源、1.5%硝酸钠为氮源的培养基中,30℃培养5 d后测定发酵液中的多糖含量,结果见图3。初始pH值过高或过低都不利于细菌合成多糖,而初始pH值为6.5~7.0时多糖合成能力最强。这说明初始pH值是影响多糖合成的一个重要因素,对多糖合成有利的pH值范围较窄。
2.4 通氧量对MP688胞外多糖合成的影响
为了研究通氧量对甲基营养菌MP688合成多糖的影响,我们将等量种子液接种后,在含100 mL培养基的250 mL摇瓶中,于不同转速的摇床上培养5 d后测定胞外多糖含量,结果见图4。随着摇床转速的提高,MP688合成的多糖量增加,当摇床转速为250 r/min时多糖合成量高达445 mg/L,而转速继续提高后多糖合成水平下降。说明多糖合成是一个需氧的过程,转速过低时通氧量低,不能满足细菌生长和多糖合成需求,但转速高于250 r/min时,可能由于剪切力过大导致MP688合成多糖的能力下降。200~250 r/min是合成多糖的最适转速。
2.5 利用Plackett-Burman设计筛选影响胞外多糖合成的重要因素

图3 甲基营养菌MP688在不同初始pH值条件下多糖的合成量
以上单因素研究结果表明,考察的因素对MP688合成多糖能力的影响程度和影响范围有很大不同。为了系统地研究发酵过程中每个因素对多糖合成的影响程度及最显著因素,我们进行了Plack⁃ett-Burman实验设计,通过统计学方法考察每个因素的影响力度。分别选取甲醇、硝酸钠、初始pH值、培养温度、接种量、磷酸盐浓度、摇床转速、摇瓶体积等8个因素作为变量,每因素取2水平,设计12组条件,以每组条件实验测定的多糖含量作为响应值,如表1所示;将变量与结果进行线性回归和方差分析,如表2所示。回归模型的P值为0.0241,说明8个变量的水平选取合适,结果差异明显,回归方程具有显著性。其中,方程的相关系数R2为0.9755,说明我们实验中得到的响应值的变异可被该模型合理解释。从结果可知,在95%的概率水平上,甲醇、硝酸钠、初始pH值和接种量等4个因素的P<0.05,说明差异显著,而其他4个因素的差异不具显著性。这说明甲醇、硝酸钠、初始pH值和接种量是MP688合成多糖的主要影响因子,影响程度依次为甲醇含量>培养基初始pH值>接种量>硝酸钠含量。
2.6 胞外多糖合成量与影响因素的线性回归曲线
通过对实验结果进行多元线性回归,得到多糖产量与8个因素之间的关系:
Y(mg/L)=800.10+425.33X1+74.00X2+141.00X3+10.71X4+116.67X5-9.50X6+0.11X7+0.27X8
其中,Y为多糖产量,X1~X8依次为甲醇、硝酸钠、初始pH值、培养温度、接种量、磷酸盐浓度、摇床转速和摇瓶体积。由方程中各因素的系数可知,除磷酸盐浓度外,其他7个因素对MP688合成多糖均为正效应。
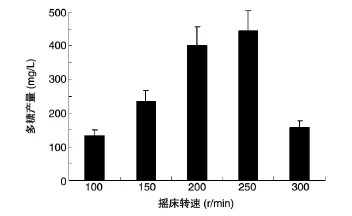
图4 甲基营养菌MP688在不同摇床转速条件下多糖的合成量

表1 Plackett-Burman实验设计及结果

表2 Plackett-Burman实验结果的统计学分析
3 讨论
本研究首先考察了单因素对甲基营养菌MP688合成胞外多糖的影响。其中,胞外多糖合成的最优氮源为硝酸钠,其次是硝酸钾,在这2种条件下细菌生长旺盛,多糖也能快速大量合成;最差氮源为氯化铵,可能是由于其影响细菌生长,也有可能是氯化铵消耗后发酵液pH值变化剧烈;含氮有机物为迟效氮源,培养初期释放慢,可能不能满足MP688生长需要,因此合成的胞外多糖量也有所降低。合成多糖的pH值为中性,可能酸性或碱性条件影响多糖的分泌。通氧量是多糖合成的重要因素,说明细菌合成多糖过程中代谢旺盛,能量需求较高。
除此以外,我们还通过Plackett-Burman实验设计及统计学分析筛选到4个主要影响因子,分别为甲醇、硝酸钠、初始pH值和接种量。碳源和氮源是维持细菌生长的必要因素,也是构成胞外多糖骨架的成分,其中甲醇和硝酸钠对MP688胞外多糖合成的贡献比例分别高达40.03%和10.9%,也说明了这2个因素的重要性。初始pH值可能主要影响多糖的分泌和大分子结构的稳定性,而接种量直接影响细菌的生长量,从而对胞外多糖含量影响较大。
Plackett-Burman实验设计是一种经济有效的量水平试验设计方法,可通过最少的试验次数达到使因素的主效果得到尽可能精确估计的目的,从而从众多考察因素中快速有效地筛选出最重要的几个因素,为进一步优化条件和提高产量提供依据[9-10]。本项研究成功地应用了这种实验设计方案,达到了预期目的。
[1]Ghevariya C M,Bhatt J K,Dave B P.Enhanced chrysene degradation by halotolerant Achromobacter xylosoxidans using response surface methodology[J].Bioresour Technol,2011,102:9668-9674.
[2]Kwak T Y,Kim N H,Rhee M S.Response surface methodol⁃ogy-based optimization of decontamination conditions for Esch⁃erichia coli O157:H7 and Salmonella typhimurium on freshcut celery using thermoultrasound and calcium propionate[J].Int J Food Microbiol,2011,150:128-135.
[3]Mazaheri H,Lee K T,Bhatia S,et al.Subcritical water lique⁃faction of oil palm fruit press fiber in the presence of sodi⁃um hydroxide:an optimisation study using response surface methodology[J].Bioresour Technol,2010,101:9335-9341.
[4]Kusic H,Jovic M,Kos N,et al.The comparison of photooxi⁃dation processes for the minimization of organic load of col⁃ored wastewater applying the response surface methodology[J].J Hazard Mater,2010,183:189-202.
[5]Arockiasamy S,Krishnan I P,Anandakrishnan N,et al.En⁃hanced production of laccase from Coriolus versicolor NCIM 996 by nutrient optimization using response surface methodolo⁃gy[J].Appl Biochem Biotechnol,2008,151:371-379.
[6]Zhang Y,Liu J Z,Huang J S,et al.Genome shuffling of Pro⁃pionibacterium shermanii for improving vitamin B12 produc⁃tion and comparative proteome analysis[J].J Biotechnol,2010,148:139-143.
[7]Politis A,Olgiati P,Malitas P,et al.Vitamin B12 levels in Alzheimer's disease:association with clinical features and cyto⁃kine production[J].J Alzheimers Dis,2010,19:481-488.
[8]Xiong X H,Zhi J J,Yang L,et al.Complete genome se⁃quence of the bacterium Methylovorus sp.strain MP688,a high-level producer of pyrroloquinolone quinone[J].J Bacteri⁃ol,2011,193:1012-1013.
[9]Liu S B,Qiao L P,He H L,et al.Optimization of fermenta⁃tion conditions and rheological properties of exopolysaccharide produced by deep-sea bacterium Zunongwangia profunda SM-A87[J].PLoS One,2011,6:e26825.
[10]Liu X,Ren B,Gao H,et al.Optimization for the production of surfactin with a new synergistic antifungal activity[J].PLoS One,2012,7:e34430.

