甲醇-山梨醇混合碳源诱导提高抗HER2抗体在糖基工程毕赤酵母中的表达
高爱荣 ,刘波 ,唱韶红 ,巩新 ,徐敏锐 ,3,徐威 ,吴军
1.军事医学科学院 生物工程研究所,北京 100071;2.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;3.安徽大学 生命科学学院,安徽 合肥 230601
抗体等糖蛋白类药物已成为发展最快的基因工程药物,目前有几十种治疗性抗体已进入市场,其中一半以上用于癌症的治疗,上百种抗体处于临床研究阶段[1]。但是,现在的抗体类药物主要依赖于哺乳动物细胞表达系统生产,生产周期长,成本昂贵,限制了该类抗体的广泛应用[2]。为此,找到一种廉价的、可替代哺乳动物细胞的表达系统,已经成为目前研究的热点问题。
毕赤酵母表达系统已成为一种成熟的蛋白表达技术平台。作为简单的真核生物,酵母具有培养成本低廉、工程菌构建周期短、不含内毒素、表达水平高等特点,同时具有大多数真核细胞的翻译后修饰能力,并已长期用于大规模工业生产。但是,野生型毕赤酵母表达的主要是高甘露糖型的糖蛋白,这种糖蛋白应用于人体后,会很快被肝脏及一些淋巴细胞表面的甘露糖受体识别,因此易出现免疫原性及药物清除过快等问题。这是限制毕赤酵母表达系统广泛应用的重要原因之一。为了解决这一问题,近年来,国内外研究者开展了一系列的酵母糖基工程改造。2006年,Gerngross等报道利用糖基工程技术对酵母菌进行改造,工程酵母表达了具有哺乳动物复杂型糖基的抗CD20单抗,并发现该酵母工程菌表达的抗体比哺乳动物细胞表达的抗体具有更强的ADCC(抗体依赖的细胞介导的细胞毒)作用[3];同年,Gerngross等又构建了另一工程菌株,成功地利用该糖基工程酵母表达了具有唾液酸末端的复杂型糖基的促红细胞生成素(EPO)[4]。
本实验室正在进行毕赤酵母糖基工程改造的研究,已成功构建了过度甘露糖基化缺失的糖基工程酵母菌株GJK01[5]等,但要使酵母表达系统成为抗体等人用剂量较大糖蛋白的大规模、低成本的制备平台,还需要解决全抗体在毕赤酵母中的高效表达和制备的问题。目前,关于全抗体在毕赤酵母中表达的报道还不多:1999年,Ogunjimi等在嗜甲醇毕赤酵母中成功地表达了第一个IgG[6];2006年,Li等利用糖基工程酵母表达了具有人源化N-糖链并具有功能的全抗体[3];2009~2011 年,Thomas等利用人源化改造的糖基化毕赤酵母获得了含有复杂型N-糖链的全抗体,该抗体糖链末端含有半乳糖,与哺乳动物细胞表达的Trastuzumab(曲妥珠单抗)相比具有更强的ADCC活性,经过发酵条件的优化,全抗体表达量已经达到1.9 g/L[7-9]。
在毕赤酵母表达系统中实现全抗体的表达涉及很多问题。例如,甲醇不仅是醇氧化酶启动子的诱导物,又是蛋白表达过程中的主要能源和碳源,因此,甲醇的添加是外源蛋白表达的关键原因之一,但甲醇浓度过高可对菌体产生毒害作用。混合碳源补料可在一定程度上补充碳源的不足,又可避免高浓度甲醇可能引起的中毒。混合碳源补料有甲醇/甘油混合碳源、甲醇/山梨醇混合碳源等[10-11]。在此,我们以表达抗HER2单克隆抗体的糖基工程酵母菌株作为模式菌株,利用甲醇和山梨醇混合碳源诱导策略对全抗体的发酵表达进行了初步探索。
人表皮生长因子受体2(human epidermal gor⁃wth factor receptor 2,HER2)属于酪氨酸激酶受体家族,是具有酪氨酸激酶活性的跨膜糖蛋白,其过度表达与乳腺癌的发生有着密切的关系[12]。抗HER2人源化单克隆抗体与HER2胞外区特异性结合,抑制肿瘤细胞生长,可用于治疗过量表达HER2受体的肿瘤——乳腺癌[13-14],属于IgG1亚类[15]。
1 材料与方法
1.1 材料
SK-BR-3细胞来自中国科学院典型培养物保藏委员会上海细胞库;表达抗HER2单克隆抗体的糖基工程巴斯德毕赤酵母菌株由本实验室构建并保存[5,16]。酵母抽提物、胰蛋白胨购自Oxoid公司;羊抗人IgG-HRP购自华美生物工程公司;商业化Her⁃ceptin(赫赛汀)购自解放军307医院;其他试剂为分析纯试剂。蛋白电泳仪、酶联免疫检测仪购自Bio-Rad公司;5L B5型贝朗发酵罐购自Sartorius公司;AKTA UPC900蛋白纯化仪购自GE公司。
1.2 培养基
MD平板:YNB(无氨基酸酵母氮源)1.34%,葡萄糖20 g/L,琼脂粉15 g/L。YPD培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,葡萄糖20 g/L。BMGY摇瓶培养基:酵母提取物10 g/L,胰蛋白胨20 g/L,pH6.0,100 mmol/L磷酸缓冲液,YNB 1.34%,生物素4×10-5%,甘油10 g/L。发酵基础培养基(BSM):H3PO43.5 mL/L,K2SO42.4 g/L,KOH 0.65 g/L,CaSO4(无水)0.14 g/L,MgSO4·7H2O 1.95 g/L,甘油40.0 g/L,PTMI 1.2 mL/L,500×生物素0.5 mL/L;高压灭菌,氨水调pH6.0。补料生长培养基:500 g/L甘油(含12 mL/L PTMI,2 mL/L 500×生物素)。
PTM1:CuSO4·5H2O,6.0 g/L;MnSO4·H2O,3.0 g/L;FeSO4·7H2O,65 g/L;ZnSO4·7H2O,20 g/L;CoCl2·6H2O,0.5 g/L;NaMoO4·2H2O,0.2 g/L;KI,0.1 g/L;H2SO4,5 mL/L。
1.3 甲醇诱导浓度对抗体表达的影响
巴斯德毕赤酵母是一种甲醇利用型酵母菌,用摇瓶试验分析甲醇浓度对抗体表达的影响。在诱导期向培养基中添加甲醇,浓度分别为0.2%、0.5%、1%、1.5%、2%、2.5%、3%。每隔12 h诱导一次,诱导72 h收获培养液。
1.4 抗HER2抗体抗原结合活性的测定[17]
SK-BR-3细胞是HER2基因高扩增和高表达的乳腺癌细胞,利用该细胞表达的HER2抗原与对应抗体结合的特性,采用间接ELISA检测毕赤酵母表达的抗HER2抗体与抗原的结合活性。
将SK-BR-3细胞用含10%胎牛血清的DMEM培养基,于37℃、5%CO2水汽饱和的培养箱中培养,以1×105/mL的浓度铺96孔板,培养至72 h,用戊二醛固定细胞,1%的BSA-PBS封闭2 h,弃封闭液,用0.1%的苯肼-PBS闭光作用1 h,弃苯肼液,用PBST洗涤4次,加入合适浓度的摇瓶表达抗体,37℃作用1 h;用0.1%的BSA-PBS洗涤4次,加入羊抗人IgG-HRP(1∶1000)50 μL/孔,37℃作用 1 h;用 PBST洗涤5次,每次尽量弃去残液;每孔各加50 μL显色液,37℃温育15 min;每孔加50 μL终止液以终止显色,测定D492nm值。
1.5 抗HER2抗体糖基工程酵母菌的发酵
1.5.1 种子培养 从新鲜MD平板上挑取重组糖基工程酵母菌的单菌落接种于YPD培养基中,24℃、250 r/min培养约48 h,转接于YPD摇瓶培养基中,培养基体积为300 mL,接种量为1%,25℃、250 r/min培养至菌液D600nm为10。
1.5.2 发酵培养 配制发酵培养基2.1 L,加入5 L发酵罐中,121℃、35 min高压灭菌,待发酵罐降至室温,以10%的接种量将摇瓶种子接入发酵罐,氨水控制pH6.0,温度为24℃,调节搅拌转速和通气量,维持溶氧在20%以上;当基础培养基内甘油耗尽时,溶氧回升,开始流加补料生长培养基;当甘油耗尽时停止补料,开始甲醇诱导,温度依然维持在24℃,调节pH值为6.4。起始阶段,甲醇以2.4 mL/(L·h)开始流加,每小时增加终浓度的20%,5 h后增至12 mL/(L·h),此时记为诱导0 h;表达阶段甲醇与山梨醇按照1∶1的摩尔比混合诱导,流加速度为12 mL/(L·h);诱导表达96 h后结束发酵,发酵液于4℃、8000 r/min离心20 min,发酵液上清用于后续分析。
1.6 ELISA测定抗体的表达量[16]
将发酵培养液上清加入酶联板中,用包被液倍比稀释,4℃包被过夜,弃上清,用PBST洗涤3次,每孔分别加入300 μL 5%的奶粉封闭1.5 h;弃上清,用PBST洗涤1次,每孔加入300 μL羊抗人IgGHRP(用5%的奶粉稀释至1/5000),37℃温育1 h;用PBST洗涤5次,每次尽量弃去残液;每孔各加100 μL显色液,37℃温育15 min;每孔加50 μL终止液以终止显色,测定D492nm值;用已知浓度的IgG和D492nm值绘制标准曲线,计算发酵液上清中抗HER2抗体的表达量。
1.7 发酵培养液中抗体的纯化
收集发酵液,4℃、12 000 r/min离心20 min,弃沉淀,上清保存于-20℃备用。收集的上清用阳离子交换柱分离纯化,具体方法参见文献[15];采用Lowry法对纯化的抗体进行定量,参考中国药典第二部[18]。
1.8 纯化蛋白的Western印迹
纯化样品经SDS-PAGE,采用半干式电转移方法将蛋白转移到硝酸纤维素膜上,恒压18 V,1.5 h;转移完成后,将硝酸纤维素膜放在平皿中,加入封闭液[5%的脱脂奶粉溶于 PBST(PBST:0.01 mol/L PBS+0.05%Tween,pH7.4)],37℃轻轻振荡 2 h;封闭结束后洗掉硝酸纤维素膜上的封闭液,将硝酸纤维素膜浸泡在一抗溶液[含羊抗人IgG-HRP(1∶4000)的奶粉]中,室温轻轻振荡2 h;将硝酸纤维素膜用PBST洗5次,每次5 min;用滤纸稍微吸干硝酸纤维素膜上的PBST液体,放置在洁净的保鲜膜上,将显色底物(Pro-light HRP化学发光检测试剂)溶液A和B等体积混合(这里各500 μL),均匀涂布于膜上的蛋白面,曝光显色。
2 结果
2.1 摇瓶试验确定抗体表达最佳的甲醇浓度
甲醇既是酵母自身生长必需的碳源,又是外源基因表达的诱导剂,因此合适的甲醇浓度对于外源基因的表达有重要影响。我们研究了不同甲醇浓度对蛋白表达量的影响,结果如图1。在摇瓶培养中,当甲醇浓度由0.2%提高到0.5%时抗体表达量提高,而甲醇浓度由1%提高到3%的过程中蛋白表达量逐渐下降。分析可能是由于过高的甲醇浓度对细胞产生了毒害作用,从而造成抗体的分泌减少。
2.2 抗HER2抗体的抗原结合活性测定
抗HER2抗体靶向HER2的胞外区,我们采用间接ELISA实验检测抗体与抗原的结合活性,图2结果显示表达的抗HER2抗体能够和SK-BR-3细胞表面表达的HER2抗原结合,具有抗原结合活性。
2.3 抗HER2抗体糖基工程酵母菌在5 L发酵罐中的培养
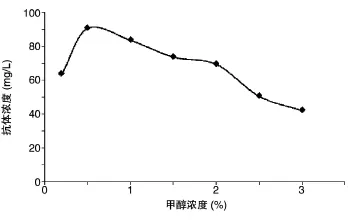
图1 甲醇诱导浓度对抗HER2抗体表达的影响
在摇瓶实验基础上,我们在5 L发酵罐中进行了抗体表达菌株的发酵研究,主要探讨了甲醇与山梨醇混合碳源诱导策略对抗体表达量的影响。整个发酵过程分为菌体生长阶段、甘油补料阶段和诱导阶段(图3)。当pH值曲线和溶氧曲线都快速上升时,表明基础培养基中碳源消耗殆尽,进入甘油补料阶段。甘油补加完毕,进入诱导补料阶段。诱导起始适应阶段,为避免甲醇对酵母细胞的毒害作用,甲醇以2.4 mL/(L·h)的速率开始流加,每小时增加终浓度的20%,5 h后流加速率提至12 mL/(L·h),此时记为诱导0 h。诱导表达阶段,甲醇/山梨醇按1∶1的摩尔比、12 mL/(L·h)的速率混合添加,诱导培养96 h后发酵结束。整个诱导过程中的菌体密度及抗体表达见图4。诱导表达前,处于菌体的生长阶段,经过甘油补料培养阶段,菌体大量增长,发酵上清中并无抗体表达;随着甲醇诱导时间的延长,发酵液中的抗体不断积累,菌体密度也在不断提高。由图5可知,甲醇和山梨醇混合添加策略使菌体生长加快,5 L罐中抗体的表达量达到了0.6 g/L。

图2 抗HER2抗体的抗原结合活性测定

图3 甲醇/山梨醇混合诱导补料的发酵过程图
2.4 抗HER2抗体的纯化与鉴定
发酵培养液经阳离子交换层析柱纯化,对纯化得到的抗体进行还原及非还原SDS-PAGE分析(图6)。从抗体条带的位置判断,还原电泳中抗体的轻重链相对分子质量与商业化的Herceptin一致。非还原SDS-PAGE结果表明,纯化样品中含有完整的抗体分子,抗体相对分子质量为1.5×105,表明其能够通过二硫键的配对形成正确的四聚体结构。用Lowry法对纯化产物进行浓度测定,测得纯化的抗体浓度为0.365 g/L。
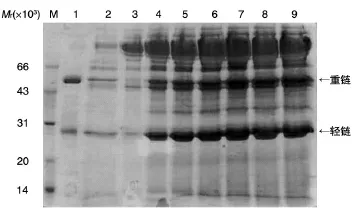
图4 甲醇与山梨醇混合补料诱导策略的发酵SDS-PAGE图谱

图5 甲醇/山梨醇混合诱导策略对抗HER2抗体的表达及菌体生长的影响

图6 纯化蛋白的还原(A)和非还原(B)SDS-PAGE图谱

图7 纯化蛋白的Western印迹还原电泳(A)和非还原电泳(B)
3 讨论
本研究以表达抗HER2抗体的糖基工程酵母菌为模型,研究该类工程菌的发酵技术。首先,通过摇瓶试验确定了合适的甲醇浓度,糖基工程毕赤酵母表达的抗HER2抗体具有SK-BR-3细胞抗原结合活性;然后在5 L发酵罐中,利用甲醇和山梨醇混合诱导方式发酵,抗体的表达量比摇瓶诱导提高了近10倍;非还原SDS-PAGE及Western印迹表明抗体分子大小与商业化抗体Herceptin一致。上述结果表明,采用甲醇-山梨醇混合碳源诱导方式发酵,能够提高抗HER2抗体在糖基工程酵母中的表达量。本研究可为抗体在酵母中的规模发酵技术提供重要参考。
目前,毕赤酵母表达系统已成功表达了多种抗体及抗体片段,如抗CD20、ALD518、ScFv、Fab等,尤其是抗体片段的发酵表达量已超过8 g/L。2011年,Merck公司利用氧限制方法,将抗HER2抗体的表达量提高到1.9 g/L。我们采用Mut+型高表达菌株,经过摇瓶试验验证该菌诱导控制的最适甲醇浓度为0.5%,发现过高的甲醇不利于菌体生长,还会出现菌体死亡、裂解释放蛋白酶等,从而降低表达量。在此基础上,进行了混合补料发酵对抗体表达量的影响研究,发现山梨醇和甲醇混合补料有助于表达量的提高。与传统的甲醇诱导方式相比,混合补料具有很多优点。山梨醇是一种非抑制性碳源,相关报道表明,山梨醇与甲醇共同诱导外源蛋白表达时,二者具有不同的代谢途径,甲醇代谢有利于产生外源蛋白表达所需的能量,但同时也产生了对酵母细胞有害的甲醛,而山梨醇则进入EMP途径和TCA循环,产生蛋白合成必要的能量ATP。因此,山梨醇的加入缓解了甲醇单独诱导表达能量不足的压力和甲醇积累造成细胞毒性的问题[19],其辅助甲醇进行抗体的诱导表达是可行并且有效的。
可作为酵母碳源的化合物有多种,除山梨醇外还包括甘油、乳酸、小分子有机酸等。甘油与甲醇混合添加是研究较早的一种混和碳源流加方式,适量的添加可以提高细胞的生长活力,但添加过量就会产生对AOX启动子具有抑制作用的乙醇,从而影响产量[20];乳酸虽不会抑制启动子AOX的表达,但它是弱酸,会改变发酵体系的pH值;也可以加入一些小分子有机酸的缓冲体系,其作为碳源的同时稳定了发酵体系的pH值[21]。本研究采用甲醇/山梨醇混合碳源流加策略,进一步证实了山梨醇有益于外源蛋白的表达。
[1]Li J,Zhu Z.Research and development of next generation of antibody-based therapeutics[J].Acta Pharmacol Sin,2010,31:198-207.
[2]Farid S S.Established bioprocesses for producing antibodies as a basis for future planning[J].Adv Biochem Eng Biotech⁃nol,2006,101:1-42.
[3]Li Huijuan,Natarajan S,Stadheimet T A,et al.Optimization of humanized IgGs in glycoengineered Pichia pastoris[J].Nat Biotechnol,2006,2(24):210-215.
[4]Hamiltone S R,Davidson R,Sethuraman N,et al.Humaniza⁃tion of yeast to produce complex terminally sialylated glycopro⁃teins[J].Science,2006,313(8):1441-1443.
[5]王越,巩新,唱韶红,等.α-1,6-甘露糖转移酶基因敲除的毕赤酵母菌株构建及其用于融合蛋白HAS-/GM-CSF表达的研究[J].生物工程学报,2007,23(5):907-914.
[6]Ogunjimi A A,Chandler J M,Gooding C M,et al.High-lev⁃el secretory expression of immunologically active intact anti⁃body from the yeast Pichia pastoris[J].Biotechnol Lett,1999,21:561-567.
[7]Potgieter T I,Cukan M,Drummond J E,et al.Production of monoclonalantibodiesby glycoengineered Pichia pastoris[J].Biotechnology,2009,139:318-325.
[8]Potgieter T I,Kersey S D,Mallem M R,et al.Antibody ex⁃pression kinetics in glycoengineered Pichia pastoris[J].Biotech⁃nol Bioeng[J].2010,106:918-927.
[9]Berdichevsky M,d'Anjou M,Mallem M R, et al. Improved production ofmonoclonalantibodies through oxygen-limited cultivation of glycoengineered yeast[J].J Biotechnol,2011,155:217-224.
[10]Xie J L,Zhou Q W,Peng D,et al.Use of different carbon sources in cultivation of recombinant Pichia pastoris for angio⁃statin production[J].Enzyme Microb Technol,2005,36:210-216.
[11]Çelik E, Çalık P,Oliver S G. Fed-batch methanol feeding strategy for recombinant protein production by Pichia pastoris in the prenence of co-substrate sorbitol[J].Yeast,2009,26:473-484.
[12]Slamon D J,Clark G M,Wong S G,et al.Human breast can⁃cer:correlation of relapse and survival with amplification of the HER-2/neu oncogene[J].Science,1987,235:177-182.
[13]Nunes R A,Harris L N.The HER2 extracellular domain as a prognostic and predictive factor in breast cancer[J].Clin Breast Cancer,2002,31:25-35.
[14]Baselga J,Albanell J.Mechanism of action of anti-HER2 monoclonal antibodies[J].Ann Oncol,2001,12:35-41.
[15]Jiang Y W,Li F,Potgieter T I,et al.Purification process de⁃velopment of a recombinant monoclonal antibody expressed in glycoengineered Pichia pastoris[J].Protein Expr Purif,2011,76:7-14.
[16]王凌雪,张惟广,吴军.抗HER2人源化单克隆抗体在毕赤酵母中的表达及产物分析[J].生物技术通讯,2008,19(6):843-847.
[17]Zhang Ningyan,Liu Liming,Dumitru C D,et al.Glycoengie⁃nered Pichia produced anti-HER2 is comparable to trastuzum⁃ab in preclinical study[R].MAbs,2011,3(3):289-298.
[18]国家药典委员会.中华人民共和国药典[M].二部.北京:化学工业出版社,2005:附录54.
[19]戴科科,史仲平.甲醇/山梨醇共混诱导改善重组毕赤酵母表达猪优干扰素发酵过程和NADH再生效率[J].生物加工过程,2012,10(2):55-62.
[20]Jungo C,Marison I,von Stockar U.Mixed feeds of glycerol and methanol can improve the performance of Pichia pastoris cultures:a quantitative study based on concentration gradients in transientcontinuous cultures[J].Biotechnology,2007,128:824-837.
[21]叶勤,谢静莉.一种重组嗜甲醇酵母的发酵方法[P].中国专利:031160344,2003-10-08.

