建立基于RNA免疫共沉淀技术的鼠疫耶尔森菌Hfq蛋白相关sRNA的体内验证方法
孟祥荣 ,苏山春 ,邓仲良 ,刘子中 ,杨瑞馥 ,韩延平 ,黄新祥
1.江苏大学 基础医学与医学技术学院,江苏 镇江 212000;2.军事医学科学院 微生物流行病研究所,病原微生物生物安全国家重点实验室,北京 100071;3.四川农业大学 动物医学院,四川 雅安 625014
鼠疫耶尔森菌(以下简称鼠疫菌)能引起严重危害人类健康的烈性传染病——鼠疫。鼠疫菌的天然宿主是啮齿动物,传播媒介主要是跳蚤,在合适的环境下,鼠疫菌可在自然界长期存活,使所在地区成为鼠疫自然疫源地,近年来鼠疫又有重新抬头的趋势。
细菌非编码小RNA(small non-coding RNA,sRNA)是近年来生命科学领域的研究热点。sRNA通常位于基因间区(intergenic regions,IGR),长度为50~500 bp,有特殊的茎环结构。这些非编码RNA不翻译成蛋白质,以RNA的形式在细菌保持基因组稳定性、生长代谢和致病机制等很多方面发挥着调控作用,例如可通过碱基反向互补调控靶mRNA翻译和稳定性。在大肠杆菌中,已证明sRNA分子参与了包括翻译调控、铁代谢、膜蛋白生物合成、糖代谢、群体感应及致病菌的致病力调节等诸多生命过程[1-2]。sRNA调控基因表达主要有2种方式,一种为反式编码的反义sRNA通过碱基结合方式结合到靶mRNA上,影响后者的翻译和稳定性[3];另一种结合方式是分子模拟,sRNA提供RNA结合蛋白如CsrA/RsmA家族的结合位点,从而调节蛋白活性[4]。
Hfq(host factor for RNA phage Qβ replicase)在细菌体内广泛存在,作为大多数sRNA的伴侣分子,是一种转录后水平的整体调控子。Hfq是一个高度保守的RNA结合蛋白,被认为是细菌基因转录后调控的关键因子。Hfq包含2个结构域Sm1和Sm2,两者共同形成一个同源六聚体的拓扑结构[5]。研究发现,Hfq与包括鼠疫菌在内的多种病原菌的毒力相关,许多sRNA可能参与其中。Hfq作为一种RNA分子伴侣,能与大量sRNA和mRNA结合,影响sRNA的稳定性和sRNA-mRNA的配对[6-9]。
RNA-蛋白免疫共沉淀技术(RNA-binding pro⁃tein immunoprecipitation,RIP)是一种新兴技术,类似于染色质免疫沉淀技术(CHIP),但它是利用蛋白-RNA之间的相互作用,而不是蛋白-DNA的作用。Hfq作为一种有效的RNA结合蛋白,与细菌的众多RNA相互作用,为我们的研究奠定了基础。利用RIP技术可有效地得到Hfq在体内结合的RNA,通过Northern印迹检测可初步验证,并通过后期的RIP-seq、RT-PCR和RIP-chip的分析,可以直接对Hfq结合的RNA进行定性定量分析。因此,我们以鼠疫菌的RyhB1和RyhB2为研究对象,拟建立一种RNA-蛋白免疫共沉淀技术,鉴定与细菌Hfq结合的sRNA,为细菌sRNA验证和功能解析等提供帮助。
1 材料与方法
1.1 材料
鼠疫菌野生株201株为田鼠型菌株,基于λRed同源重组系统构建鼠疫菌Hfq敲除株,在Hfq敲除基础上导入pACYC184-hfq-Flag质粒,构建带有标签的实验菌株;在野生株基础上导入pACYC184-Flag,构建带有标签的对照菌株;均由本室保存。
TMH培养基:人工配制含盐、维生素、稳定及不稳定氨基酸等多种营养成分的限制性培养基,使铁终浓度为10 μmol/L,用5.5 mol/L NaOH调节pH值为7.2,过滤除菌,4℃保存。
dNTP、RNase和GoldView染料购自北京欣经科生物有限公司;Taq DNA聚合酶、DNA marker DL2000购自TaKaRa公司;Magna RNA-Binding Protein Immunoprecipitation Kit购自Milllipore公司;TRIzol试剂购自Invitrogen公司;DEPC购自Sigma公司;ULTRAhyb杂交液购自Ambion公司;Nylon Membrances,positively charged、DIG Wash and Block Buffer Set、Anti digoxigenin-AP conjugate、CDP-Star、Hybridization Bags等购自Roche公司。引物和探针见表1。
1.2 载体构建及PCR验证
设计并构建重组载体,加入3×Flag标签,本实验使用pACYC184载体,重组质粒导入Δhfq(已敲除成功,由本实验室保管)和野生株中。分别构建带标签的Hfq互补株实验株和带标签的对照株。通过PCR鉴定和基因测序证实构建成功。
1.3 生长曲线绘制
将鼠疫菌野生株201株(WT)、鼠疫菌Hfq敲除株、在Hfq敲除基础上导入pACYC184-hfq-Flag质粒构建的实验菌株和在WT基础上导入pA⁃CYC184-Flag质粒构建的对照菌株等4株实验用菌株分别接种于含相应抗生素的LB和TMH培养基中,26℃培养至对数后期,1/40稀释至新鲜LB和TMH培养基中,26℃培养至对数中期(D620nm=1.0~1.2),1/40稀释至含新鲜LB和TMH培养基的50 mL三角瓶中,26℃培养,每隔2 h测其D620nm值,连续监测46 h并绘制生长曲线,每株菌重复3次。
1.4 RNA-蛋白免疫共沉淀技术
1.4.1 细胞裂解液上清制备 4℃、12 000 r/min离心5 min收集细胞沉淀物,弃上清液,用预先冰浴冷却的PBS重悬细胞,4℃、12 000 r/min离心5 min,弃上清,洗涤2次;加入适量RIP洗涤缓冲液、蛋白酶抑制剂混合液、RNase抑制剂,充分混匀,避免产生气泡;超声波裂解细胞,4℃、12 000 r/min离心10 min,上清液将用于免疫沉淀,-80℃贮存。

表1 引物和探针序列
1.4.2 磁珠的准备 在清洗过程中,吸管头须无RNase污染。完全分散重悬磁珠,每管加50 μL磁珠悬液,再加0.5 mL RIP洗涤缓冲液,涡旋洗涤后将管置于磁力分离器上,当磁珠聚集后弃上清,共2次洗涤;每管加100 μL RIP洗涤缓冲液,重悬磁珠后加5 μg抗体,室温旋转孵育30 min;将每管短暂离心后置于磁力架上,弃上清,每管加0.5 mL RIP洗涤缓冲液,涡旋后置于磁力分离器上,弃上清液;重复洗涤1次;置于冰上。
1.4.3 RIP 制备适量含RIP洗涤缓冲液、0.5 mol/L EDTA、RNase抑制剂的RIP反应液。磁珠放磁力架上,弃上清液,每管添加900 μL RIP反应液;将第Ⅰ部分的RIP裂解上清液迅速解冻,4℃、12 000 r/min离心10 min,将100 μL上清液加入磁珠-抗体中,使每管RIP反应液达到1.0 mL;从第Ⅰ部分的RIP裂解上清液中取出100 μL提取RNA,此部分为总RNA(或input RNA);4℃旋转孵育3 h或过夜,短暂离心,置于磁力分离器上,留存上清,提取RNA,此部分RNA为未结合RNA(unbound RNA);加入0.5 mL冰冷的RIP洗涤缓冲液,涡旋后置于磁力分离器上,留存上清液;重复此步5次,共6次,标记为W1~W6;第 6 次重悬后,取磁珠悬液 50 μL 用于Western印迹,验证Hfq蛋白在磁珠上。
1.4.4 RNA的纯化 用蛋白酶K溶液重悬磁珠,55℃消化10 min;再用TRizol法抽提RNA,用乙醇沉淀,此部分RNA为结合RNA(bound RNA)。
1.5 Western印迹
15%SDS-PAGE后转膜(PVDF膜,5 mA/cm2,2 h);封闭,10 mL 5%脱脂奶粉,轻轻振荡,4℃过夜或室温3 h,一抗孵育,用封闭液1∶10 000稀释,室温振荡孵育1 h或4℃过夜;TBST洗膜3次,10 min/次;二抗孵育,加入羊抗鼠二抗,用封闭液1∶1000稀释,室温振荡孵育1 h,TBST洗膜3次,10 min/次;显色,1 mL A液+1 mL B液,充分混匀,全部滴加在PVDF膜上,使整张膜全部浸入显色底物反应5 min;压片和显影,压片 3~5 min,放入显影液 1~2 min,用水冲洗几次,放入定影液1 min,取出X线胶片,用自来水冲洗、晾干;观察结果,扫描图片。
1.6 Northern印迹
6% 尿素-PAGE后转膜[BrightStar-Plus膜,半干式转膜仪 50 mA 电转,4℃,45 min(8 cm×4 cm)];紫外交联,120 mJ/cm2能量交联;杂交,65℃,预杂交时间为1~2 h,正式杂交过夜(12~18 h);高、低严谨洗涤,用低严谨洗液室温洗2次,每次5 min,再用高严谨洗液65℃洗2次,每次15 min;洗脱、封闭和免疫检测,用洗涤缓冲液洗膜1~5 min后,用封闭缓冲液孵育30 min;将膜置于Anti digoxigen⁃in-AP conjugat solution(1∶20 000)中孵育20 min,再用洗涤缓冲液洗2次,每次15 min,最后在检测缓冲液中平衡3 min;加CDP-Star均匀覆盖膜,孵育5 min;用单层保鲜膜包裹,放在压片夹中,在暗室中取出柯达胶片压片1~5 min,取出胶片在显影液中显影20 s~1 min,去离子水中洗膜5~8次;定影液中定影1 min,去离子水冲洗干净、晾干,观察结果,扫描图片。
2 结果
2.1 载体构建及PCR验证
鼠疫菌的Hfq蛋白与其他细菌的Hfq蛋白一样,是一个高度保守的蛋白,且同源性非常高。我们表达Hfq蛋白,免疫小鼠和免疫家兔制备抗体,未能制备成功,因此采用在Hfq蛋白后加入Flag标签,使用Flag抗体,构建了重组载体,导入hfq缺陷株,经PCR鉴定和测序结果正确,可以使用。
2.2 生长曲线结果
鼠疫菌的Hfq蛋白与其生长有关,基于λRed同源重组系统构建鼠疫菌hfq缺陷株生长速度减慢,在hfq敲除基础上导入pACYC184-hfq-Flag质粒构建的实验菌株和在WT基础上导入pACYC184-Flag质粒构建的对照菌株生长速度都恢复了正常,与野生株没有明显差异。结果表明,互补后Hfq的功能得到了恢复,不影响下游实验,本实验构建的载体可用于RIP实验(图1)。
2.3 Western印迹
为了检测RIP实验过程中鼠疫菌Hfq蛋白的表达及其生物学活性,我们采用Western印迹,分别对细菌裂解上清、细菌裂解沉淀、input上清、RIP上清、W1、W2、W6、磁珠悬液、蛋白酶消化后的磁珠等9个样品中鼠疫菌Hfq蛋白的表达进行了检测,结果见图2,细菌裂解上清、细菌裂解沉淀、input上清、RIP上清、W1、磁珠悬液中均检测出Hfq蛋白。细菌裂解上清中蛋白的表达多于细菌裂解沉淀,说明蛋白主要集中于上清中;RIP上清中也存在蛋白,说明Hfq表达相对于磁珠是过量的;W2、W6中没有检测到,说明蛋白与磁珠结合稳定没有脱落;磁珠悬液中检测出蛋白,说明蛋白有活性,可以形成RNA/蛋白复合体,可进行后续实验。
2.4 TRIzol试剂提取RNA的质量验证
用紫外分光光度法检测WT-pACYC184-Flag和Δhfq-pACYC184-hfq-Flag等2株菌提取的RNA的D260nm/D280nm值约为2.0,说明RNA纯度较高,但并不能真正反映RNA的质量,还需要进行琼脂糖电泳观察。在样品中加50%去离子甲酰胺以维护RNA的稳定,用SYBR胶体金核染料观察结果,可见23S、16S、5S rRNA条带明亮,边缘清晰,且23S rRNA条带的亮度是16S rRNA的2倍左右,说明RNA质量良好,无降解(图3)。
2.5 Northern印迹
为了进一步验证RIP实验分离得到的RNA的性质,我们用RyhB1、RyhB2和5sRNA探针对分离到的RNA进行Northern印迹,主要检测总RNA、结合RNA(磁珠上提取得到)、未结合RNA(RIP上清中提取得到)等3部分RNA,它们的上样量均为1.5 μg。结果如图4,3种探针均可检测出RNA,说明鼠疫菌sRNA RyhB1和Ryhb2都可以和Hfq结合;未结合RNA检测到条带,说明Hfq蛋白相对于磁珠抗体过量。
3 讨论

图1 4株鼠疫菌在LB培养基和TMH培养基中的生长曲线
鼠疫是一种自然疫源性疾病,其特点是发病急、传播快和病死率高,是国家法定的甲类传染病。近年来鼠疫的感染呈上升趋势,已被世界卫生组织(WHO)列为重新抬头的传染病。此外,鼠疫菌还是标准的生物战剂,因此鼠疫防治将是一个不可回避的问题。鼠疫菌基因表达调控机制的研究是至关重要的,在基因调控领域已不仅只关注蛋白质的调控作用,sRNA是近年发现的细菌体内的一类重要调控分子,在细菌应对环境刺激(如活性氧、温度、酸碱度等)条件下调控靶基因的表达[10]。在大肠杆菌基因组中发现并鉴定的sRNA达数十条,沙门菌中也存在大量sRNA,序列大多与大肠杆菌的同源[3]。鼠疫菌sRNA的研究还刚起步,随着高通量测序技术的发展,越来越多的sRNA将会被发现并需要验证。因此,需要建立一种安全性好、成本低廉、便于操作的sRNA检测方法。
sRNA调控基因表达的其中一种方式,是与RNA结合蛋白相互作用,从而调节蛋白的活性。我们以RNA结合蛋白Hfq为切入点,利用它们之间的相互作用来建立一种技术,发现并鉴定sRNA。采用RIP技术,用针对RNA结合蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析。这种方法可以针对特异性的目的蛋白进行与其相关RNA的检测,灵敏度较高,可以定性发现鉴定RNA,为揭示RNA和蛋白的作用机制奠定了基础。

图2 Western印迹检测鼠疫菌Hfq蛋白
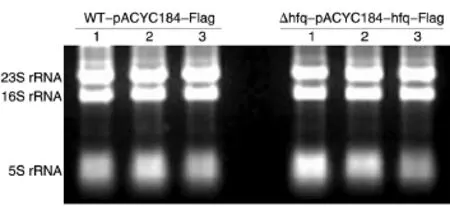
图3 RNA质量检查

图4 鼠疫菌RyhB探针Northern印迹检测
影响RIP实验结果的因素很多,包括Hfq蛋白表达量、标签活性、抗体纯度、抗体高亲和力、RNA酶污染等因素。Hfq蛋白表达量、标签活性和抗体质量是决定实验是否成功的基础。本研究中Hfq蛋白的表达过量,主要是由于蛋白在体内的表达无法控制,因而免疫共沉淀后还有大量蛋白存留,影响该技术的特异性。标签活性和抗体质量是免疫沉淀的基础,要严格控制。另外,整个实验过程中都要注意防止RNA酶污染。
RIP技术可用于其他mRNA的鉴定和检验,也可以直接结合下游应用,包括定量逆转录聚合酶链反应(RT-PCR)、芯片分析(RIP-chip)和深度测序或二代测序技术(RIP-Seq),与这些技术结合,能帮助我们更高通量地了解整体水平的RNA变化。由于不能直接鉴定RNA结合蛋白在RNA内部的识别元件,可以通过紫外交联免疫共沉淀-高通量测序技术(CLIP-seq)获取RNA结合蛋白的结合位点的cDNA文库,在全基因组范围内鉴定不同RNA上RNA结合蛋白的结合位点,就可以直接鉴定结合基序和机制,有利于新sRNA、新机制和新功能的发现。
Northern印迹结果显示,未结合RNA也检测到RNA。主要原因是实验中每个部分RNA的区分是相对的,由于Hfq蛋白表达相对于磁珠上抗体是过量,所在RIP后上清中会残留过量蛋白,因此我们提取未结合部分RNA时存在结合的RNA残留,导致Northern印迹检测在未结合RNA处有条带。
本研究以Hfq为靶点,以鼠疫菌RyhB1和RyhB2为模型鉴定了sRNA的存在与Hfq相互作用,为其他RNA的体内验证提供了可借鉴的方法。本研究使用的标签抗体策略,对某些难以获得高纯度抗体的RNA结合蛋白研究同样具有借鉴意义。
[1]Waters L S,Storz G.Regulatory RNAs in bacteria[J].Cell,2009,136(4):615-628.
[2]Brantl S.Regulatory mechanisms employed by cis-encoded an⁃tisense RNAs[J].Curr Opin Microbiol,2007,10(2):102-109.
[3]Vogel J,Sharma C M.How to find small non-coding RNAs in bacteria[J].Biol Chem,2005,386(12):1219-1238.
[4]Liu M Y,Gui G,Wei B,et al.The RNA molecule CsrB binds to the global regulatory protein CsrA and antagonizes its activity in Escherichia coli[J].J Biol Chem,1997,272(28):17502-17510.
[5]Brennan R G,Link T M.Hfq structure,function and ligand binding[J].Curr Opin Microbiol,2007,10(2):125-133.
[6]Vecerek B,Moll I,Afonyushkin T,et al.Interaction of the RNA chaperone Hfq with mRNAs:direct and indirect roles of Hfq in iron metabolismof Escherichia coli[J].Mol Microbi⁃ol,2003,50(3):897-909.
[7]Aiba H.Mechanism of RNA silencing by Hfq-binding small RNAs[J].Curr Opin Microbiol,2007,10:134-139.
[8]Valentin H P,Johansen J,Rasmussen A A.Small RNAs con⁃trolling outer membrane porins[J].Curr Opin Microbiol,2007,10:152-155.
[9]Masse E,Escorcia F E,Gottesman S.Coupled degradation of a small regulatory RNA and its mRNA targets in Escherichia coli[J].Genes Dev,2003,17:2374-2383.
[10]Toledo-AranaA,RepoilaF,CossartP.Smallnon-coding RNAs controlling pathogenesis[J].Curr Opin Microbiol,2007,10(2):182-188.

