苏云金芽孢杆菌MS7培养条件的优化
杨航聪,金松松,黄晶晶,陈 敏
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
苏云金芽孢杆菌MS7培养条件的优化
杨航聪,金松松,黄晶晶,陈 敏
(杭州师范大学生命与环境科学学院,浙江 杭州 310036)
通过单因子试验对苏云金芽孢杆菌MS7菌株的培养条件进行优化.研究表明,该菌株的最佳培养基组成和发酵条件为:蔗糖10.0 g/L、牛肉膏10.0 g/L、K2HPO42.0 g/L,初始发酵pH 7.0,装液量25 mL,培养温度35 ℃,培养时间36 h,优化后细菌总数可达1.2×108CFU/mL.
苏云金芽孢杆菌;培养基;培养条件优化
芽孢杆菌(Bacillus)是一类好氧的G+细菌,具有繁殖快、活力强的特点,极易分离培养,且产生的芽孢在环境中能存活较长时间,具有极强的适应性,一直以来是微生物菌剂重点研究开发的对象,并广泛应用于病害生物防治[1]和环境生态修复[2]等领域.据报道,美国迄今已有 4 株芽孢杆菌生防菌株获得环保局商品化或有限商品化生产应用许可[3].澳大利亚开发的B.subtilisA-B 对麦类和胡萝卜立枯病以及其他土传病害具有良好的防治和增产作用[4].日本东京技术研究所的2株枯草芽孢杆菌分别对Rhizoctoniasolani、Fusariumoxysporum和Pseudomonassolanacearum引起的番茄病害有良好的防效[5].
苏云金芽孢杆菌(Bacillusthuringiensis) MS7分离自富营养化水体,是具有高效溶藻活性的菌株,有关该菌株的分离鉴定、溶藻效果和溶藻方式等特性本课题组已作相关报道[6].本研究目的是通过对苏云金芽孢杆菌MS7营养要求和培养条件的研究,筛选适合该菌株生长的发酵培养基,为芽孢杆菌微生物制剂在养殖水体水质净化方面的应用提供理论依据.
1 材料和方法
1.1 菌株
苏云金芽孢杆菌MS7:本实验室分离保藏.
1.2 培养基
LB培养基:胰蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 5.0 g/L,琼脂粉20.0 g/L,pH 7.2.
碳源基础培养基:蛋白胨10.0 g/L,NaCl 5.0 g/L,pH 7.2.
氮源基础培养基:蔗糖10.0 g/L,NaCl 5.0 g/L,pH 7.2.
无机盐基础培养基:蔗糖10.0 g/L,蛋白胨10.0 g/L,pH 7.2.
1.3 种子液制备
将菌种于LB斜面培养基活化后,接入LB液体培养基,37 ℃,160 r/min摇床培养12 h.
1.4 细菌生长量测定
种子液以5%接种量接入装有50 mL发酵培养基的250 mL三角瓶中,37 ℃,160 r/min培养24 h后,在600 nm处测定光密度.
1.5 菌株培养条件的优化
1.5.1 最适碳源试验
在碳源基础培养基中,分别添加葡萄糖、蔗糖、可溶性淀粉、糊精、玉米粉各 10.0 g/L,每个配方设置3个重复,分别测定光密度值,选择对生长最有利的碳源.
1.5.2 最适氮源试验
在氮源基础培养基中,分别添加黄豆粉、蛋白胨、牛肉膏、 (NH4)2SO4和酵母浸出汁各 10.0 g/L,每个配方设置3个重复,分别测定光密度值,选择对生长最有利的氮源.
1.5.3 无机盐成分试验
在无机盐基础培养基中,分别添加NaCl、K2HPO4和MgSO4进行单因子试验,每组试验设置3个重复,根据600 nm的吸光度值,确定培养基的无机盐组成.
1.5.4 培养温度对菌株生长的影响
分别设置15、25、35、45 ℃ 4个温度梯度,160 r/min培养24 h测光密度值,每组试验设置3个重复.
1.5.5 培养基初始pH对菌株生长的影响
分别设置初始pH为6.0、7.0、8.0、9.0和10.0,160 r/min培养24 h测光密度值,每组试验设置3个重复.
1.5.6 培养基装量对菌株生长的影响
用250 mL三角瓶分别装料15、25、50、75、100 mL,在同一条件下发酵试验,培养24 h测光密度值,每组试验设置3个重复.
1.5.7 生长曲线的测定
在优化培养基和培养条件下,每间隔6 h取样,600 nm测定发酵液的光密度值,平板计数法测定细菌总数,以培养时间为横坐标、光密度值为纵坐标,绘制生长曲线.
2 结果与分析
2.1 碳源对MS7菌株生长的影响
改变培养基中的碳源成分,MS7菌株24 h生长的结果如图1所示.以蔗糖作为碳源时,菌株的生长量最高,其次是葡萄糖和淀粉.以玉米粉为唯一碳源时,菌株的生长量最低.
2.2 氮源对MS7菌株生长的影响
据报道,氮源作为微生物生长的重要因素在不同种属间有较大差异.改变培养基中的氮源成分,菌株生长情况如图2所示.结果显示,以牛肉膏作为氮源时,菌株的生长量最高,其次是酵母膏和蛋白胨,以硫酸铵和黄豆粉为唯一氮源时,生长量都很低.
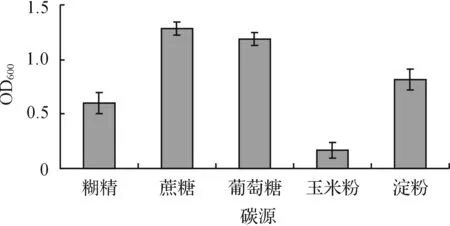
图1 碳源对MS7菌株生长量的影响Fig. 1 Effect of carbon sources on biomass of strain MS7

图2 氮源对MS7菌株生长量的影响Fig. 2 Effect of nitrogen sources on biomass of strain MS7
2.3无机盐对MS7菌株生长的影响

表1 无机盐对MS7菌株生长量的影响Tab. 1 Effect of inorganic salt on biomass of strain MS7
CK:不添加无机盐.
不同种类的无机盐对菌株生长的影响见表1.与对照比较,添加单一无机盐K2HPO4时生长较好.同时添加K2HPO4、NaCl和MgSO4时,菌株的生长较添加单一无机盐时有一定程度的提高,但差异不显著.考虑成本因素后将K2HPO4作为培养基中的唯一无机盐添加成分.
2.4生长温度对MS7菌株生长的影响
温度对菌株生长影响见图3.结果显示,在25~45 ℃温度范围内菌株都能生长,但以 35 ℃时菌株生长量最高,45 ℃时生长量下降明显,而在15 ℃时菌株不生长(数据未显示).
2.5 培养基初始pH值对MS7菌株生长的影响
调节培养基的初始pH值,试验在不同培养基初始pH值条件下对菌株生长的影响.结果如图4所示,菌株在pH 6.0~9.0的范围内均能生长,其中pH 7.0时生长量最高,pH 10.0时菌株不生长.

图3 温度对MS7菌株生长量的影响Fig. 3 Effect of temprature on biomass of strain MS7

图4 培养基初始pH值对MS7菌株生长量的影响Fig. 4 Effect of pH on biomass of strain MS7
2.6 培养基装量对MS7菌株生长的影响
用250 mL三角瓶分别装料15、25、50、75和100 mL,在同一条件下发酵试验,结果如图5.装液量对菌株的生长有较大影响,装液量为25 mL时生长最好,说明该菌株对通气量的要求较高,是好氧性细菌,发酵过程需要充足的氧气.
2.7 MS7菌株生长曲线的测定
在以上优化的培养基和培养条件下,菌株的生长曲线测定结果表明,在发酵6 h以后,菌株生长进入对数期;24 h时菌株生长基本进入平稳期,经平板计数活菌数为1.2×108CFU/mL;42 h以后生长呈下降趋势(图6).造成发酵后期生长下降的原因可能是发酵液中营养耗竭,pH等环境条件变化及部分有毒代谢产物的累积.

图5 培养基装量对MS7菌株生长量的影响Fig. 5 Effect of medium volume on biomass of strain MS7

图6 MS7菌株生长曲线Fig. 6 The growth curve of strain MS7
3 讨 论
微生物菌剂从实验室走向应用是一个复杂的过程,要成功地开发利用微生物菌剂,除了通过有效方法筛选到优良菌株以外,培养基的优化以及发酵工艺条件的确定尤为重要.前期研究表明,MS7菌株的溶藻作用与细胞的浓度密切相关,即细胞浓度越高溶藻效果越明显,达到最佳溶藻效果的时间越短[6],因此,作为开发微生物菌剂的前提条件,获得MS7菌株高密度发酵培养物成为其中的关键环节之一,而实验室发酵条件的研究,是进行产业化生产的前期基础性研究,可为工业化生产提供相应的技术参数.
细菌的生长受到包括培养基等培养条件在内的多方面因素的影响.通过研究培养基中不同碳源、氮源等营养物质以及不同发酵温度等发酵条件对菌株生长的影响,优化培养基的组分,可获得高水平的细菌生长量.有关这方面的研究报道很多,如张丽霞等[7]采用 Plackett-Bruman 设计法和响应面分析法,在摇瓶发酵条件下,使含菌量明显提高;张根伟[8]通过单因素实验和正交实验,对枯草芽孢杆菌 BS-6 液体发酵条件进行了研究;郭小华等[9]也在枯草芽孢杆菌 MA139 增殖培养基的优化研究中,使芽孢产量大幅度提高.本研究表明,MS7菌株的最佳培养基组成和发酵条件为:蔗糖10.0 g/L、牛肉膏10.0 g/L、K2HPO42.0 g/L,初始发酵pH7.0,装液量25 mL,培养温度35 ℃,培养时间36 h,优化后细菌总数可达1.2×108CFU/mL.
本研究仅在单因子水平对MS7的培养条件进行了初步试验,还需要进一步通过正交试验或响应面分析法等确定各类营养物质的合理配比,并通过上罐发酵确定相应的发酵参数,后续研究将另文报道.
[1] 刘雪,穆常青,蒋细良,等.枯草芽孢杆菌代谢物质的研究进展及其在植病生防中的应用[J].中国生物防治,2006,22(S1):179-184.
[2] 李超,吴为中,吴伟龙,等.解淀粉芽孢杆菌对鱼腥藻的抑藻效果分析与机理初探[J].环境科学学报,2011,31(8):1602-1608.
[3] 张文君.美国生物农药登记管理情况[J].农药科学与管理,2002,23(2):43-44.
[4] Baker K F. Evolving concepts of biological control of plant pathogens[J]. Ann Rev Phytopathol,1987,25:67-85.
[5] Asaka O, Shoda M. Biocontrol ofRhizoctoniasolanidamping-off of tomato withBacillussubtilisRBI4[J]. Appl Environ Microbiol,1996,62(11):4081-4085.
[6] 黄晶晶,汪雪婷,夏赛周,等.溶藻细菌MS7的分类鉴定及其溶藻活性的初步研究[J].海洋与湖沼,2013,44(3):632-636.
[7] 张丽霞,李荣禧,王琦,等.枯草芽孢杆菌发酵培养基的优化[J].中国生物防治,2006,22(S1):82-88.
[8] 张根伟.枯草芽孢杆菌BS-6液体发酵条件的研究[J].河北省科学院学报,2005,22(1):54-57.
[9] 郭小华,陆文清,邓萍,等.益生枯草芽孢杆菌MA139增殖培养基的优化[J].中国农业大学学报,2006,11(3):41-46.
OptimizationofCultureConditionsforBacillusthuringiensisMS7
YANG Hangcong, JIN Songsong, HUANG Jingjing, CHEN Min
(College of Life and Environmental Sciences, Hangzhou Normal University, Hangzhou 310036, China)
The culture conditions ofBacillusthuringiensisMS7 were optimized through the single factor test. The optimal medium consisted of sucrose 10.0 g/L, beef cream 10.0 g/L and K2HPO42.0 g/L, the optimal fermentation condition was initial pH 7.0, liquid volume 25 mL, incubation temperature 35 ℃ and culture time 36 h. After the optimization, the viable number ofBacillusthuringiensisMS7 reached to 1.2×108CFU/mL.
Bacillusthuringiensis; medium; optimization of culture conditions
2013-07-05
杭州市科技发展计划项目(20101032B26);浙江省大学生科技创新活动计划暨新苗人才计划项目(2013R421052).
陈 敏(1963—),女,教授,主要从事微生物研究.E-mail: mchen63@163.com
10.3969/j.issn.1674-232X.2013.06.011
Q93
A
1674-232X(2013)06-0535-04
——化工原料、农副产品

