含硅十六元大环线性环化聚合物的控制合成及表征
傅凌子,泮晓芳,李 斌,李文清,胡自强,来国桥
(1. 杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121; 2. 杭州师范大学材料与化学化工学院,浙江 杭州 310036)
含硅十六元大环线性环化聚合物的控制合成及表征
傅凌子1,泮晓芳2,李 斌1,李文清1,胡自强2,来国桥1
(1. 杭州师范大学有机硅化学及材料技术教育部重点实验室,浙江 杭州 311121; 2. 杭州师范大学材料与化学化工学院,浙江 杭州 310036)
利用硅上的thorpe-ingold效应,设计并合成了非共轭的双甲基丙烯酸酯类的单体,通过原子转移自由基聚合(ATRP)方法控制合成了含十六元大环的线性环化聚合物,对所合成聚合物的结构进行了1H NMR、13C NMR和GPC的表征.
环化聚合物; thorpe-ingold;原子转移自由基聚合(ATRP)
主链含有大环的线性环化聚合物(Linear cyclo-polymer)[1]是一类通过双官能团单体分子内/分子间链增长交替进行而得到的新型聚合物.其中的大环可以通过设计而作为金属离子、有机小分子、手性分子(如氨基酸)等识别主体,因而这种聚合物有望作为金属离子分离、手性分离等分离材料的固定相.
环化聚合(Cyclopolymerization)是通过单体分子中的两个反应官能团经引发,先进行分子内环化、再分子间反应这两种链传递反应交替进行的聚合反应,是合成线性环化聚合物的一种主要方法.由于环化聚合反应热力学稳定性的影响,成功合成的线性环化聚合物主要是含五元环、六元环的线性环化聚合物[2],形成大环线性环化聚合物的例子相对较少[1,3].笔者所在的课题组在研究硅上thorpe-ingold效应的基础上,设计了新型含硅的双甲基丙烯酸酯类的单体,利用ATRP引发体系成功合成了含十四元环的线性环化聚合物[4].为了考察利用硅上的thorpe-ingold效应能否适用含更大环的线性环化聚合物的合成,本文设计了相应的双甲基丙烯酸酯类的单体,并成功合成了含十六元环的大环线性环化聚合物.
1 实验部分
1.1 化学试剂
溴化亚铜:AR;1,3-丙二醇:98%,AR;甲基丙烯酰氯:97%,AR;α-溴代异丁酸:98%,AR;二苯基二氯硅烷:98%;N,N,N′,N,′N″-五甲基二亚乙基三胺(PMDETA):AR;苯甲醇:AR;咪唑:AR;二氯甲烷:AR;甲醇:AR;三乙胺:AR.
1.2 含硅的双甲基丙烯酸酯单体的合成
在干燥的250 mL双颈圆底瓶中,加入3.6 mL 1,3丙二醇(50 mmol)、8.0 mL三乙胺(60 mmol)和100 mL二氯甲烷,搅拌溶解.在冰水浴下,缓慢滴加含有5.23 g甲基丙烯酰氯(50 mmol)和50 mL二氯甲烷的溶液.滴加完毕后,室温下继续搅拌反应4 h,反应结束后,依次用0.1 mol/L HCl、饱和NaHCO3洗涤除去三乙胺盐酸盐,再用无水Na2SO4干燥.旋蒸除去二氯甲烷,柱层析(V(乙酸乙酯)/V(正己烷二)=1∶4)得到2.81 g化合物1(图1),甲基丙烯酸羟基丙酯,收率39%.1H NMR (400 MHz, CDCl3) δ 6.07 (s, 1H), 5.54 (s, 1H), 4.25 (t, 2H), 3.66 (t, 2H), 2.69 (s, 1H), 1.89 (s, 3H), 1.86 (m, 2H).13C NMR(100 MHz, CDCl3) δ 167.9, 136.1, 125.8, 61.6, 59.0, 31.7, 18.3.
在干燥(100 mL)双颈圆底瓶中,加入2.88 g化合物1(20 mmol),1.56 g咪唑(23 mmol)和40 mL二氯甲烷,搅拌溶解.在冰水浴下,缓慢滴加含有2.53 g Ph2SiCl2(10 mmol)和20 mL二氯甲烷的溶液,滴加完毕后,室温下反应过夜.反应结束后,过滤除去咪唑盐酸盐,滤液用饱和碳酸氢钠溶液、饱和食盐水分别洗涤2次,再用无水Na2S04干燥除水,旋蒸除去二氯甲烷.柱层析(V(乙酸乙酯)/V(正已烷)=1∶20)得到3.81 g化合物2(图2),收率81%.1H NMR (400 MHz, CDCl3) δ 7.65 (d, 4H), 7.46~7.34(m, 6H), 6.04 (s, 2H), 5.53 (s, 2H), 4.30 (t, 4H), 3.90 (t, 4H), 1.97 (quint, 4H),1.90 (s, 6H).13C NMR (100 MHz, CDCl3) δ 167.4, 136.3, 134.9, 132.3, 130.5, 128.0, 125.5, 61.4, 59.5, 31.4, 18.4. HRMS (ESI) calcd for C26H32O6Si: 468.196 8; found: 468.197 1.

图1 化合物1的结构Fig. 1 Structure of compound 1

图2 化合物2的结构Fig. 2 Structure of compound 2
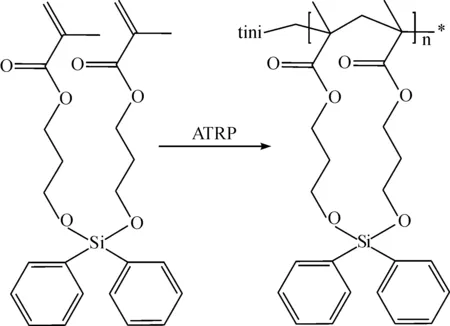
图3 化合物2的ATRP反应过程Fig. 3 ATRP of compound 2
1.3 α-溴代异丁酸苄酯(BBIB)的合成
在干燥的100 mL三颈圆底瓶中,加入5 g(30 mmol)α-溴代异丁酸和30 mL干燥的氯仿,搅拌.在冰水浴下,缓慢滴加含有23 mL SOCl2(40 mmol)和25 mL氯仿的溶液.滴加完毕后,60 ℃下继续反应4 h.反应结束后,减压蒸馏除去溶剂及未反应的SOCl2,得到产物4.5 g α-溴代异丁酰氯,收率89%.
在干燥的100 mL两颈瓶中,加入2.9 g苯甲醇(26 mmol),4.0 mL三乙胺(29 mmol)和40 mL二氯甲烷,搅拌溶解.冰水浴下缓慢滴加含有4.5 g α-溴代异丁酰氯(26 mmol)和30 mL二氯甲烷的溶液,滴完后继续反应1 h,再在室温下反应4 h.反应结束后,滤去三乙胺盐酸盐,用饱和碳酸氢钠溶液、饱和食盐水分别洗涤2次,用无水Na2SO4干燥,柱层析(V(乙酸乙酯)/V(正己烷)=1∶6)得到4.9 g无色透明液体,产率81%.1H NMR (400 MHz, CDCl3) δ 7.39~7.34(m, 5H), 5.22(s, 2H), 1.96(s, 6H).13C NMR (100 MHz, CDCl3) δ 171.5,135.5,128.7,128.4,128.0,67.6,55.8,30.8.
1.4 双丙烯酸酯环化聚合物的控制聚合
按照n(CuBr)∶n(L)∶n(BBIB)∶n(M) =1∶2∶1∶50,其中L为配体PMDETA,M为环化单体化合物2,体系中V(M):V(PhMe)=1∶14,在反应管中,先加入CuBr,抽真空—充氮气反复3次,再加入PhMe,PMDETA,超声波溶解后,加入单体,放入70 ℃的油浴中,恒温10 min后,加入BBIB封管,开始聚合反应(图3).反应6 h后,取出反应管,样品用甲醇进行沉淀,过滤,真空干燥至恒重,得聚合物3.1H NMR (400 MHz, CDCl3) δ 7.84~7.52 (br,4H),7.52~7.04 (br,6H),4.57~3.41 (br,8H), 2.31~1.47 (br,7H),1.43~0.51 (br,7H).13C NMR (100 MHz,CDCl3) δ 177.3,135.9,134.4,130.5,128.0,62.1,60.0,45.2,31.2,18.6,16.1.
1.5 产物表征
相对分子质量及分子质量分布用WATERS/1525型凝胶液相色谱仪测定,温度35 ℃,聚甲基丙烯酸甲酯为标准,淋洗液为THF,流速1 mL/min.1H NMR和13C NMR测定用Brucker Advance 400 (400 MHz)核磁共振谱仪,CDCl3为溶剂,TMS为内标.
2 结果与讨论
2.1 环化聚合单体的合成
环化聚合单体通过由1,3-丙二醇和甲基丙烯酰氯生成的甲基丙烯酸羟基丙酯与二苯基二氯硅烷反应得到.甲基丙烯酸羟基丙酯为单酯,因此,在合成过程中需控制反应体系中1,3-丙二醇的浓度在0.3~0.5 mol/L,同时,通过控制反应处于低温(0 ℃)和缓慢的滴加速度来降低副反应二酯的生成.图4为甲基丙烯酸羟基丙酯的1H NMR,由图4可知,δ=4.25(2H),3.66(2H)应分别归属甲基丙烯酸羟基丙酯中的酯亚甲基峰(—CH2—OOC)和羟亚甲基峰(—CH2—OH),这两种氢的峰面积比为1∶1,符合单酯化的特征.δ=2.69(1H)归属羟基峰.δ=1.86~1.89(5H)应归属羟基丙酯中的亚甲基(—CH2—CH2OH)和甲基丙烯酰基中的甲基(—CH3)的重叠峰.δ= 6.07(1H),5.54 (1H)的峰应归属于甲基丙烯酸酰基中的双键上的质子峰(=CH2).以上结果符合单酯的理论值,所得化合物1的13C NMR与目标单体的结构相符.因此,通过1,3丙二醇和甲基丙烯酰氯反应,得到的化合物1为甲基丙烯酸羟基丙酯.

图4 化合物1的1H NMRFig. 4 1H NMR of compound 1
图5为反应所得环化聚合单体化合物2的1H NMR.由图5可知,δ=7.35~7.65(10H)应归属硅苯基峰(C6H5—Si),δ= 6.07(2H),5.54 (2H)的峰则为甲基丙烯酸酰基中的双键峰(=CH2),δ=3.90(4H)和4.30(4H)处的峰为单体中的酯亚甲基峰(—CH2—OOC)和硅醚亚甲基峰(—CH2—OSi),甲基丙烯酸羟基丙酯中δ=2.69处的羟基峰已完全消失,说明甲基丙烯酸羟基丙酯中的羟基已完全酯化.δ=1.90(6H)和1.97(4H)的多重峰分别归属于甲基丙烯酰基中的甲基(—CH3)和丙酯中的亚甲基(—CH2—CH2O—).以上结果符合目标单体的理论值.所得化合物2的13C NMR以及HRMS也与目标单体的结构相符.

图5 化合物2的1H NMRFig. 5 1H NMR of compound 2
2.2 双丙烯酸酯环化聚合物的控制合成及结构

图6 70 ℃下所得聚合物3的GPC曲线图Fig. 6 GPC curves of 3 obtained at 70 ℃
大环环化聚合物不易合成,主要原因是其单体在成环过程中产生的立体张力和熵损失,以及分子内成环与分子间反应(导致交联聚合等副反应)的竞争的影响.成功实现环化聚合的关键,是在聚合过程中使分子内环化的速率快于分子间反应,从而使反应由先分子内、再分子间交替进行.为此,笔者利用硅上的thorpe-ingold效应[4-6],设计了有利于单体(化合物2)中两反应官能团相互接近的构象,提高分子内环化反应的速率,同时,通过调整体系的单体反应浓度来降低分子间的反应速率,从而实现有效的环化聚合反应.ATRP是实现分子结构有效控制的高分子合成技术[7],笔者利用此反应体系控制目标大环聚合物的合成及实现对聚合物的结构控制.聚合体系中,反应物的配料比为n(CuBr)∶n(L)∶n(BBIB)∶n(M) = 1∶2∶1∶50,其中PhMe是作为溶剂加入,它和单体的体积比为V(M)∶V(PhMe) = 1∶14,反应在较稀的浓度下进行.所得的聚合物3在氯仿等有机溶剂中具有较好的溶解性.图6为所得聚合物的GPC曲线图.从图中可看出,GPC曲线峰形均匀对称,所得的聚合物具有极窄分子质量分布,PDI=1.13,聚合物的分子质量为6 400,说明聚合体系对聚合物的结构具有良好的可控性.
同时,对所合成的聚合物用1H NMR进行了表征(图7).由图7可见,引发剂引发化合物2聚合后,在

图7 聚合物3的1 H NMRFig. 7 1H NMR of polymer 3
聚合物3的1H NMR谱图上,δ=6.07,5.54 ppm处烯键质子峰已基本消失,而在δ=2.31~1.47处出现属于聚合物3中烯键聚合后生成的亚甲基和甲基峰(—CH2—CH—),说明单体上的烯键已基本反应;δ=7.04~7.84 ppm应归属于引发剂BBIB和聚合物3中的苯环叠加峰(C6H5—),δ=5.22 ppm为BBIB中与苯环相连的酯亚甲基峰(C6H5—CH2—),而δ=4.57~3.41 ppm则属于聚合物3中的酯亚甲基峰(—CH2—OOC)和硅醚亚甲基峰(—CH2—OSi),δ=1.43~0.51处的为甲基峰(—CH3).聚合物3中的苯基、酯亚甲基峰和硅醚亚甲基峰、烯键加成后的亚甲基、甲基峰的峰面积比接近10∶8∶8∶6,与聚合物的理论值相符.同时通过δ=5.22 ppm的峰面积与酯亚甲基峰(—CH2—OOC)和硅醚亚甲基峰(—CH2—OSi)的峰面积可以计算出聚合物的分子质量m(NMR)=6 500,与m(GPC)=6 400相一致,聚合物3的13C NMR与目标聚合物的理论值相符.
3 结 论
以甲苯为介质,以BBIB/CuBr/PMDETA为引发体系引发含硅的双丙烯酸酯单体,利用硅上的thorpe-ingold效应,通过ATRP反应,得到了含十六元大环、PDI=1.13窄分子质量分布的线性环化聚合物.
[1] Sakai R,Satoh T,Kakuchi R,etal. Helicity induction of polyisocyanate with a crown cavity on the main chain synthesized by cyclopolymerization of α,ω-diisocyanate[J]. Macromolecules,2004,37(11):3996-4003.
[2] Coluccini C,Metrangolo P,Parachini M,etal. “Push-pull” supramolecular chromophores supported on cyclopolymers[J]. J Polym Sci Part A: Polym Chem,2008,46(15):5202-5213.
[3] Ochiai B,Ootani Y,Endo T. Controlled cyclopolymerization through quantitative 19-membered ring formation[J]. J Am Chem Soc,2008,130(33):10832-10833.
[4] Hu Ziqiang,Xu Yongping,Wu Di,etal. Thorpe-ingold effect on the ATRP-induced cyclopolymerization of bismethacrylate tethered by a substituted silylene moiety[J]. Macromol Chem Phys,2012,213(5):566-571.
[5] Luh Tienyau, Hu Ziqiang. Thorpe-ingold effect in organosilicon chemistry[J]. Dalton Trans,2010,39:9185-9192.
[6] Cheng Yenju, Luh Tienyau. Synthesis, light-harvesting, and energy-transfer properties of regioregular silylene-spaced alternating[(donor-SiMe2-)n=1-3-(acceptor-SiMe2)] copolymers[J]. Chem Eur J,2004,10(21):5361-5368.
[7] Wang Jinshan,Matyjaszewski K. Controlled/“Living” radical polymerization. Atom transfer radical polymerization in the presence of transition-metal complexes[J].J Am Chem Soc,1995,117(20):5614-5615.
TheControllableSynthesisandCharacterizationof16-memberedRingLinearCyclopolymerwithSilicon
FU Lingzi1, PAN Xiaofang2, LI Bin1, LI Wenqing1, HU Ziqiang2, LAI Guoqiao1
(1.Key Laboratory of Organosilicon Chemistry and Material Technology of Ministry of Education, Hangzhou Normal University,Hangzhou 311121, China; 2.College of Material, Chemistry and Chemical Engineering, Hangzhou Normal University,Hangzhou 310036, China)
The unconjugated bis methylacrylate monomer was designed and synthesized with the thorpe-ingold effect on silicon. The linear cyclopolymer with 16-membered ring was obtained by atom transfer radical polymerization. The structure of the cyclopolymer was characterized by1H NMR,13C NMR and gel permeation chromatography (GPC).
cyclopolymer; thorpe-ingold; atom transfer radical polymerization(ATRP)
2013-09-18
浙江省自然科学基金项目(LY12B04006).
胡自强(1963—),男,副教授,博士,主要从事活性聚合研究.E-mail:huzq2000@hznu.edu.cn
10.3969/j.issn.1674-232X.2013.06.003
O631
A
1674-232X(2013)06-0491-05

