利用结构多样性的对硝基苯酚羧酸酯和脂肪醇乙酸酯评估7个枯草芽胞杆菌酯水解酶的指纹图谱
刘佳言,钱 乐,郑高伟,许建和
(华东理工大学 生物反应器工程国家重点实验室,上海 200237)
传统的生物催化剂筛选方法通常是从土壤中分离微生物,既耗时又耗力[1]。现在随着微生物基因组数据的迅速增长,在实验室中得到具有某一功能的酶正变得越来容易[2-4]。枯草芽胞杆菌的基因组序列早在1997年就已经公布[5],30个基因被预测可能为水解酶,其中一些酶已经被鉴定和表征,例如Lip A 和 Lip B[6-9]。另外,来自B.subtilis Thai I-8的羧酸酯酶NP(由nap基因编码)已被用于拆分非甾体抗炎药物[10]。酶 YbfK(由 ybfK基因编码),被报道能催化水解外消旋的 IPG(1,2-O-isopropyl-ideneglycerol)辛酸酯生成e.e.值为 99.9%的(S)-IPG[11-12]。来自枯草芽胞杆菌 NRRL B8079的对硝基苄基酯酶也在1995年在大肠杆菌中被克隆、表达和表征[12-13]。枯草芽胞杆菌DSM402中基因名为yvak的酯酶也被发现能催化水解1-苯乙醇乙酸酯并具有很高的对映选择性(E>150)[14]。枯草芽胞杆菌ECU0554的酯酶能在高底物浓度(1 mol/L)下催化拆分薄荷醇,具有极高的对映选择性(E>200),并被克隆表达于大肠杆菌中[15-16]。然而,枯草芽胞杆菌中仍有许多水解酶的性质和功能尚未被研究报道。
尝试对模式菌枯草芽胞杆菌168的基因组进行挖掘,试图发现具有应用潜力的水解酶。本工作成功表达了7个具有明显酯水解活力的枯草芽胞杆菌酯酶,其氨基酸序列分析表明,它们分别属于5个不同的亚家族,具有遗传多样性。接着通过高通量的方法分别研究它们对结构多样的酸和醇的底物特异性和多样性,并且考察其对工业相关手性酯水解的对映选择性。
1 材料与方法
1.1 菌株
枯草芽胞杆菌(B.subtilis 168)由中科院植物生理生态研究所杨晟研究员馈赠。大肠杆菌E.coli DH5α用于克隆实验,E.coli BL21(DE3)用于重组酶的表达,皆为本实验室保藏。
1.2 培养基
LB培养基(g/L):NaCl 10,蛋白胨10,酵母粉5;于121℃高压灭菌20 min。
自诱导培养基(g/L):蛋白胨10,酵母粉5,Na2HPO48.95,KH2PO43.4,NH4Cl 2.67,Na2SO40.71,MgSO40.24,甘油 5,葡萄糖 0.5,乳糖 2;于115℃高压灭菌30 min。
1.3 酯酶的克隆和表达
枯草芽胞杆菌168中30个预测为水解酶的基因被逐一克隆[5],经过PCR扩增后酶切连接于表达载体pET-28a,并转化到宿主E.coli BL21(DE3)中进行重组表达。
所有重组子在LB培养基中培养种子液(37℃),在自诱导培养基[17]中培养20 h(25℃)。细胞经离心(6500 r/min 10 min)收集后,用磷酸盐缓冲液洗涤2次(0.1 mol/L,pH 7.0),再超声破碎。以SDS-PAGE考察基因的表达情况,用Bradford法检测蛋白浓度。破碎后的上清酶液冻干后于4℃保存备用。
1.4 酶活检测
重组酶酶活力检测参照文献[18]。酶活单位(U)定义为在检测条件下每分钟产生1.0 μmol对硝基苯酚所需要的酶量。
1.5 底物特异性
1.5.1 酶对对硝基苯酚羧酸酯的底物特异性
利用对硝基苯酚酯酶促水解生成黄色的对硝基苯酚[19]检测酯酶的活力,所用底物具有结构多样性(图1)。配制底物母液,底物溶于二甲基亚砜(DMSO),浓度为1 mmol/L。反应体系为:酶溶液10 μL,底物母液50 μL 和 KPB 缓冲液140 μL(100 mmol/L,pH 7.0)。将以上溶液迅速加入96孔板放入酶标仪,30℃振荡10 s后,在404 nm下每隔20 s检测1次吸光值,共10 min。
1.5.2 酶对不同醇乙酸酯的底物特异性
采用对硝基苯酚作为pH指示剂,检测乙酸酯酶促水解所生成的乙酸量[20],所用检测底物见图2。检测液组成:30 mmol/L底物/乙腈溶液420 μL,乙腈470 μL,1 mmol/L对硝基苯酚溶液6 mL(溶于5.0 mmol/L BES缓冲液,pH 7.2),以及5.0 mmol/L N,N-双(2-羟乙基)-2-氨基乙磺酸BES缓冲液(pH 7.2)5.11 mL。取酶液5和100 μL上述检测液快速加入96孔酶标板,放入酶标仪检测。在25℃振荡10 s,每30 s检测404 nm处吸光值,共10 min,具体计算见式(1)。式中:dA/dt是每分钟在404 nm处吸光值的变化值,cB是缓冲液浓度(mol/L),cin是指示剂对硝基苯酚的浓度(mol/L),Δε404是pH指示剂对硝基苯酚的质子化和非质子化2种结构的消光系数之差(17300 mol-1·L·cm-1),l是光程(酶标板中 105 μL液体的光程为0.306 cm),V为反应体积。

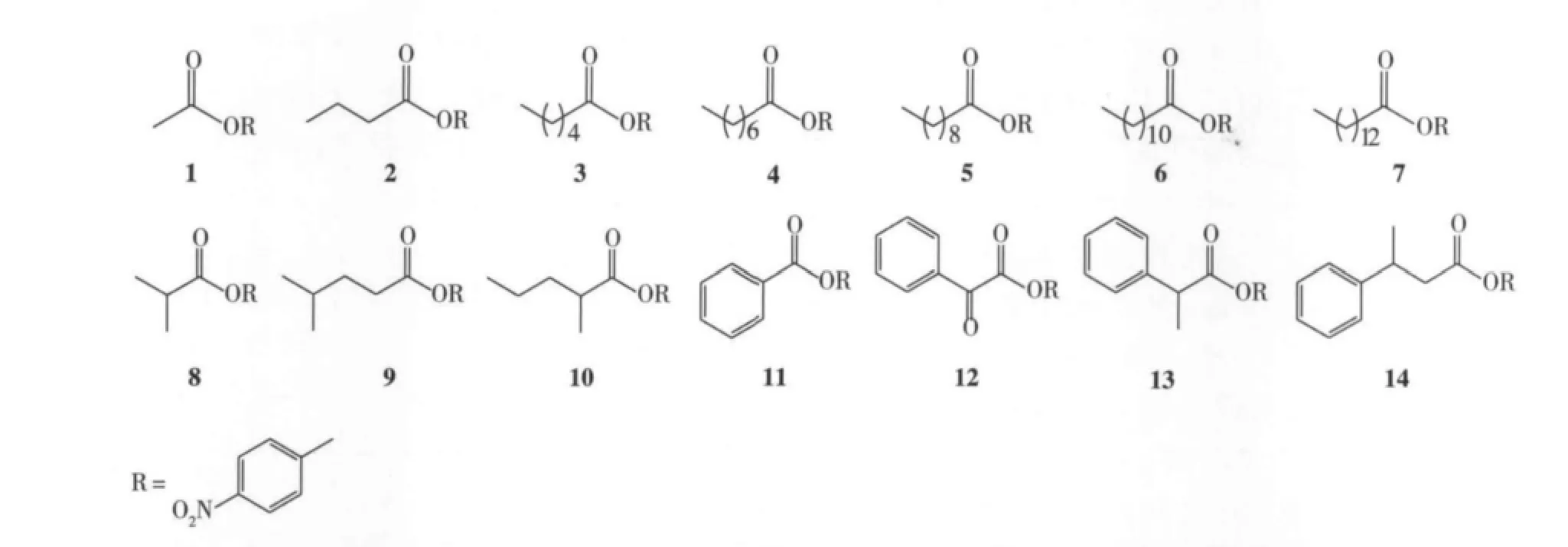
图1 用于表征枯草芽胞杆菌酯酶脂肪酸特异性的结构多样性对硝基苯酚酯Fig.1 Structure of p-nitrophenyl esters used for profiling substrate specificity of Bacillus subtilis esterases(BSEs)

图2 用于表征枯草芽胞杆菌酯酶底物特异性的醇乙酸酯Fig.2 Acetyl esters of alcohols for fingerprinting substrate specificity of BSEs
1.6 酶促水解手性底物的对映选择性
反应液包括10 mmol/L底物(图3)和酶溶液,反应条件见表1。反应试样用乙酸乙酯萃取或直接取有机相,干燥后进行高效液相色谱(HPLC)或气相色谱(GC)分析。酶的对映选择性(E)根据文献[21]中的公式计算。

图3 用于评估枯草芽胞杆菌酯酶对映选择性的工业相关底物Fig.3 Industrially relevant substrates for evaluating the enantioselectivity of BSEs

表1 酶催化手性底物水解的反应条件和检测方法Table 1 Reaction conditions and analytic methods for enzymatic hydrolysis of various substrates
2 结果与讨论
2.1 枯草芽胞杆菌酯酶(BSEs)的克隆、表达和进化关系分析
30个枯草芽胞杆菌(B.subtilis)168的预测为酯水解酶的基因被克隆,N端加入His6标签在大肠杆菌BL21(DE3)中表达,其中7个酶对对硝基苯酚乙酸酯和丁酸酯表现出明显的水解活力:PnbA,YitV,YvaK,Nap,SrfAD,LipB 和 Cah,YitV 是首次被报道。利用Megalign(DBAStar)软件对这些酯酶序列进行进化分析(图4)。由图4可知:它们属于α/β-fold水解酶家族中5个不同的亚家族[22]:亚家族Ⅰ(LipB),亚家族Ⅲ(Cah),亚家族Ⅴ(Nap和YvaK),亚家族Ⅵ(YitV)和亚家族Ⅶ(PnbA)。SrfAD与亚家族Ⅱ(GDSL亚家族)有最近的进化关系,但是SrfAD并没有Gly-Asp-Ser-(Leu)[GDS(L)]保守序列。因此,这些具有基因多样性、属于不同亚家族的酶,就有可能提供各种各样的催化功能。
2.2 酯水解酶对不同羧酸的对硝基苯酚酯的底物特异性
通过高通量检测7个枯草芽胞杆菌酯水解酶对不同羧酸的对硝基苯酚酯(1~14)的水解活力,考察它们对不同羧酸的底物特异性(图1),结果见图5。由图5可知这些酶除了Cah之外,大多对中短链脂肪酸(C4~C8)的对硝基苯酚酯表现出较高活力。Cah酶在以前的报道中为头孢菌素C脱乙酰化酶,它对对硝基苯酚乙酸酯表现出专一性的高活力[23]。另外,有趣的是SrfAD酶对芳香羧酸酯中的底物13具有最高活力,这与其他酶不尽相同。

图4 用MEGALIGN分析枯草芽胞杆菌中各酯水解酶的进化关系Fig.4 Phylogenetic analysis of all esterases and lipases from Bacillus subtilis 168

图5 用对硝基苯酚酯高通量表征7个枯草芽胞杆菌酯水解酶的脂肪酸特异性Fig.5 Substrate specificity of p-nitrophenyl esters of different fatty acids assayed in high-throughput format
2.3 酯水解酶对不同醇乙酸酯的底物特异性
以对硝基苯酚作为pH指示剂,检测不同醇的乙酸酯(15~23)(图2)水解所产生的酸度,由此考察酯水解酶对醇的底物特异性,结果见图6。由图6可知:Cah和PnbA酶对芳香醇乙酰酯(18~23)显示出明显的活力,但却很难水解脂肪醇的乙酸酯(15~17),这与文献[15,23]报道的结果一致。除此之外,Nap酶对化合物18、19和22,YvaK酶对化合物19,也有活力。但其他3个酶LipB、SrfAD和YitV并未被检测到明显活力。

图6 用乙酸酯高通量表征7个枯草芽胞杆菌酯水解酶的醇特异性Fig.6 Substrate specificity on acetyl esters of different alcohols assayed in high-throughput format
2.4 酯水解酶催化拆分工业相关手性化合物
在快速分析了7个酯水解酶的底物特异性后,又进一步考察了这些酶对一些工业相关手性酯的对映选择性水解。有关结果,如底物的 e.e.s或产物的e.e.p,底物的转化率和对映体选择率(E)等,列于表2。
大多数酶对外消旋手性芳基羧酸酯(24~27)的水解显示出较低的对映选择性(E<10),只有酶LipB水解底物24和酶Nap水解底物27时显示出中等的对映选择性(E分别为25.2和12.9)。而对于含有较大基团的底物26和27,仅Nap显示出显著的活性。
底物28~32是手性中心位于醇端的羧酸酯。对于底物28和29,所有酶都显示出一定的活力,而且Nap酶在催化水解底物28和29时显示出极好的选择性(E>200)。但是,大多数酶对底物30、31和32没有活力或活力很低,只有Cah对底物30和31显示了很高活力,但其对映选择性却很低(E<15)。YitV这个酶是第一次被表达和表征,它对底物29(2-萘乙醇乙酸酯)具有较高的对映选择性(e.e.p>95%)。此外还发现YitV酶在催化水解底物28(2-氯-1-苯乙醇乙酸酯)时,表现出不同于其他多数酶的独特的对映体偏爱性。根据Kazlauskas规则[24],仲醇羟基两侧取代基团的“尺寸”大小,取决于酶催化2种对映异构体速度的快慢,酶促水解(R)-型酯生成(R)-醇。2-氯-1-苯乙醇的羟基两侧取代基团中,大基团为苯基,中基团为—CH2Cl,但由于有氯原子而导致基团排序变化,普通酯酶/脂肪酶遵从Kazlauskas规则水解(S)-型酯,生成(S)-醇,但YitV在水解底物28(2-氯-1-苯乙醇乙酸酯)时选择性相反,即生成(R)-氯醇,其对映选择率(E)为13.5。

表2 7个枯草芽胞杆菌酯水解酶对手性工业相关产物的对映选择性Table 2 Performances of the seven enzymes in enantioselective hydrolysis of severalindustrially relevant chiral esters
3 结论
通过基因组数据挖掘,从枯草芽胞杆菌168中克隆表达酯水解酶,其中7个酶表现出明显的酯水解活力,它们分属于5个不同的亚家族。利用显色反应和pH指示剂法高通量地绘制了这7个酯水解酶的底物指纹谱,分析了酶的底物特异性和多样性。并且对这些酶催化拆分工业相关的手性化合物的对映选择性进行了考察,有趣的是,发现新酶YitV在水解仲醇乙酸酯时符合少见的反-Kazlauskas规则。本工作为通过基因组数据挖掘法发现有工业应用潜力的酶并高通量地筛选合适底物提供了一个案例。
[1]Lorenz P,Schleper C.Metagenome:a challenging source of enzyme discovery[J].J Mol Catal B:Enzymatic,2002,19:13-19.
[2]Kaluzna I A,Matsuda T,Sewell A K,et al.Systematic investigation of Saccharomyces cerevisiae enzymes catalyzing carbonyl reductions[J].J Am Chem Soc,2004,126:12827-12832.
[3]Liu J,Tang X,WangB,etal.Cloning,screeningand characterization of ester hydrolases with enantioselectivity in typical bacteria[J].Process Biochem,2010,45:475-480.
[4]TangX,Liu J,WangB,etal.Cloning,screeningand characterization of enantioselective ester hydrolases from Escherichia coli K-12[J].World J Microbiol Biotechnol,2011,27:129-136.
[5]Kunst F,Ogasawara N,Moszer I,et al.The complete genome sequence of the gram-positive bacterium Bacillus subtilis[J].Nature,1997,390:249-256.
[6]Eggert T,Pencreac'h G,Douchet I,et al.A novel extracellular esterase from Bacillus subtilis and its conversion to a monoacylglycerol hydrolase[J].Eur J Biochem,2001,267:6459-6469.
[7]Eggert T,van Pouderoyen G,Dijkstra B W,et al.Lipolytic enzymes LipA and LipB from Bacillus subtilis differ in regulation of gene expression,biochemical properties,and three-dimensional structure[J].FEBS Lett,2001,502:89-92.
[8]Eggert T,Brockmeier U,Dröge M J,et al.Extracellular lipases from Bacillus subtilis:regulation of gene expression and enzyme activity by amino acid supply and external pH[J].FEMS Microbiol Lett,2003,225:319-324.
[9]Dröge M J,BosR,WoerdenbagH J,etal.Chiralgas chromatography for the determination of 1,2-O-isopropylidene-snglycerol stereoisomers[J].J Sep Sci,2003,26:771-776.
[10]Quax W,Broekhuizen C.Development of a new Bacillus carboxyl esterase for use in the resolution of chiral drugs[J].ApplMicrobiol Biotechnol,1994,41:425-431.
[11]Droge M J,Bos R,Quax W J.Paralogous gene analysis reveals a highly enantioselective 1,2-O-isopropylideneglycerol caprylate esterase of Bacillus subtilis[J].Eur J Biochem,2001,268:3332-3338.
[12]Dröge M J,Bos R,Boersma Y L,et al.Comparison and functional characterisation of three homologous intracellular carboxylesterases of Bacillus subtilis[J].J Mol Catal B:Enzymatic,2005,32:261-270.
[13]Zock J,Cantwell C,Swartling J,et al.The Bacillus subtilis pnbA gene encoding p-nitrobenzyl esterase:cloning,sequence and highlevel expression in Escherichia coli[J].Gene(Amsterdam),1994,151:37-43.
[14]Henke E,Bornscheuer U T.Esterases from Bacillus subtilis and B.stearothermophilus share high sequence homology but differ substantially in their properties[J].Appl Microbiol Biotechnol,2002,60:320-326.
[15]Zheng G W,Yu H L,Zhang J D,et al.Enzymatic production of lmenthol by a high substrate concentration tolerable esterase from newly isolated Bacillus subtilis ECU0554[J].Adv Synth Catal,2009,351:405-414.
[16]Zheng G W,Pan J,Yu H L,et al.An efficient bioprocess for enzymatic production of L-menthol with high ratio of substrate to catalystusing whole cells of recombinant E.coli[J].J Biotechnol,2010,150:108-114.
[17]Studier F W.Protein production by auto-induction in high-density shaking cultures[J].Protein Expr Purif,2005,41:207-234.
[18]Zhao L L,Xu J H,Zhao J,et al.Biochemical properties and potential applications of an organic solvent-tolerant lipase isolated from Serratia marcescens ECU1010[J].Process Biochem,2008,43:626-633.
[19]Qian L,Liu J Y,Liu J Y,et al.Fingerprint lipolytic enzymes with chromogenic p-nitrophenyl esters of structurally diverse carboxylic acids[J].J Mol Catal B:Enzymatic,2011,73:22-26.
[20]Janes L E,Lowendahl A C,Kazlauskas R J.Quantitative screening of hydrolase libraries using pH indicators:identifying active and enantioselective hydrolases[J].Chem-Eur J,1998,4:2324-2331.
[21]Chen C S,Fujimoto Y,Girdaukas G,et al.Quantitative analyses of biochemical kinetic resolutions of enantiomers[J].J Am Chem Soc,1982,104:7294-7299.
[22]Arpigny J L,Jaeger K E.Bacterial lipolytic enzymes:classification and properties[J].Biochem J,1999,343:177-183.
[23]Takimoto A,Yagi S,Mitsushima K.High-level expression,purification,and some properties of a recombinant cephalosporin-C deacetylase[J].J Biosci Bioeng,1999,87:456-462.
[24]Kazlauskas R J,Weissfloch A N E,Rappaport A T,et al.A rule to predict which enantiomer of a secondary alcohol reacts faster in reactions catalyzed by cholesterol esterase,lipase from Pseudomonas cepacia,and lipase from Candida rugosa[J].J Org Chem,1991,56:2656-2665.

