外加氮源对葛仙米生长及光合生理的影响
邱昌恩,王卫东
(湖北师范学院生命科学学院,湖北 黄石 435002)
QIU Chang-en,WANG Wei-dong
葛仙米(Nostoc sphaeroides Kützing)是因东晋炼丹术家、医学家、道教理论家葛洪的名字而得名,古名天仙菜、天仙米、珍珠菜,俗称水木耳[1],学名称拟球状念珠藻。它是一种多细胞群体的淡水藻类,其主要形状为球形,少数为纺锤形、椭圆形、哑铃形或扁平状,与地木耳(N.commune)、发菜(N.flagelliforme)同属蓝藻门(Cyanophyta)、蓝藻纲(Cyanophyceae)、段殖藻目(Hormogonales),念珠藻科(Nostocaceae)、念珠藻属(Nostoc)[2]。发菜、地木耳及葛仙米均在原产地作为一种传统食品食用。葛仙米丝状体的外面有一共同的胶质衣鞘,易形成层状结构,比较坚固[3],呈墨绿色[4]。葛仙米在我国的主要分布地是湖北鹤峰县走马坪镇,生于水稻田中[5-10],为圆球状群体。湖北的房县[10]、陕西的灵丘、湖北的神农架林区、广西北流、广东仁化[5]、江西井冈山[11]、安徽九华山[12]与潜山[13]、山东[14]、烟台[15]等地有分布。葛仙米是一种具有自养固氮能力的微生物,其体内含有固氮酶,可以同化其生长所需的氮素营养。其它异养菌类很难从葛仙米培养基获得营养物质,葛仙米能在几乎无菌状态下生长。目前人工培养葛仙米的培养基大多采用无氮的BG110培养基。本次研究通过外加不同氮浓度的NaNO3来培养葛仙米,通过测量葛仙米的叶绿素a含量的多少来研究外加氮源对葛仙米生长的影响。光合作用是指光合色素(主要是叶绿素)的植物细胞和细菌吸收光能,将无机物转化为有机物并释放出氧气的过程。荧光是指物质吸收光能发出的较长波长的光,它是第一单线态的叶绿素分子由基态跃迁到激发态,激发态很不稳定,会释放能量回到基态,这种现象称荧光现象[16]。在正常生理温度条件下,绝大部分植物体内叶绿素荧光来自PSⅡ的天线色素系统,PSⅠ色素系统基本不发荧光[17]。因此利用荧光仪测得的叶绿素荧光参数来研究外加氮源对葛仙米光合生理的影响。有关部门对葛仙米进行化学成份分析,葛仙米中含有丰富的多糖及蛋白质,据记载,葛仙米具有明目益气、解热清膈、利肠胃、久食延年、清除疲劳、收敛、治夜盲症等功效[18]。据调查,鹤峰县近年来葛仙米产量大大降低,其原因是:农民不施农家肥而改施化肥,严重污染了土壤,如碳铵等肥料改变了土壤的酸碱性,另外,使用除草剂也改变了葛仙米赖以生存的生长环境,因此造成了葛仙米自然资源短缺,甚至有绝迹的可能[19]。本文研究了自养培养葛仙米的最适条件,旨在通过研究,为充分开发利用和保护这一宝贵资源提供科学依据。
1 材料与方法
1.1 材料
葛仙米藻种由中国科学院水生生物研究所提供,原始材料采自湖北省鹤峰县。
1.2 方法
1.2.1 藻种扩大培养 每升培养基取2 g鲜藻种,于研钵中研磨充分,加入3 L广口瓶中培养,培养基用BG110液体培养基,培养15 d左右,使葛仙米生长处于对数生长期时用于实验藻种。
1.2.2 外加氮源浓度设置及培养 实验设为5个处理,分别用实验组1~5表示,每个处理中NaNO3含量分别为 0.375、0.75、1.5(即 BG11 培养基)、3、6 g/L,以BG110无氮培养基为对照组,每组3个重复。取对数生长期的藻种对每个实验组进行等量接种,接种量为每升培养基按含300 μg叶绿素α(Chla)的标准接种。每个处理都用1 L锥形瓶,加600 mL培养基。实验在光照培养箱中通气培养,培养温度25℃,光照强度50~80 μmol photos m-2/s,光周期为(14∶10)。从接种当天开始,每隔2 d测一次叶绿素a含量及叶绿素荧光参数。
1.2.3 叶绿素 a含量的测定 参照 Scherer和Zhong(1991)的方法,将葛仙米新鲜的藻体匀浆后(如果色素能提取干净或藻体较少可不匀浆),加入100%甲醇,然后室温下过夜,于665 nm处测定OD值,叶绿素a含量用以下公式计算:

A为光密度值,∈为光系数74/cm/mg mL,l为比色杯的内径长度1 cm。最终得出的叶绿素浓度为mg/mL。
比生长速率μ的计算公式:

其中X2、X1为2个时间点的鲜重,(T2-T1)为测定2个时间的间隔。
1.2.4 叶绿素荧光参数的测定 荧光参数Fv/Fm、ØPSⅡ、ETR采用英国Hansatech公司生产的FMS-2便携调制式荧光仪测定。在培养葛仙米的锥形瓶中吸取30 mL葛仙米,抽滤后将滤纸于黑暗中放置 20 min,先照射检测光(<0.05 μmol/m2/s)再照射饱和脉冲光(12000 μmol/m2/s),测定Fv/Fm后,打开内源光化光(180 μmol/m2/s),5 min 后测 ØPSⅡ、ETR[20]。另外每个样品用分析天平测得藻种的鲜重。
2 结果与分析
2.1 外加氮源对葛仙米生长的影响
外加氮源对葛仙米生长的影响见表1和图1。在培养过程中每隔2 d测1次叶绿素a含量,用来研究外加氮源对葛仙米生长的影响。与对照组相比实验组外加NaNO3浓度在小于1.5 g/L时,葛仙米可以正常生长,但比对照组BG110生长较差,最大比生长率在第2天;在BG11培养基中培养4 d后出现负增长;在大于BG11即1.5 g/L NaNO3中培养时,第2天开始出现负增长,葛仙米的生长受到明显的抑制。

表1 外加氮源对葛仙米比生长速率μ的影响Table 1 The effect of additional nitrogen on the specific rate of Nostoc sphaeroids
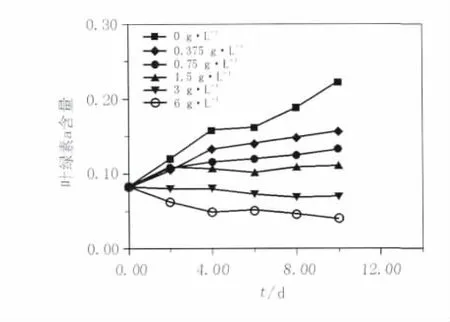
图1 外加氮源对葛仙米生长的影响Fig.1 The effect of additional nitrogen on the growth of Nostoc sphaeroids
2.2 外加氮源对葛仙米光合生理的影响
2.2.1 外加氮源对葛仙米叶绿素荧光参数Fv/Fm的影响 外加氮源对葛仙米叶绿素荧光参数Fv/Fm的影响见图2。与对照组相比,在不高于BG11(即浓度为1.5 g/L)氮浓度的培养下,荧光参数Fv/Fm的变化趋势与对照组的变化趋势相似,在前6 d中明显下降且在第6天达到最低值,但之后又有回升,呈上升趋势,而在BG11培养基的培养下荧光参数Fv/Fm的值一直比低于BG11培养基及对照组的值要高。而在高于BG11氮浓度培养基的培养下,荧光参数Fv/Fm的变化趋势不大,随时间延长有逐渐下降的趋势。另外,从图2中还可以看出,在培养的时间内,在高于1.5 g/L的氮浓度培养下,Fv/Fm的值明显比其他低氮实验组及对照组高。
2.2.2 外加氮源对葛仙米叶绿素荧光参数ØPSⅡ的影响 外加氮源对葛仙米叶绿素荧光参数ØPSⅡ的影响见图3。与BG110无氮培养基的对照组相比,在BG11培养基以及低于BG11氮浓度的较低氮源的培养下,其荧光参数ØPSⅡ的变化趋势与对照组的变化趋势大致相似,开始都有很明显下降的趋势并在第6天达到最低值,之后又有逐渐上升的趋势;而在BG11培养基的培养下荧光参数ØPSⅡ的值一直比低于BG11培养基及对照组的值要高。在高于BG11氮浓度培养基的培养下,荧光参数ØPSⅡ开始有下降的趋势后又有升高的趋势,并在第4天达到最大值。另外,从图3中还可以看出,在高于1.5 g/L的氮浓度培养下,ØPSⅡ的值明显比其他低氮实验组及对照组高。

图2 外加氮源对葛仙米叶绿素荧光参数Fv/Fm的影响Fig.2 The effect of additional nitrogen on fluorescence parameters Fv/Fm of chlorophyll of Nostoc sphaeroids
2.2.3 外加氮源对葛仙米叶绿素荧光参数ETR的影响 外加氮源对葛仙米叶绿素荧光参数ETR的影响见图4。与 BG110对照组相比,在BG11培养基以及低于BG11氮浓度的较低氮源的培养下,其荧光参数ETR的变化趋势与对照组的变化趋势大致相似,开始都有很明显下降的趋势并在第6天达到最低值,之后又有逐渐上升的趋势;而在BG11培养基的培养下荧光参数ETR的值一直比低于BG11培养基及对照组的值要高。在高于BG11氮浓度培养基的培养下,荧光参数ETR开始有下降的趋势后又有升高的趋势,并在第8天达到最大值,之后又有下降的趋势。另外,从图4中还可以看出,在高于1.5 g/L的氮浓度培养下,ETR的值明显比其他低氮实验组及对照组高。
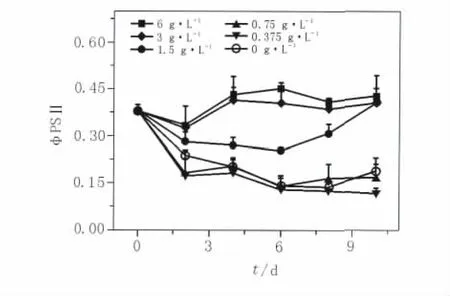
图3 外加氮源对葛仙米叶绿素荧光参数ØPSⅡ的影响Fig.3 The effect of additional nitrogen on fluorescence parameters ØPSⅡ of chlorophyll of Nostoc sphaeroids

图4 外加氮源对葛仙米叶绿素荧光参数ETR的影响Fig.4 The effect of additional nitrogen on fluorescence parameters ETR of chlorophyll of Nostoc sphaeroids
3 讨论
葛仙米具有较高的食用价值和药用价值,因此,优化葛仙米的培养就具有很大的现实意义。氮是影响藻类生长的一个重要因素,由于葛仙米异型胞内具有固氮酶,目前,葛仙米培养一般使用不含氮的BG110培养基培养,氮源是植物生长必须的营养素,而葛仙米尽管具有固氮作用,但是通过研究外加氮源对葛仙米生长及生理的影响,探讨葛仙米的生长是否需要氮源具有一定的理论和应用价值。
与对照组相比实验组外加NaNO3浓度在小于1.5 g/L时,葛仙米可以正常生长,但比对照组BG110生长较差;在BG11培养基中培养4 d后出现负增长;在浓度大于BG11中培养时,葛仙米的生长受到明显的抑制。一方面由于葛仙米异性胞的存在使得葛仙米生长的培养液中无需添加氮源,但在本实验中添加高浓度的氮源反而抑制了其藻殖段的分裂;另一方面,氮磷的浓度比对藻体的生长会有很大的影响,氮单方面浓度的增加或许会破坏氮磷间的平衡,从而抑制了葛仙米的生长,同时,在有氮情况下,其他微生物更易繁殖,灭菌工作需更加严格,一些滋生的微生物会与葛仙米形成竞争,消耗培养基中的养分,影响葛仙米的生长。最后,提供的氮源—NaNO3也许不是最适合葛仙米,从目前实验结果可以看出无氮环境是最适合葛仙米生长的环境。
植物叶绿素荧光动力学是近年来在光合作用机理研究中发展起来的一种新型、快速、简便、精确且整体无损伤并用来检测植物光合作用生理状况的新技术[21]。活体状态下,叶绿素荧光几乎全部来源于PSⅡ的Chla,活体叶绿素荧光提供的快速信息反映了PSⅡ对激发能的利用和耗散情况,而与光合作用过程的各个步骤密切偶联,因此任何一步变化都会影响到PSⅡ,从而引起荧光变化,也就是说通过叶绿素荧光几乎可以探测所有光合作用过程的变化。
本实验选择了3个有代表性的叶绿素荧光参数来反映光合作用过程的变化。Fv/Fm:PSⅡ的最大量子产量,它反映了植物的潜在最大光合能力,也反映PSⅡ反应中心最大光能转换效率;ØPSⅡ:PSⅡ实际电子传递的量子效率,不仅与碳同化有关,也与光呼吸及依赖氧气的电子流有关;ETR:光合电子传递效率,反映了体内的总光合电子传递能力。
本实验过程中所测得的3个叶绿素荧光参数(Fv/Fm、ØPSⅡ和ETR),在BG11培养基以及低于BG11氮浓度的培养基中培养时,都有下降的趋势,而BG110无氮培养基即对照组荧光参数值虽然低于BG11培养基但高于另外2个较低氮浓度培养基的值。而在高于BG11氮浓度的培养基中,上述3个荧光参数几乎没有下降的趋势,这表明在这段时间里葛仙米的固氮能力还很弱,必需利用外加氮源来进行光合作用。另一方面,在接种6~8 d之后较低氮浓度的培养基中葛仙米叶绿素荧光参数都有不同程度升高的趋势,而高于BG11氮浓度的培养基中叶绿素荧光参数有下降的趋势,说明在培养一段时间后葛仙米具有了固氮能力,不再需要外加的氮源,反而外加的氮源会抑制光合生理的过程,这可能是因为有氮的环境使其他杂菌侵入影响了葛仙米的光合作用过程。再者,在高于1.5 g/L的氮浓度培养下,所测3个叶绿素荧光参数值明显比低于BG11两个浓度组及对照组高,说明在高氮浓度下,葛仙米光合作用强。从目前的实验结果可以看出,BG11培养基所含的氮浓度最适合葛仙米的光合生理过程。
综上所述,无氮的BG110培养基最适合葛仙米的生长,而含氮1.5 g/L的BG11培养基葛仙米的光合生理能力最佳。另外无氮的BG110培养基虽然不含氮源,但其叶绿素荧光参数比另外2个较低氮浓度的实验组的荧光参数的值要高,这可能是因为在BG110培养基中葛仙米的长势最佳,而使得其光合生理的能力较强。
[1]魏印心.中国淡水藻类[M].上海:上海科技出版社,1980:49-57.
[2]邓中洋,阎春兰,胡强,等.葛仙米研究进展[J].水生生物学报,2008,32(3):393-399.
[3]陈超,汪兴平,张家年.葛仙米的保护和利用[J].特种经济动植物,2003,(5):15-16.
[4]Gao K,Ai H.Relationship of growth and photosynthesis with colonysize in an edible cyanobacterium,Ge-Xian-Mi Nostoc(cyanophyceae)[J].Journal of Phycology,2004,40(3):523-526.
[5]Qiu B S,Liu J Y,Liu ZL,et al.Distribution and ecology of the edible cyanobacterium Ge-Xian-Mi(Nostoc)in rice fields of Hefeng County in China[J].Journal of Apply Phycology,2002,14(5):423-429.
[6]毕永红,胡征宇.葛仙米的营养价值及开发利用[J].中国野生植物资源,2004,23(1):40-42.
[7]谭学儒.葛仙米[J].中国土特产,2000,(3):30.
[8]夏建荣,高坤山.球形念珠藻的生化组分分析[J].武汉植物学研究,2002,20(3):223-224.
[9]李敦海.拟球状念珠藻(葛仙米)形态建成与发育及其生理学研究[D].理学博士论文,中国科学院水生生物研究所,武汉,2000.
[10]沈银武,黎尚豪.固氮蓝藻培养和应用的结果和展望[J].水生生物学报,1993,17(4):357-364.
[11]胡文海,肖宜安.井冈山野生蔬菜资源调查[J].吉安师专学报(自然科学版),1998,19(6):60-64.
[12]郑艳,巩劼,郭新弧,等.安徽九华山药用资源及评价体系初探[J].西北植物学报,2004,24(1):75-82.
[13]孙达峰,张卫明,史劲松,等.安徽潜山野生植物资源调查研究及开发利用[J].中国野生植物资源,2005,24(2):14-17.
[14]赵遵田,樊守金.山东野生蔬菜资源调查研究[J].山东科学,1997,10(2):29-34.
[15]张德山.烟台市近郊野生蔬菜资源初报[J].烟台师范学院学报(自然科学版),1997,13(3):213-216.
[16]王宝山.植物生理学[M].北京:科学出版社,2003.
[17]Krause G H ,Weis F.Chlorophyll fluorescence and photosynthesis:The basics[J].Ann Rev Plant Physiol Plant Mol Biol,1991,(42):313-349.
[18]《全国中草药汇编》编写组.全国中草药汇编[M].北京:人民卫生出版社,1983.
[19]程超,莫开菊,汪兴平.葛仙米生长及繁殖条件的探讨[J].湖北民族学院学报(自然科学版),2003,21(4):14-17.
[20]史庆华,朱祝军,应泉盛,等.不同光强下高锰对黄光光合作用特性的影响[J].应用生态学报,2005,16(6):1047-1050.
[21]刘家尧,衣艳君,张承德,等.活体叶绿素荧光诱导动力学及其在植物抗盐生理研究中的应用[J].曲阜师范大学学报,1997,23(4):80-83.