死谷芽胞杆菌B10发酵条件的研究与抗菌谱的测定
王 萍,李 莉,李 扬,桓明辉,张 鹏
(1.沈阳农业大学土地与环境学院,辽宁 沈阳 110161;2.辽宁省微生物科学研究院,辽宁 朝阳 122000)
随着社会的迅猛发展,生物农药因其符合环境保护、人类健康和食品安全的需要,已成为当前化学杀菌剂的理想替代品,而获得高效拮抗菌是生物防治的基础,是实现全球提出的农业可持续发展的重要发展目标[1]。本研究所用死谷芽胞杆菌B10对多种食用菌病原菌如哈茨木霉(T.harzianum)、康氏木霉(T.koningii)、尖孢镰刀菌(F.oxysporum)、绿色木霉(Trichodermaviride)等都有明显抑制作用,具有很好的应用前景。本试验通过摇瓶发酵,对该菌产生的拮抗物质培养基及其发酵条件进行优化筛选,得出其最适培养基和发酵条件,为进一步的生产工艺研究奠定基础。对该菌的抑菌谱进行了测试,证明其对多种食用菌病原真菌具有一定的抑制作用。
1 材料与方法
1.1 材料
1.1.1 供试菌种 拮抗菌死谷芽胞杆菌(B.vallismortis)B10由辽宁省微生物菌种选育重点实验室分离保存。食用菌病原菌:木霉29(保藏中心编号3.3029)、棘孢木霉 30(Trichoderma asperellum)、康氏木霉(T.koningii)、深绿木霉 52(T.atroviride)、哈茨木霉 T22(T.harzianum)、哈茨木霉T2(T.harzianum)、长枝木霉(T.longibrachiatum)、绿色木霉(Trichodermaviride)、粗糙脉胞霉(Neurosporacrassa)、尖孢镰刀菌(F.oxysporum)均由辽宁省微生物菌种保藏中心提供。
1.1.2 培养基 PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂 18 ~20 g,水 1000 mL,pH 自然;种子培养基:蛋白胨 10.0 g,NaCl 10.0 g,葡萄糖10.0 g,水 1000 mL,pH 7.0;斜面培养基:胰蛋白胨10.0 g,酵母浸膏10.0 g,NaCl 5.0 g,琼脂17.0~20.0 g,水 1000 mL,pH 7.0;发酵培养基:①ATCC 液体培养基:酵母膏 5.0 g,蛋白胨1.0 g,KH2PO41.0 g,NaCl 1.0 g,水950 mL,pH 6.8,121℃灭菌30 min后补加50 mL 10%葡萄糖(葡萄糖单独用0.22 μm无菌滤器灭菌);②YPD液体培养基:酵母提取物 10.0 g,胰蛋白胨 20.0 g,葡萄糖 20.0 g,水 1000 mL,pH 7.0;③TYG 液体培养基:胰蛋白胨 3.0 g,酵母膏 3.0 g,葡萄糖 3.0 g,K2HPO41.0 g,水 1000 mL,pH 7.2;④BPY 液体培养基:牛肉膏 5.0 g,蛋白胨10.0 g,NaCl 5.0 g,酵母膏5.0 g,水 950 mL,pH 7.0,121 ℃灭菌 30 min后补加50 mL 10%葡萄糖(葡萄糖单独用0.22 μm无菌滤器灭菌);⑤NB液体培养基:牛肉浸膏 5.0 g,蛋白胨 10.0 g,NaCl 5.0 g,葡萄糖20.0 g,水 1000 mL,pH 7.0 ~7.2;⑥LB 液体培养基:胰蛋白胨 10.0 g,酵母膏 5.0 g,NaCl 10.0 g,水 1000 mL,pH 7.2。
1.2 方法
1.2.1 最佳培养基的选择 拮抗菌B10菌株最适液体培养基 ATCC、YPD、TYG、BPY、NB、LB 中筛选。pH 7.0,30 ℃,170 r/min,振荡培养 36 h,测定抑菌圈直径,确定菌株最佳培养基,每组试验3次重复。
1.2.2 无菌发酵液的制备 用无菌接种环挑取B10菌种一环,接种到含有50 mL种子培养基的100 mL三角瓶中,在30℃、170 r/min的恒温摇床中振荡培养18 h,按4%接种量接种到100 mL/250 mL的NB液体培养基三角瓶中,30℃,170 r/min的摇床中振荡培养36 h,8000 r/min离心20 min,上清液用0.22 μm微孔滤膜过滤,即为无菌发酵液[2]。
1.2.3 抑菌活性的测定[3]采用牛津杯扩散法。将指示菌木霉29菌悬液加入40~50℃ PDA固体培养基中倒平板,待冷却后,在PDA平板上同一直线相距3 cm处移入2个直径为4 mm灭过菌的牛津杯,向牛津杯中加入150 μL B10发酵无菌滤液,对照牛津杯中加入无菌水,28℃培养3~5 d,观察抑菌状况和测量抑菌圈直径。
1.2.4 生长曲线的测定 取1 mL培养好的种子液接种于装有100 mL优化培养基的250 mL三角瓶中,采用摇瓶发酵培养条件振荡培养48 h,自接种后每3 h取样1次测定菌液的OD600,用未接种培养基作为空白对照,重复3次[4]。
1.2.5 培养条件的优化 以最佳培养基和筛选培养基的培养条件为基础,通过分别改变培养基的初始 pH(5.0、6.0、7.0、8.0、9.0、10.0),接种量2%、4%、6%、8%和10%(体积比)、装液量(250 mL 三角瓶每瓶装50、75、100、125、150、175 mL)、培养温度(25、30、32、35、37、40、45、50 ℃)、培养时间(12、24、36、48、60、72 h)和摇床转速(130、150,170,190,210 r/min),按 1.2.3 方法以抑菌圈直径为指标,每组试验重复3次,确定B10菌株最佳培养条件。
1.2.6 抗菌谱测定[5]在无菌条件下将融化的PDA培养基倒入灭好菌的平皿内,冷却后,在PDA平板上呈对角线移4个直径为4 mm灭过菌的牛津杯,在平板中央接种4 mm病原菌菌饼,向牛津杯中加入150 μL B10发酵无菌滤液,28℃培养箱中培养3~5 d,观察抑菌情况和测量抑菌圈直径。
2 结果与分析
2.1 B10菌株的生长曲线
如图1所示,菌体在0~6 h的时间区间为菌种的生长延迟期,在这段时间,菌体得到复苏和分散;9~18 h进入对数生长期,菌体数量急剧增多;18~36 h菌体进入生长的相对稳定期,生长相对缓慢;从40 h以后,死谷芽胞杆菌进入生长的衰亡期,活菌数减少。因此,菌株种龄为18 h,发酵周期为36 h。
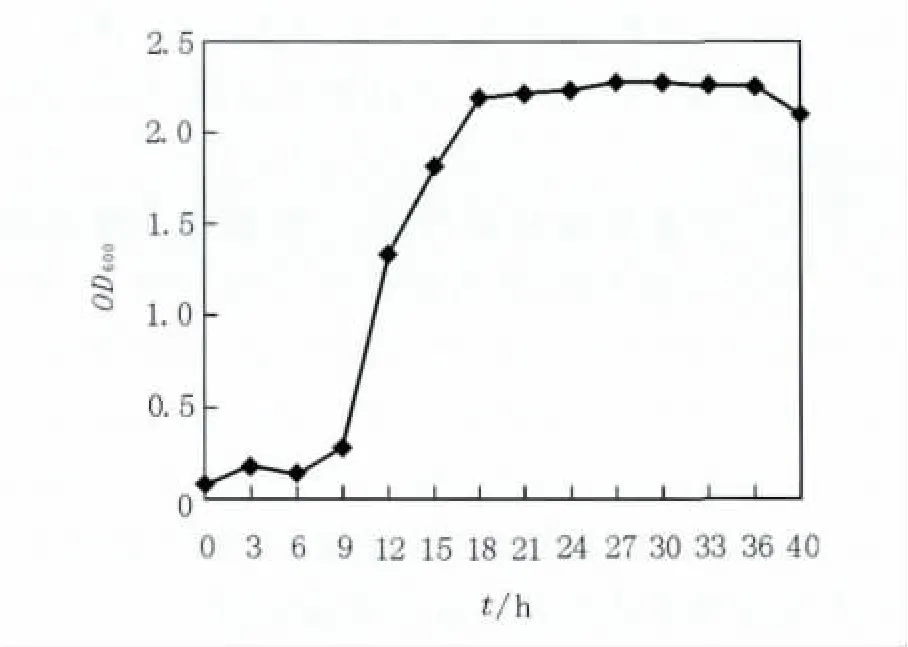
图1 B10菌株的生长曲线Fig.1 Growth cure of B10
2.2 最佳培养基的选择
培养基是人们提供微生物生长繁殖及生物合成各种代谢产物所需要的按一定比例配制的多种营养物质的混合物[6]。图2结果表明,不同培养基成分发酵培养对抑菌活性物质的产生影响很大。NB液体培养基培养的B10发酵液对指示菌的抑菌直径达到19.1 mm,说明NB培养基更适合B10抗菌物质的产生与分泌。
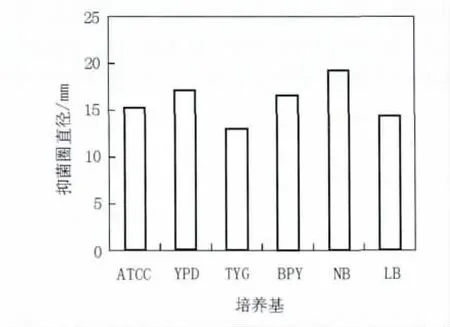
图2 不同培养基对B10菌株发酵液拮抗活性的影响Fig.2 Effect of medium on antagonistic activity of fermentatiaon broth
2.3 培养条件的优化
2.3.1 初始pH值 由于摇瓶发酵过程中pH难以控制,因此只能控制发酵液的初始pH值,pH值主要通过影响菌体细胞膜电荷,引起膜渗透性变化以及改变营养物质离子化程度,从而影响菌体对养分的吸收[7]。由图3可知,B10菌株发酵液随pH值增加呈先上升后下降趋势,在pH值为7时,发酵液抑菌活性最大,抑菌直径达到19.4 mm。
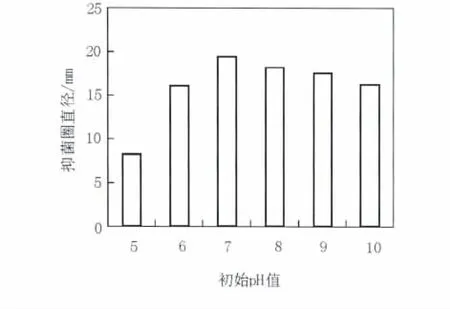
图3 不同初始pH值对B10菌株发酵液拮抗活性的影响Fig.3 Effect of initial pH on antagonistic activity of fermentatiaon broth
2.3.2 装液量 摇瓶中的通氧量直接影响菌株的生长和抑菌活性物质的产生,所以装液量是影响微生物代谢产物生成的重要因素。如图4所示,发酵液抑菌活性随装液量的增加呈先缓慢上升后快速下降趋势,装液量为100 mL/250 mL时,B10发酵液的抑菌直径最大,达到21.5 mm。
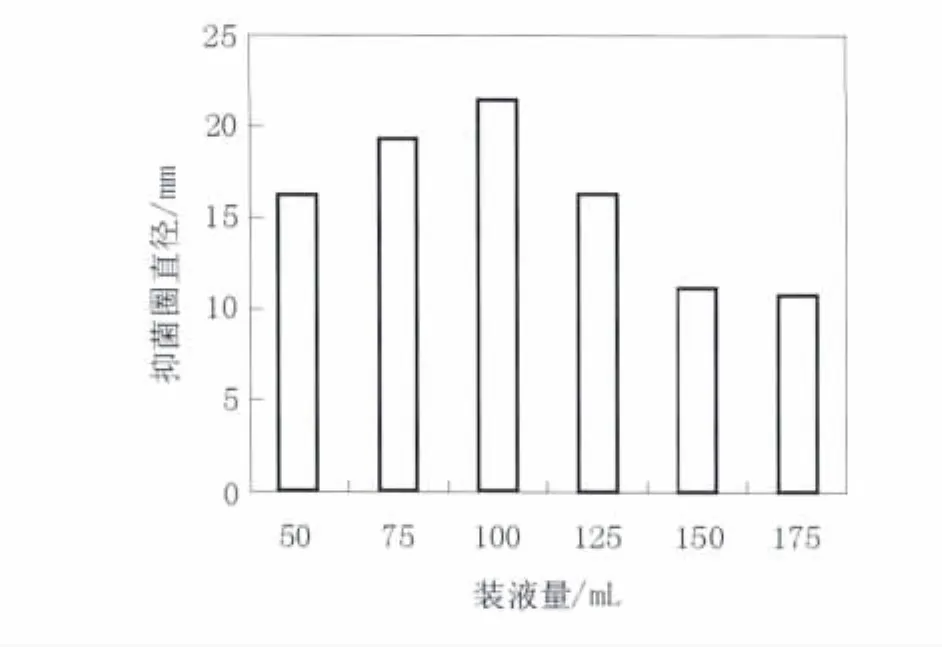
图4 不同装液量对B10菌株发酵液拮抗活性的影响Fig.4 Effect of medium volume on antagonistic activity of fermentatiaon broth
2.3.3 培养温度 温度通过酶反应速率、蛋白质的合成和活性、DNA的结构及转录等影响微生物的生命活动[8]。由图5可知,在温度为30℃时,B10菌株发酵液抑菌活性达到最强,抑菌直径为19.7 mm,适合抑菌活性物质的产生,继续提高培养温度,发酵液活性降低,所以最适温度为30℃。

图5 不同培养温度对B10菌株发酵液拮抗活性的影响Fig.5 Effect of temperature on antagonistic activity of fermentatiaon broth
2.3.4 接种量 接种量的大小,影响菌体的生长浓度,同时影响菌体对发酵液中营养物质和氧气的消耗,接种量太小延滞生长周期,而接种量太大会影响代谢产物的合成。如图6所示,接种量为4%时,发酵液抑菌活性最强,但随着接种量的增大活性不断下降,故4%为B10发酵的最佳接种量。
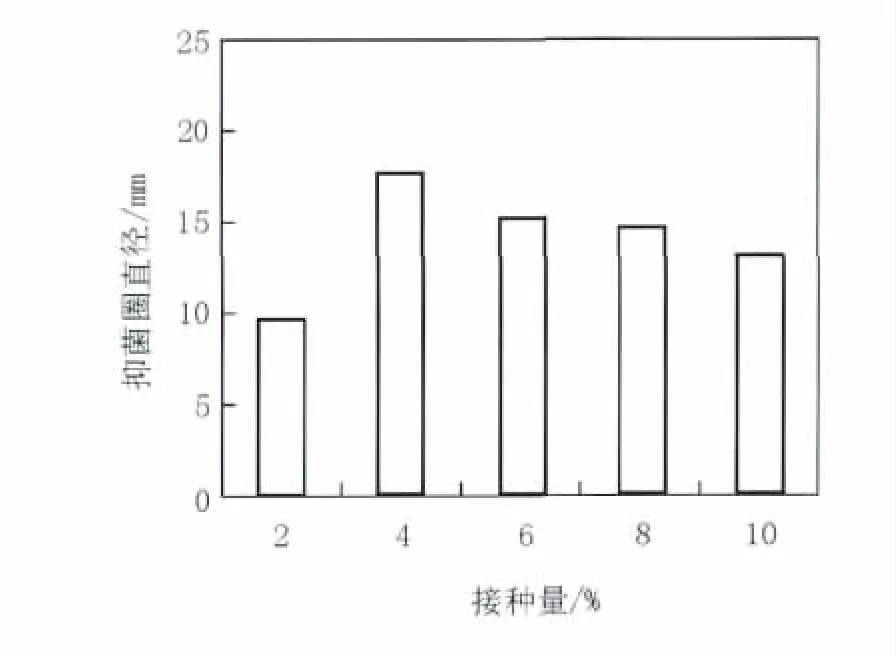
图6 不同接种量对B10菌株发酵液拮抗活性的影响Fig.6 Effect of inoculation quantity on antagonistic activity of fermentatiaon broth
2.3.5 摇瓶转速 由图7可知,随着摇瓶转速的提高,发酵液活性不断增大,但高于170 r/min后,转速提高活性下降。提高摇瓶转速,可能会引起菌体自溶,对菌体产生机械损伤[9]。所以170 r/min为B10菌株发酵的最适摇瓶转速。
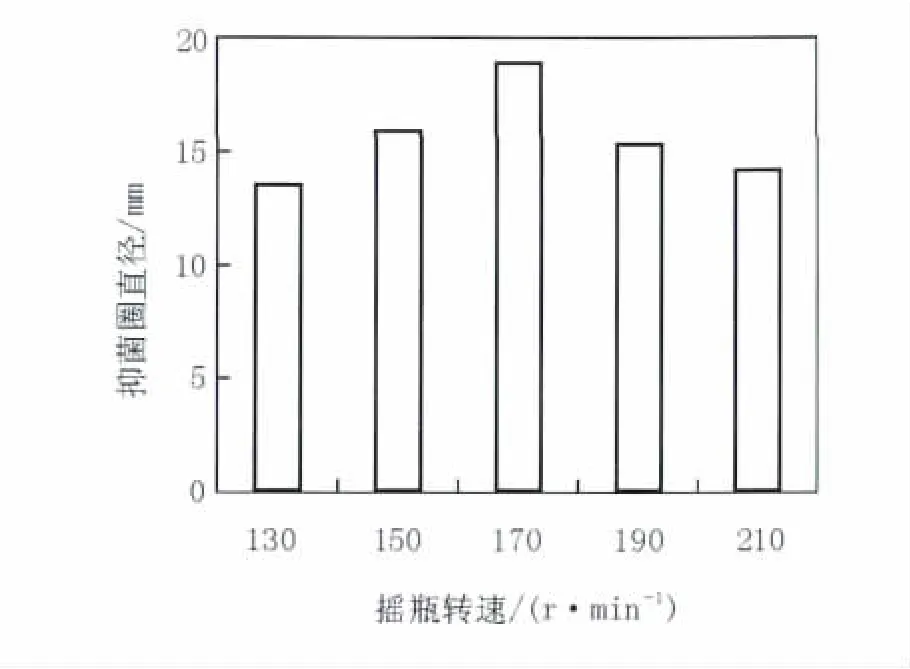
图7 不同摇瓶转速对B10菌株发酵液拮抗活性的影响Fig.7 Effect of rotation speed on antagonistic activity of fermentatiaon broth
2.4 抑菌谱测定
死谷芽胞杆菌B10发酵液具有较广的抑菌谱,对供测定的真菌病原菌抑制效果见表1及图8,对木霉病原菌的抑菌效果显著,抑菌率均达到60%以上,其中对哈茨木霉T22的抑菌率最高,达90.56%,木霉 29次之,抑菌率为 88.43%,对棘孢木霉30、深绿木霉52抑制效果较差。结果表明,死谷芽胞杆菌B10发酵液对供测定的几种食用菌病原菌真菌都具有很好的拮抗作用,说明B10发酵产物在防治食用菌病原真菌方面的潜在应用价值,具有开发生防产品潜能。
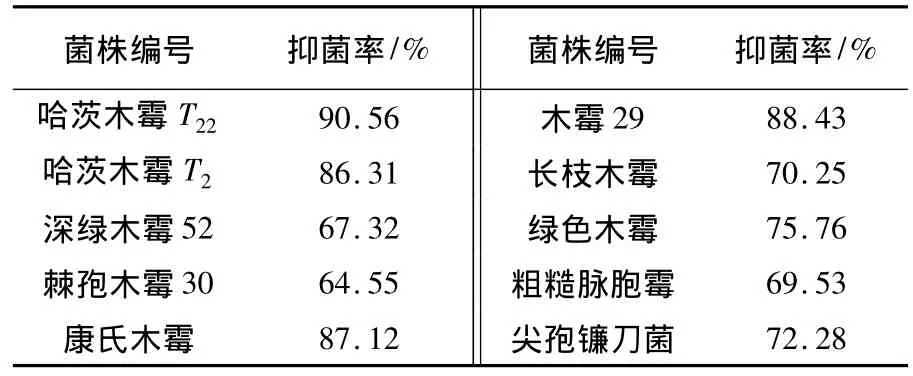
表1 死谷芽胞杆菌B10的抑菌作用Table 1 The inhibition effects of the strain of B10
3 讨论
本试验通过摇瓶发酵对死谷芽胞杆菌B10产生抑菌活性物质的培养基和培养条件进行了初步研究,温度、装液量等因素都对B10产生抑菌活性物质有明显的影响,温度过高或者过低都不利于菌株产生抑菌活性物质,在接近中性环境中最易产生拮抗物质;接种种龄为18 h,此时的种子保持有旺盛的增殖能力和较高的菌体浓度以缩短发酵周期;发酵周期为36 h,B10菌株可充分分泌产生抑菌活性物质,达到最佳抑菌效果[10]。死谷芽胞杆菌B10生长快,物理、化学性质稳定,通过分泌拮抗物质和生长竞争,在防治病原真菌方面发挥多种有益作用[11]。B10菌株对多种食用菌病原真菌有很好的抑制作用,对哈茨木霉T22的抑菌率达到90%以上,是1株很有潜力的生防菌,有着不可低估的开发潜力,具有广阔的应用前景。
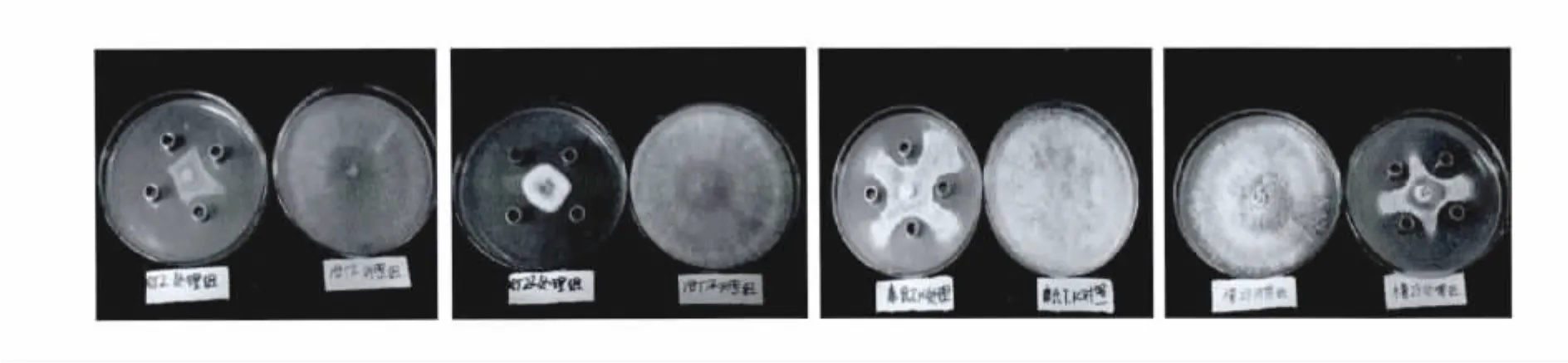
图8 B10发酵液对病原菌的抑制作用Fig.8 The inhibitory effect of B10 on pathogenic fungi
[1]Cook RJ.Making greater use of introduced microorganism for biological control of plant pathogen[J].Annual Review Phytopathology,1993,(31):53-58.
[2]张秀玉,孔凡玉,王静,等.枯草芽胞杆菌SH7抑菌蛋白产生的最佳发酵条件及温室效应[J].中国烟草科学,2010,31(2):45-48.
[3]于婷,尚玉珂,李艳芳,等.短小芽胞杆菌BSH-4抗菌物质的提取及其特性[J].《植物保护学报》,2009,36(1):65-69.
[4]王健华.枯草芽胞杆菌DPG-01发酵条件的优化[J].安徽农业科学,2007,35(26):8081-8082,8086.
[5]杨敬辉,孙庭东,朱桂梅,等.枯草芽胞杆菌K12摇瓶发酵条件的确定和抗菌谱测定[J].上海农业科技,2006,(1):27-28.
[6]张文芝,王云鹏,刘红霞,等.蜡质芽胞杆菌AR156发酵培养基及发酵条件的优化[J].微生物学通报,2010,37(6):803-810.
[7]闵钟熳,岳喜庆.动物益生芽胞杆菌菌株的筛选及发酵条件优化研究[J].食品科技,2007,24(5):62-67.
[8]翟茹环,尚玉珂,刘峰,等.枯草芽胞杆菌G8抗菌蛋白的理化性质和抑菌作用[J].植物保护报,2007,34(6):592-596.
[9]任争光,张志勇,李丹,等.芽胞杆菌BJ-6产抗菌物质发酵条件初探[J].中国农学通报,2007,23(5):321-325.
[10]Xu J,Chen SW,Yu ZN.Optimization of process parameters for poly γ-glutamate production under solid state fermentation from Bacillus subtilis CCTCC202048[J].Process Biochemistry,2005(40):3075-3081.
[11]郝捷,李莉,陈飞,等.菌株B10对食用菌木霉病的拮抗作用及菌株鉴定[J].微生物学杂志,2011,31(4):23-25.