桑黄等十种食药用菌抗氧化和延缓衰老功效的比较研究
汪雯翰,张劲松,杨 焱,严梦秋,吴 迪,吴 娜,章 慧
国家食用菌工程技术研究中心农业部应用真菌资源与利用重点开发实验室上海市农业遗传育种重点开发实验室上海市农业科学院食用菌研究所,上海 201403
食用菌是指一类可供人们食用的大型真菌,具有肉质、胶质或纤维质的子实体,我们俗称为“菇”、“蕈”、“菌”、“耳”,例如香菇、黑木耳、银耳、榆耳和双孢蘑菇等距今7000年前的河姆渡文化已有人类将食用菌作为食物的记录,而在2000多年前的《神农本草经》中则具有关于赤芝、紫芝、黑芝、白芝、茯苓和木耳等多种食用菌药效学的文字记录,其中关于灵芝的记载为“益心气、解胸中结、补中、增智慧、不忘,延年神仙等”,因而食用菌除具有口味鲜美和肉质细嫩等优点以外,还具有一定的医疗保健功能。
随着生活水平的不断提高,保健食品开发已逐渐成为食品开发的潮流和发展方向,具有良好的前景和广大的市场潜力,食用菌因具有食用性和保健性,是功能食品开发的优良原料。国内外已有大量关于食药用菌抗氧化活性的文献报道,然而此类文章主要集中于报道单一品种的抗氧化活性研究,缺乏对多种食用菌提取物同时在抗氧化和延缓衰老等多种模型上药效学的比较研究[1-3]。本实验采用清除自由基模型、细胞抗氧化和延缓衰老模型从桑黄等十种常见的食药菌醇提物中筛选出抗氧化延缓衰老活性强的品种,为后续的食用菌功能食品开发奠定基础。
1 材料与方法
1.1 材料和试剂
1.1.1 食用菌原料
桑黄(锈革孔菌科、木层孔菌属,Phellinus baumii Pliát)子实体由上海市农业科学院食用菌研究所在2010年栽培获得,菌种保存于中国微生物菌种保藏中心上海食用菌分中心,标本存放于上海市农业科学院食用菌研究所加工技术与发酵工程研究室;桦褐孔菌(锈革孔菌科、纤孔菌属,Inonotus obliquus(Pers.:Fr.)Pilát),于 2009 年购自于黑龙江哈尔滨市关东天然物产商社;灵芝(灵芝科、灵芝属 Ganoderma lingzhi Sheng H.Wu,Y.Cao & Y.C.Dai),子实体由上海市农业科学院食用菌研究所在2009年栽培获得,菌种保存于保存于中国微生物菌种保藏中心上海食用菌分中心,标本存放于上海市农业科学院食用菌研究所加工技术与发酵工程研究室;香菇(小皮伞科、微香菇属 Lentinula edodes(Berk.)Pegler);杏鲍菇(侧耳科、侧耳属,Pleurotus eryngii(DC.)Quél.);鸡腿菇(伞菌科、鬼伞属,Coprinus comatus(O.F.Müll.)Pers.);灰树花(薄孔菌科、灰树花属 Grifola frondosa(Dicks.:Fr.)Gray);猴头(猴头菌科、猴头菌属,Hericium erinaceus(Bull.:Fr.)Pers.);姬松茸(伞菌科、蘑菇属,Agaricus blazei Murrill);蛹虫草(虫草菌科、虫草菌属,Cordyceps militaris(Fr.)Link),以上子实体均于2011年购自上海百信生物科技有限公司;以上10种食药用菌均经广东省微生物研究所李泰辉研究员鉴定为各自的子实体。
1.1.2 试剂
Dulbecco's Modified Eagle Medium(DMEM)高糖培养基(#946880)、RPMI-1640(#1016442)、胎牛血清(#8172881)、马血清(#1021372)和胰酶(含0.25%EDTA)(#1128331)购自GIBCO公司;叠氮钠(Sodium azide,NaN3)(#20030401)和二甲亚砜[Dimethyl sulfoxide,DMSO(#RNBB8137)]购自 Sigma公司;链霉素(#3061B12)、青霉素(#0610S02)和3-(4,5-dimethylthiozol-2-yl)-2,5-diphenyltetrazolium bromide(MTT)(#11088866001)购自AMERSCO公司;30%H2O2(#20061130)购自国药集团。
1.1.3 仪器
DJ-10A中药粉碎机(上海隆拓仪器设备有限公司);BC-R2001型旋转蒸发仪(上海贝凯生物化工设备有限公司);Heto PL-3000冷冻干燥机(赛默飞世尔科技(中国)有限公司);Synergy HT多功能酶标仪(美国BIO2TEK公司);Delta series生物安全柜(美国LABCONCO公司)。
1.2 实验方法
1.2.1 乙醇提取物的制备
分别取干燥的十种食用菌子实体粉末30 g,依次加入10倍体积95%乙醇,25℃浸泡24 h,过滤,残渣重复上述操作一次,合并两次滤液,浓缩挥去乙醇后,冷冻干燥,即得。
1.2.2 抗氧化实验
1.2.2.1 清除超氧阴离子试验
上述乙醇提取物分别用DMSO配制成不同浓度(200、500 和2000 μg/mL)的溶液,改进郭蔼光[5]的方法测定对超氧阴离子的清除率。分别取10 μL加入96孔板(空白对照为DMSO,阳性对照为样品相同浓度的Vc溶液),由泵1泵入10 μL 6.25×10-4mol/L邻苯三酚溶液,泵2泵入150 μL鲁米诺-CBS溶液(pH 10.2),在20℃启动发光反应,每0.6 s记录一次发光值,连续记录30 s。超氧阴离子清除率按公式(1)计算:
公式(1):

1.2.2.2 清除H2O2自由基试验
乙醇提取物分别用DMSO配制成不同浓度(200、500 和 2000 μg/mL)的溶液,改进 Toshimasa Toyo’oka等[6]方法测定乙醇提取物对H2O2的清除率。分别取5 μL样品加入96孔板(空白对照为DMSO,阳性对照为样品相同浓度的Vc溶液),由泵1泵入150 μL鲁米诺-CBS溶液(pH 9.5),泵2泵入10 μL 6%H2O2,在20℃启动发光反应,每0.6 s记录一次发光值,连续记录30 s,H2O2自由基清除率按公式(1)计算。
1.2.3 细胞实验
1.2.3.1 细胞培养
PC12(肾上腺嗜铬细胞瘤细胞)于2009年在中国科学院上海生命科学研究院细胞资源中心购买。PC12细胞培养液为DMEM,内含25 mL/L胎牛血清和150 mL/L马血清,青霉素100 IU/mL,链霉素100 IU/mL;细胞培养于37℃ 5%CO2的培养箱中,细胞汇集至85%时进行传代接种,选取对数生长期细胞进行实验。
1.2.3.2 体外PC12细胞氧化损伤试验
参照胡金霞[7]实验方法,并略作改动。取对数生长期的PC12细胞,用DMEM培养基稀释至2×104个/mL。取190 μL细胞悬液接于96孔板中,然后分别加入10 μL 0.25 mmol H2O2刺激4 h。用DMEM培养基将样品稀释到不同浓度的样品溶液(2、10和40 mg/mL)将全部培养基吸出后加入199 μL新鲜培养基和1 μL不同浓度样品,每个样品重复3孔,于5%CO2和37℃细胞培养箱中培养48 h后。每孔加MTT 20 μL,继续培养4 h,离心(2000 rpm,5 min),弃上清,每孔加 DMSO 150 mL,震荡10 min,用酶标仪测570 nm的OD值,试验重复3次。
1.2.3.3 体外PC12细胞抗衰老试验
根据前期实验结果选用25 mmol/L的NaN3处理PC12 4h作为诱导细胞衰老的方式。用胰酶将对数生长期的PC12细胞消化,用DMEM培养基将细胞稀释为5×104个/mL,每孔190 μL接种于96孔板,细胞贴壁后,加入1 mol/L的NaN3处理液10 μL,处理24 h,用DMEM培养基将样品稀释到不同浓度的样品溶液(2、10和40 mg/mL,吸出培养基,每孔加入含有血清的DMEM培养液199 μL,然后加入1 μL不同浓度的样品,置于37℃、5%CO2培养48 h后,按1.2.3.2MTT试验方法检测细胞存活率。
1.2.4 数据统计
以SPSS 13.0软件包对所获得实验数据进行统计学分析,数据表示为平均数±标准差,结果差异的显著性检验通过ANOVA方差检验完成,显著性设定为*P <0.05,**P <0.01。
2 结果与分析
2.1 清除超氧阴离子试验结果
图1表明,200 mg/mL桑黄、桦褐孔菌和灵芝醇提物清除超氧阴离子的能力[96.11% ±0.30%、75.92% ±0.77%和65.60% ±6.66%(表1)]分别位于前三位,而杏鲍菇、姬松茸、灰树花和蛹虫草醇提物[42.23% ±3.06%、34.81% ±1.12%、40.16% ±2.70%和40.63% ±0.61%(表1)]的清除超氧阴离子能力较为相近,其余的食用菌(猴头,6.24% ±2.05%;香菇,14.36% ±2.34%;鸡腿菇,7.92% ±3.19%)则较弱或没有。
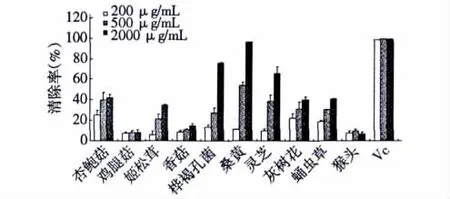
图1 十种食用菌醇提物对超氧阴离子的清除率Fig.1 Superoxide anion scavenging activities of ethanol extracts of ten edible/medicinal fungi
2.2 清除过氧化氢试验结果
图2表明,2000 μg/mL桑黄、桦褐孔菌和灵芝均具有较强的清除过氧化氢能力[99.31% ±0.03%、97.51% ±0.05%和71.01% ±0.79%(表1)],并且桑黄的清除效果最好,而鸡腿菇、灰树花和蛹虫草醇提物[53.39% ±5.05%、39.17% ±1.84%和48.61% ±2.23%(表2)]的清除过氧化氢能力较为相近,其余的食用菌(猴头,29.82% ±5.68%;香菇,32.51% ±7.80%;姬松茸,21.49% ±0.99%;杏鲍菇,21.15% ±7.26%)则较弱或没有。
2.3 体外PC12细胞氧化损伤试验结果
试验结果表明在十种食用菌中,与非细胞水平抗氧化结果相似,200 μg/mL桑黄、桦褐孔菌和灵芝的醇提物对PC12细胞损伤有良好的保护作用(0.868±0.078、0.270±0.004和0.261% ±0.013%)
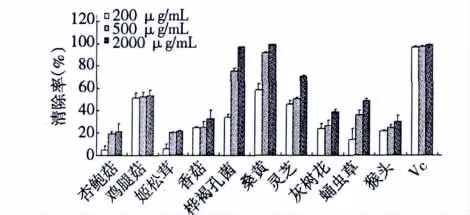
图2 十种食用菌醇提物对H2O2的清除率Fig.2 H2O2scavenging activities of ethanol extracts of ten edible/medicinal fungi

表1 十种食用菌醇提物对超氧阴离子和过氧化氢的清除率Table 1 Superoxide anion and H2O2scavenging activities of ethanol extracts of ten edible/medicinal fungi
(表2),其中桑黄的效果最好,而其它食用菌醇提物(杏鲍菇,0.198 ±0.005;鸡腿菇,0.206 ±0.017;姬松茸,0.185±0.003;香菇,0.190±0.010;灰树花,0.201±0.011;蛹虫草,0.185±0.002;猴头,0.186±0.001)无明显效果(图3)。
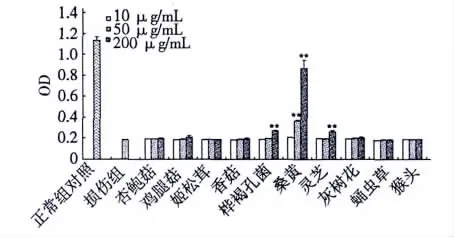
图3 十种食用菌醇提物对PC12细胞的氧化损伤保护作用Fig.3 Antioxidant activities of ethanol extracts of ten edible/medicinal fungi on PC12
2.4 体外PC12细胞抗衰老试验结果
本试验结果表明,在此模型中200 μg/mL桑黄与以上试验结果相同,具有最好的抗细胞衰老效果(1.419 ±0.070)(表2),而 200 μg/mL 桦褐孔菌和灵芝的功效较为相近(0.693±0.036和0.701±0.031)(表2),这与H2O2损伤的细胞学实验结果相似,而与非细胞水平抗氧化实验结果有所不同(图4)。

图4 十种食用菌醇提物对NaN3诱导PC12细胞衰老的修复作用Fig.4 Anti-aging activities of ethanol extracts of ten edible/medicinal fungi on PC12

表2 十种食用菌醇提物对PC12细胞氧化损伤和衰老的修复作用Table 2 Antioxidant and anti-aging activities of ethanol extracts of ten edible/medicinal fungi on PC12
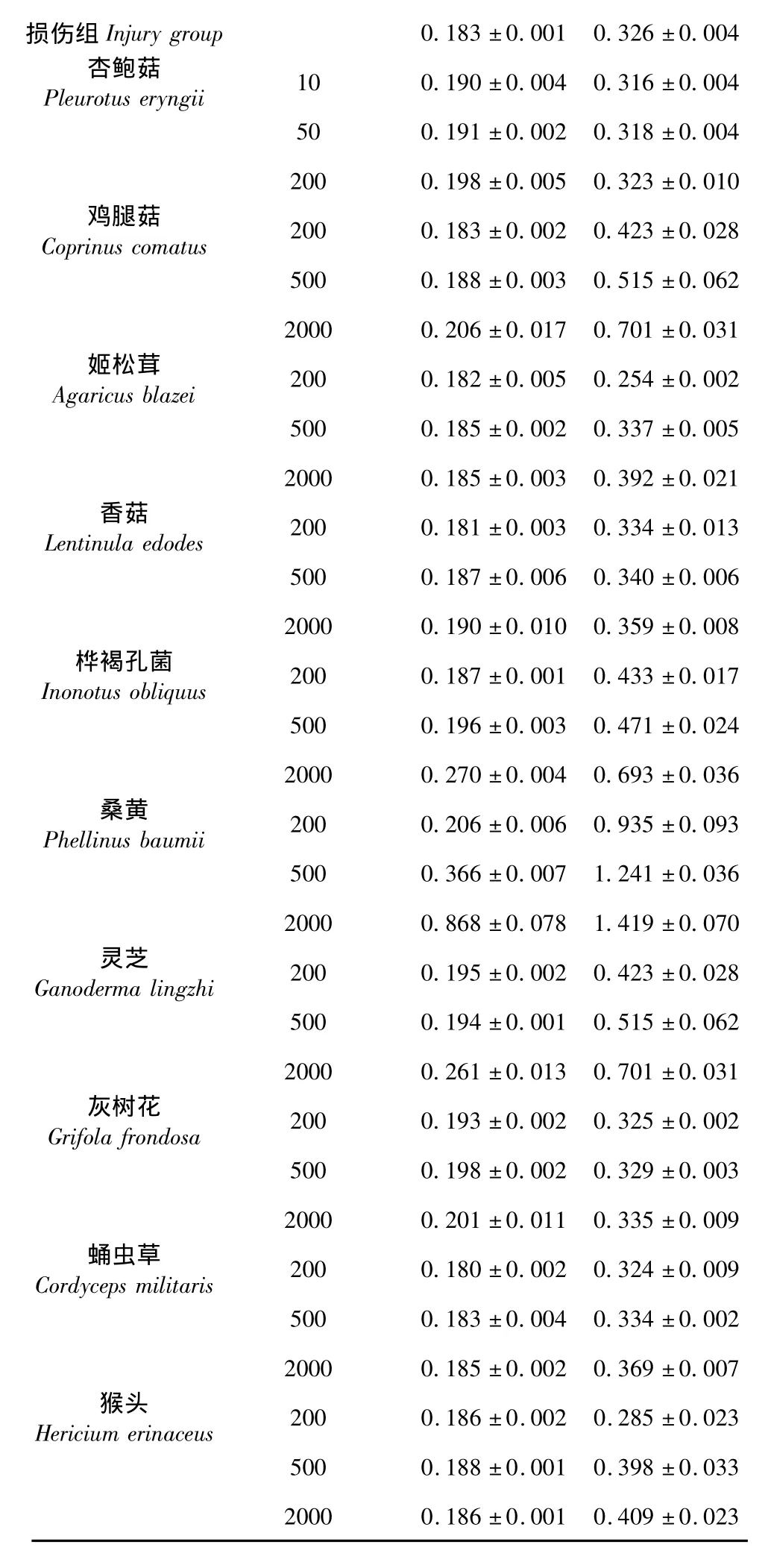
损伤组 Injury group 0.183 ±0.001 0.326 ±0.004杏鲍菇Pleurotus eryngii 10 0.190 ±0.004 0.316 ±0.004 50 0.191 ±0.002 0.318 ±0.004 200 0.198 ±0.005 0.323 ±0.010鸡腿菇Coprinus comatus 200 0.183 ±0.002 0.423 ±0.028 500 0.188 ±0.003 0.515 ±0.062 2000 0.206 ±0.017 0.701 ±0.031姬松茸Agaricus blazei 200 0.182 ±0.005 0.254 ±0.002 500 0.185 ±0.002 0.337 ±0.005 2000 0.185 ±0.003 0.392 ±0.021香菇Lentinula edodes 200 0.181 ±0.003 0.334 ±0.013 500 0.187 ±0.006 0.340 ±0.006 2000 0.190 ±0.010 0.359 ±0.008桦褐孔菌Inonotus obliquus 200 0.187 ±0.001 0.433 ±0.017 500 0.196 ±0.003 0.471 ±0.024 2000 0.270 ±0.004 0.693 ±0.036桑黄Phellinus baumii 200 0.206 ±0.006 0.935 ±0.093 500 0.366 ±0.007 1.241 ±0.036 2000 0.868 ±0.078 1.419 ±0.070灵芝Ganoderma lingzhi 200 0.195 ±0.002 0.423 ±0.028 500 0.194 ±0.001 0.515 ±0.062 2000 0.261 ±0.013 0.701 ±0.031灰树花Grifola frondosa 200 0.193 ±0.002 0.325 ±0.002 500 0.198 ±0.002 0.329 ±0.003 2000 0.201 ±0.011 0.335 ±0.009蛹虫草Cordyceps militaris 200 0.180 ±0.002 0.324 ±0.009 500 0.183 ±0.004 0.334 ±0.002 2000 0.185 ±0.002 0.369 ±0.007猴头Hericium erinaceus 200 0.186±0.002 0.285±0.023 500 0.188±0.001 0.398±0.033 2000 0.186±0.001 0.409±0.023
2.5 小结
桑黄、桦褐孔菌和灵芝三种食药用菌对超氧阴离子和过氧化氢自由基表现出良好的清除效果,并且对PC12细胞的氧化损伤具有较好的修复作用,说明这三种食药用菌在非细胞水平和细胞水平上均有良好的抗氧化能力。同时,对十种食药用菌的抗细胞衰老能力实验结果表明,这三种食药用菌的抗衰老能力明显好于其他几种食药用菌。以上研究结果提示桑黄、桦褐孔菌和灵芝具有良好的抗氧化和延缓衰老的双重功效。
3 讨论
衰老(aging,senescence)又称老化,通常是指在正常状况下生物发育成熟后,随年龄增加,自身机能减退,内环境稳定能力与应激能力下降,结构、组分逐步退行性变,趋向死亡的不可逆转的现象。近年来,随着现代遗传学、分子生物学、细胞生物学和分子免疫学等边缘学科的飞速发展,人们对衰老的机制有了深层次的认识,并在大量实验证据的基础上提出了许多新的学说,分别从不同的角度探讨了衰老发生的机制和对策。在这些衰老学说中,以自由基学说最受重视,支持这一理论的实验证据也最为丰富。机体较弱的抗氧化能力,会导致组成体内细胞受到自由基的攻击,从而引起细胞损伤,并导致机体快速衰老。利用叠氮钠诱导的PC12细胞模型可在细胞水平评价待测物质的抗衰老能力。本研究以自由基学说作为研究基础,从食用菌中寻找具有抗氧化活性的品种,并利用PC12细胞衰老模型进行验证。在本实验中,桑黄、桦褐孔菌和灵芝均表现出一定的抗氧化能力,但桑黄的效果在两项试验中均要好于后两种食用菌,并且在高浓度(2000 μg/mL)接近VC阳性对照清除效果。桑黄在抗细胞衰老试验中也表现出最好的抗衰老效果。
在前期的实验中,我们比较了桑黄水提物和醇提物在非细胞和细胞水平上抗氧化和抗衰老效果,实验结果提示,醇提物的活性明显高于水提物。进一步通过正丁醇萃取获得的萃取相其抗衰老活性得到了明显提高,这一结果表明桑黄子实体中起到抗氧化和抗衰老活性的主要是小分子化合物[8]。桑黄子实体小分子主要为黄酮及其衍生物、香豆素类、角醇类等,莫顺燕等首次从桑黄中分离得到5个黄酮和2个香豆素类化合物,分别为袖皮素、樱花亭、二氢莰非素、7-甲氧基二氢茨非素、北美圣草素、香豆素及蓖若亭,后来又分离得到个新的二氢黄酮衍生物,分别为5,7,4'-三经基邻羟苄基二氢黄酮和5,7,4'-三羟基-6-邻羟苄基二氢黄酮[9]。已有研究表明黄酮类、香豆类和角醇类化合物均具有一定的抗氧化和抗衰老效果,因而在后续的研究中需要通过分离纯化的方法从桑黄醇提物中获得单一化合物,通过药理学实验寻找有效物质,并阐明其作用机理。
目前国内市场上食用菌的功能食品主要集中于提高免疫力的多糖类保健品,除了灵芝三萜类产品以外,对食用菌小分子产品的开发基本还处于空白领域。衰老是所有人都无法避免的正常生理现象,随着人们对自身健康的不断关注,为延缓衰老功能食品的开发提供了广阔的市场前景。本研究的对象为市场上最为常见的10种食药用真菌,从中筛选出具有抗良好氧化和抗衰老功效的桑黄对功能食品开发具有一定的指导意义。
1 Fu L,Chen H,Dong P,et al.Effects of ultrasonic treatment on the physicochemical properties and DPPH radical scavenging activity of polysaccharides from mushroom Inonotus obliquus.J Food Sci,2010,75:C322-337.
2 Aydin S,Aytac E,Uzun H,et al.Effects of Ganoderma lucidum on obstructive jaundice-induced oxidative stress.Asian J Surg,2010,33:173-180.
3 Yang Y,Hu J,Liu Y,et al.Antioxidant and cytotoxic activities of ethanolic extracts and isolated fractions of species of the genus Phellinus Quél.(Aphyllophoromycetideae).Int J Med Mushrooms,2011,13:145-152.
4 Guo AG(郭蔼光),Wang ZY(王振镒).Antioxidation of pyrogallol-chemiluminescence assay for superoxide dismutase activity.J Plant Physiol(植物生理学通报),1989,3:54-57.
5 Toyo'oka T,Kashiwazaki T,Kato M.On-line screening methods for antioxidants scavenging superoxide anion radical and hydrogen peroxide by liquid chromatography with indirect chemiluminescence detection.Talanta,2003,60:467-475.
6 Hu JX(胡金霞),Yang Y(杨焱),Zhang JS(张劲松),et al.The antioxidant activity of ethanol extracts from Phellinus baumii and their protective effects against oxidative damage of nerve cell.Acta Agric Shanghai(上海农业学报),2009,25:58-61.
7 Yun C,Wu SH,Dai YC.Species clarification of the prize medicinal Ganoderma mushroom “Lingzhi”.Fungal Diversity,2012,56(1):49-62.
8 Wang WH(汪雯翰),Wang QB(王钦博),Zhang JS(张劲松),et al.Protective effects of lipophilic extracts of Phellinus baumii on PC12 aging model.Mycosystema(菌物学报),2011,30:760-766.
9 Mo SY(莫顺燕),Yang YC(杨永春),Shi JG(石建功).Studies on chemical constitutes of Phellinus igniarius.China J Chin Mater Med(中国中药杂志),2003,28:339-341.

