壳寡糖镧配合物的抑菌活性及其与牛血清白蛋白的相互作用
冯小强,李小芳,杨 声
1天水师范学院生命科学与化学学院,甘肃天水741001;2定西师范高等专科学校,甘肃定西743000
壳寡糖(简称COS)是壳聚糖通过化学法、酶法等解聚而成的低分子壳聚糖,一般由2~50个糖单元通过糖苷键连接而成,不仅水溶性大,而且具有独特的生理活性如抗菌性、抗肿瘤性、抗氧化性、降血脂性、调节免疫等。COS分子中由于氨基和羟基的存在而对过渡金属和稀土离子有着稳定的配位作用。近年来,有关COS过渡金属配合物的报道不断涌现,如与 Fe2+、Ca2+、Cu2+、Mn2+、Zn2+等离子的配位,而有关COS稀土配合物的研究却少有报道。稀土元素由于特殊的外层电子构型,具有发光[1]、抗炎、杀菌、抗癌、抗凝血、镇痛等作用[2]。任群翔等制备了COS与Pr3+、Dy3+的配合物,发现配合物对羟自由基具有明显的清除作用,与COS相比对羟自由基具有更高的抑制活性[3];中心离子 Nd3+与COS4个链节单元上的氨基N和仲羟基O结合,形成八配位的壳寡糖-钕配位聚合物[4]。本文合成了壳寡糖-La(简称COS-La)配合物,并对其结构和性质进行了表征。考察COS、COS-La对金黄色葡萄球菌、大肠杆菌抑菌活性,发现COS、COS-La对这金黄色葡萄球菌、大肠杆菌具有较强的抑菌活性,且COS-La的抑菌活性强于COS,故COS-La是一种潜在的抑菌药物。
各种药物进入血液循环后需要通过血浆的存储和运输,才能到达受体部位而发挥相应的药理作用[5]。药物在血浆中都会与血浆蛋白结合,对药物在体内的代谢和分布产生重要影响,而血清白蛋白是血浆中含量最丰富的蛋白质。因此,研究药物与血清白蛋白的作用机制,这对于了解药物在体内的运输和分布情况具有很重要的意义。本实验并采用紫外光谱、荧光光谱和循环伏安曲线法研究COS-La与牛血清白蛋白(BSA)的相互作用机理。
1 实验部分
1.1 材料与仪器
壳寡糖(分子量10000,济南海德贝海洋生物工程有限公司);LaCl3(甘肃稀土新材料股份有限公司);牛血清白蛋白(BSA)(北京奥博星生物技术责任有限公司,C=10-5mol/L的溶液);大肠杆菌ATCC 35218(E.coli)、金黄色葡萄球菌ATCC 26113(St.aureaus)由天水市中医医院化验科提供。
Spectrum One 3.0傅立叶红外光谱仪(Perkin Elmere公司);UV-2450紫外可见光谱仪(日本岛津);TG-DTA分析仪(Perkin Elmere公司);RF-5301PC荧光光谱仪(日本岛津);DSX-280B型不锈钢自动手提式压力蒸汽灭菌锅(上海申安医疗器械厂);ZDP-2120型全自动新型电热培养箱(上海智城分析仪器制造有限公司);ZHJH-2109B超净工作台。CHI-612C电化学工作站(上海辰华仪器公司);三电极体系:碳糊电极(CPE)为工作电极,饱和甘汞电极(SCE)为参比电极,铂丝电极为辅助电极。
1.2 COS-La配合物的制备
分别称取1.0 g COS、1.5 g LaCl3加入到50 mL蒸馏水中,在60℃下搅拌回流6 h,冷却至室温后,在上述混合液中倒入3倍体积的丙酮,即刻产生沉淀,沉淀陈化过夜,抽滤,用φ =0.95的乙醇反复洗涤至滤液中无氯离子存在(滴加少许硝酸银溶液,直到无白色沉淀产生即可),60℃干燥得COSLa。
1.3 抑菌实验
将固体培养基高温灭菌30 min倒平板,用无菌水分别稀释金黄色葡萄球菌、大肠杆菌制得OD610nm=0.1的菌悬液,在每个平板中加入0.1 mL菌悬液,涂平板。将浸泡在5 mg/mL COS、COS-La溶液中直径为6 mm的滤纸片贴在细菌培养基上,以1.0%HAc做空白对照组,在37℃下恒温培养24 h(E.coli)、48 h(St.aureus)。
1.4 COS-La与BSA的相互作用
在一系列试管中分别加入1.0 mL BSA溶液和一定量的浓度为5 mg/mL的COS-La溶液,以二次蒸馏水定容至5.0 mL,室温下作用12 h,200 ~600 nm范围扫描紫外吸收光谱;设定λex=280 nm,EX=EM=3 nm,扫描荧光发射光谱;电极处理后放入0.5 mol/L(pH 6.8)的Tris-HCl缓冲溶液中,加入适量的COS-La与BSA,与未加BSA的COS-La溶液比较,于电位-1.2~1.2 V下以扫速100 mV/s进行扫描,用循环伏安法对该体系进行测定。
2 结果与讨论
2.1 COS-La表征
COS、COS-La的红外光谱如图1所示。COS原位于3445 cm-1左右的-OH和-NH特征吸收峰配位后峰形变窄,说明COS中-OH和-NH可能参与配位;原位于1083 cm-1处仲羟基伸缩振动吸收峰,配位后位移至1069 cm-1;1598 cm-1的伯胺N-H面内弯曲振动强吸收峰移至1603 cm-1左右,进一步证明COS中仲羟基-OH和-NH参与配位。另外,配合物在774 cm-1处产生尖而强的吸收峰,归属为O-La吸收。因此COS中-NH2上的N原子与仲羟基上的O原子参与配位。
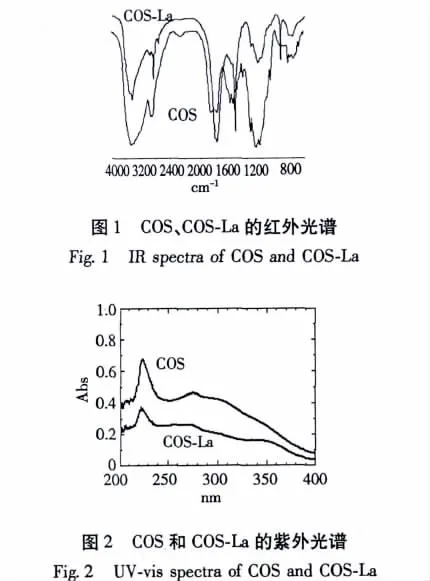
浓度为1.0 mg/mL的COS、COS-La溶液紫外光谱如图2所示。COS在223.5 nm和275.5 nm处有两个较强吸收峰,而COS-La除了在222.8 nm和274.0 nm有两个吸收峰,还在341 nm处有一弱吸收峰,这可能是COS-La中氧、氮某一元素或二种元素的孤对电子发生n-σ*跃迁,从而导致电子光谱发生变化。由此表明COS与La3+发生了配位作用。
以α-Al2O3为参比,以10℃/min速率升温至800℃,对产物进行热力学分析。COS的热分解可分为三个阶段:第一阶段分解在50℃,主要脱去水分,失重率为15.8%,在97.8℃有一强放热峰;第二阶段是在200~340℃失重率为42.9%,是COS分解、氧化、燃烧的结果,归属为糖环的脱水、聚合物单元的解聚的综合结果,在217℃有一强放热峰;第三阶段在600℃左右又出现弱放热峰,热重曲线还呈下降趋势,当温度升到800℃时,COS分解和氧化完全。而 COS-La最大失重在175~360℃,在253.3℃有一强放热峰,当温度升到800℃时,样品质量还剩45%,最终的氧化产物为三氧化二镧。热重数据表明COS-La热稳定性不如COS,是由于在多聚糖结构中-OH和-NH2参与配位,一定程度上减弱了COS分子间氢键的形成,进而此次级转变的转变温度略有降低。
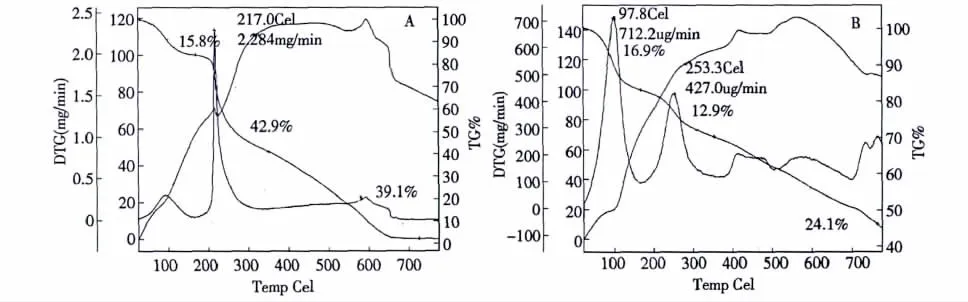
图3 COS(A)、CS-La(B)的 TG 图Fig.3 TG images of COS(A)and COS-La(B)
2.2 COS-La的抑菌活性
COS、COS-La对黄色葡萄球菌、大肠杆菌的抑菌圈如图4所示。可以看出COS、COS-La对革兰氏阴性菌大肠杆菌和革兰氏阳性菌金黄色葡萄球菌均具有抑菌效果,且COS-La抑菌效果好于COS的,说明稀土离子与壳寡糖具有协同作用,使得配合物抑菌效果增强。
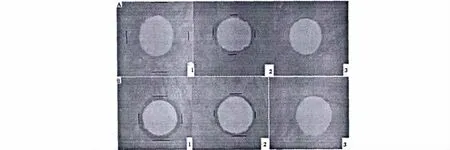
图4 COS-La(1)、COS(2)、1.0%HAc(3)对黄色葡萄球菌(A)、大肠杆菌(B)的抑菌圈Fig.4 Inhibition zone of COS-La(1),COS(2)and 1.0%HAc(3)against St.aureus(A),E.coli(B)
2.3 COS-La与BSA的相互作用
2.3.1 荧光光谱
BSA分子中色氨酸、酪氨酸和苯丙氨酸能够发荧光,其荧光光谱变化情况可直接反映分子中荧光生色团的结构和所处微环境及分布情况。图5为COS-La对BSA荧光强度的影响。在激发波长为280 nm时,BSA在339nm出现发射峰。在BSA溶液中依次加入COS-La,随着COS-La浓度的增大,BSA的荧光强度依次减弱,表明COS-La对BSA的荧光具有猝灭作用。

图5 COS-La对BSA荧光强度的影响(CBSA=2×10-6 mol/L)Fig.5 Fluorescence spectra of BSA with various concentrations of COS-La
荧光猝灭过程分为动态猝灭和静态猝灭。通过采用Stern-Volmer方程来分析BCS-Eu对BSA的荧光猝灭过程类型。
Stern-Volmer方程:

其中,F0为未加入猝灭剂时的荧光强度;F为加入猝灭剂后的荧光强度;Kq(L/mol·s)为双分子猝灭过程的速率常数,Kqгo=KSV(L/mol)称为Stern-Volmer猝灭常数:[Q]为猝灭剂的浓度;гo为没有猝灭剂存在时荧光分子的平均寿命,生物大分子的平均寿命约为10-8s。根据(1)式,以F0/F-1对COS-La浓度[Q]作图,得Stern-Volmer猝灭曲线,如图6a所示,满足方程Y=-0.05+0.55x。通常各类猝灭剂对生物大分子的最大动态猝灭常数为2.0×1010L/mol·s[6],由(1)式求得 Stern-Volmer猝灭常数 KSV=0.55 × 1012L/mol·s(R=0.9990),大于最大动态猝灭常数,表明COS-La配合物对BSA的荧光猝灭效应是二者形成复合物的静态猝灭。
静态猝灭作用荧光强度与猝灭剂的关系采用Regression equation方程:
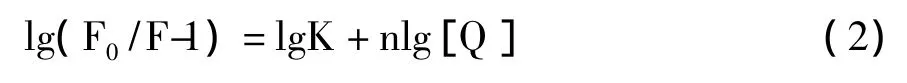
其中,F0为未加入猝灭剂时的荧光强度;F为加入猝灭剂后的荧光强度;K为猝灭剂与BSA分子的结合常数;n为结合位点数。lg(F0/F-1)与nlg[Q]的关系(如图6b),满足线性方程Y=4.80+1.29x(R=0.9976),所以COS-La与BSA分子的结合常数K=6.35×104L/mol,结合位点数n=1.29。表明COS-La与BSA之间有较强结合作用,可以被蛋白质运输和储存。
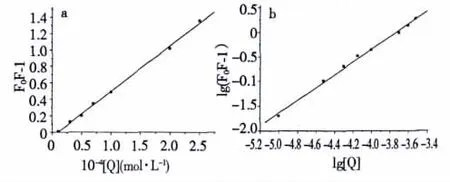
图6 COS-La与BSA作用的Stern-Volmer图Fig.6 Stern-Volmer plots of the interaction of COS-La and BSA
2.3.2 紫外光谱
动态猝灭只影响荧光分子的激发态,并不改变荧光物质的吸收光谱;在静态猝灭中,由于猝灭剂与猝灭物质的基态分子发生相互作用,形成基态配合物,从而引起紫外吸收光谱的变化[7]。COS-La对BSA紫外光谱的影响如图7所示。BSA在280 nm附近吸收峰是其肽链上的色氨酸和酪氨酸的苯杂环π-π*跃迁引起的,在BSA溶液中依次加入COS-La后,吸收强度随COS-La浓度的增加而增强,说明COS-La能使包围在BSA分子内部的色氨酸和酪氨酸残基的芳杂环疏水基团裸露出来,使吸收强度增强,同时疏水基团之间的疏水作用减弱,π-π*跃迁能量增大,使吸收峰稍有蓝移,表明COS-La与BSA混合后生成了一种复合物。紫外光谱结果进一步表明了COS-La与BSA之间的猝灭机制属于静态猝灭。
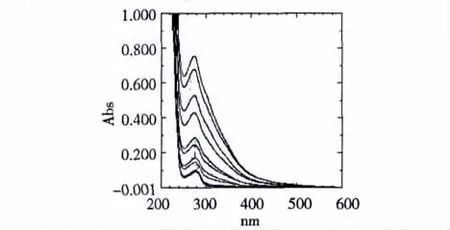
图7 COS-La对BSA紫外光谱的影响Fig.7 Effect of COS-La on the UV spectra of BSA
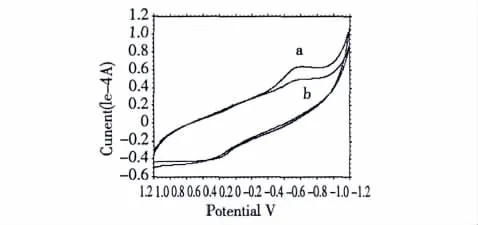
图8 COS-La与BSA体系的循环伏安图(a COS-La;b COS-La-BSA)Fig.8 Cyclic voltammograms of COS-La-BSA system
2.3.3 电化学
通过循环伏安曲线法考察BSA与COS-La相互作用的电化学行为(见图8)。可看出,COS-La在-0.6 V附近有一个明显的峰,当体系中引入BSA后,在电位扫描范围内未出现新峰,峰电流降低,推测COS-La与BSA作用形成了一种非电活性的超分子化合物,使得COS-La的电化学活性基团隐藏于BSA 内部,导致 COS-La所处环境发生了变化[6,8]。综合上述分析,进一步表明COS-La对BSA的荧光猝灭不是由于分子间动态碰撞所引起,而是因为形成复合物所产生的静态猝灭。
3 结论
COS中-NH2上的N原子与仲羟基上的O原子都与La3+发生了配位,COS-La热稳定性不如COS;COS、COS-La对金黄色葡萄球菌和大肠杆菌均具有较强的抑菌活性,且COS-La的抑菌活性强于COS;COS-La与BSA形成了一种非电活性的超分子化合物,从而猝灭BSA内源荧光,该猝灭机制为静态猝灭,室温下配合物与BSA的结合常数和结合位点数分别为6.35×104L/mol和1.29。
1 Cui HX(崔海霞),Chen JM(陈建敏),Zhou HD(周惠娣).Synthesis and fluorescence properties of rare earth complexes with a new diamide ligand.Chin J Lumin(发光学报),2009,30:457-462.
2 He QZ(何其庄),Yang XF(杨小飞),Qian XP(钱秀萍),et al.Synthesis,characterization and fungistatic effect of ternary complexes rare earths with m-aminobenzoic acid and 8-hydroxyquinoline.J Chin Rare Earth Soc(中国稀土学报),2002,20(20):1-5.
3 Ren QX(任群翔),Zhai YC(翟玉春),Bai YH(白玉红),et al.Synthesis,coordination mechanism and anti-hydroxyl free radical activity of coordination compounds of chitooligosaccharide with PrCl3and DyCl3.Chin Rare Earths(稀土),2009,30(3):57-61.
4 Ren QX(任群翔),Zhai YC(翟玉春),Bai YH(白玉红),et al.Synthesis and coordination mechanism of the coordination compound of chitooligosaccharide with Nd(NO)3.J Mole Sci(分子科学学报),2008,24:316-319.
5 Sugio S,Kashima A,Mochizuki S,et al.Crystai structure of human serum albumin at 2.5 nm resolution.Protein Eng,1999,12:439-446.
6 Jia T(贾涛),Wang K(王凯),Bao XP(鲍小平),et al.Synthesis of metal porphyrins bonded with salicylic acid and their interaction with bovine serum albumin.Chem Res Chin Univ(高等学校化学学报),2004,25:1604-1607.
7 Huang B(黄波),Zou GL(邹国林),Yang TM(杨天鸣).Studies on the interaction between adriamycin and bovine serum albumin.Acta Chim Sin(化学学报),2002,60:1867-1871.
8 Wu CH(邬春华),Lv YQ(吕元琦),Yuan ZB(袁倬斌).Electrochemical studies of the interaction between rhein and BSA.J Instru Anal(分析测试学报),2004,23(3):73-75.

