灵芝酸T提高多药耐药性肿瘤细胞对阿霉素敏感性的初步研究
唐 文
上海应用技术学院香料香精技术与工程学院食品科学系,上海 201418
灵芝是一种珍贵的药用真菌,具有广泛的药理作用,如抗肿瘤、抗HIV病毒、免疫调节等。灵芝酸是灵芝中主要的三萜类生物活性成分,自Toth等[1]首先报道了灵芝三萜类化合物的抗癌活性以来,已对其进行了较深入的研究。前期研究表明:多种灵芝酸能抑制肿瘤细胞的增殖和转移,限制细胞周期,诱导多种肿瘤细胞凋亡[2],并提出了灵芝酸诱导凋亡的途径是与p53蛋白相关的依赖于线粒体的内源性凋亡途径[3]。
肿瘤细胞对化疗药物的耐药性是导致癌症治疗无效的常见原因之一。一般认为,肿瘤细胞产生多药耐药性有两方面原因[4]:一是干扰了肿瘤细胞的凋亡过程;二是细胞表面载体使抗癌药物被排斥或排出细胞,使细胞内药物积累量减少。在多药耐药性研究中,主要介导药物转运的蛋白是P-糖蛋白(P-gp),多药耐药性相关蛋白(MRP)、抗原处理相关转运蛋白(TAP)等。有研究表明一些来源于植物的三萜类物质具有逆转癌细胞的多药耐药性作用,如红参中的人参皂甙Rg3[5]。但关于灵芝酸逆转肿瘤细胞多药耐药性的研究还未见报道。
本研究目的是初步研究灵芝三萜类(灵芝酸T)增加多药耐药性KB-A-1/Dox细胞对阿霉素敏感性的效果及其可能的作用机理,从而为灵芝酸作为辅助肿瘤化疗的保健品研究或逆转多药耐药性药物的先导化合物研究提供理论依据。
1 实验部分
1.1 材料和仪器
细胞株:KB-A-1和KB-A-1/Dox是人口腔表皮癌耐药细胞,由华东理工大学药学院刘建文教授实验室提供。灵芝酸T(纯度>99%)为本实验室从发酵培养灵芝干燥菌丝体中经制备色谱分离提取获得,经核磁谱图与标准品比对鉴定。噻唑蓝[3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl tetrazolium bromide,MTT],RPMI 1640 培养基、小牛血清,碘化丙啶(PI)购于华美生物技术有限公司。阿霉素(Dox),Rhodamin123购于 Sigma公司。酶标仪(Bio-Rad,USA);CO2培养箱(Heraeus,USA);荧光分光光度计(Shimadzu,Japan);流式细胞仪(BD Bioscience,USA);液相色谱及荧光检测器(Shimadzu,Japan)。
1.2 细胞培养
KB-A-1和KB-A-1/Dox细胞置5%CO2培养箱,37°C培养。培养基为EMEM高糖培养基,添加12%的小牛血清。KB-A-1/Dox细胞需要在培养基中添加阿霉素(Dox)维持耐药性,阿霉素浓度为0.75 μM。
1.3 肿瘤细胞多药耐药性的诱导和维持
方法[6],接种对数生长期的 KB-A-1细胞,培养基中加入0.1 μM的阿霉素诱导5代,以后逐渐增加阿霉素的添加量。至90 d后,KB-A-1细胞可以在含0.75 μM阿霉素的培养基中正常生长增殖,停药后2 w,冻存细胞,以此KB-A-1/Dox细胞为耐药性肿瘤细胞进行以下的实验,未经阿霉素诱导的KB-A-1细胞为对照肿瘤细胞。
1.4 抑制细胞增殖能力的测定
实验方法如参考文献[7]所示。将对数生长期细胞1×105cell/mL接种于96孔培养板,每孔0.2 mL,分别加入 0、10、50、100、150 μg/mL 浓度的灵芝酸T处理,对照组加等量体积的培养液,置37°C,5%CO2及饱和湿度的培养箱培养24 h,实验终止前4 h 每孔加入5 μg/mL MTT 10 μL,培养结束后每孔加入 0.04 M DMSO 200 μL,振荡保温 15 min,待MTT还原产物完全溶解,用BioRad 550型酶标仪,以550 nm为实验波长,655 nm为参照波长测定其吸收度,计算细胞的抑制率,并以药物的不同浓度和细胞的抑制率作图,确定细胞的半数抑制浓度(IC50)。实验重复6次,取平均值。
1.5 流式细胞仪检测凋亡
实验方法如参考文献所示[3],对数生长期细胞培养4 h后,加入 0、50、100 μg/mL 灵芝酸 T 作用24h后,经胰蛋白酶消化,离心收集细胞(1500 rpm×10 min),PBS洗涤2遍,以PBS调整细胞浓度为106个/mL,加入 RNase,终浓度为 100 U/mL,37 °C保温30 min,加入PI等荧光试剂,终浓度为50 μg/mL,在常温下暗反应30 min,然后200目滤膜过滤,经流式细胞仪分析凋亡,每次记录1000个细胞。
1.6 细胞内阿霉素含量的检测
根据参考文献用高效液相色谱(HPLC)检测[8]。取对数生长期细胞接种在24孔板中,浓度为105个/mL,细胞在0.5 μM 阿霉素和5 μg/mL 灵芝酸联合作用下处理4 h,对照为不加灵芝酸的细胞。处理后的细胞用冷PBS洗涤三次后,悬浮细胞,统一各组细胞浓度为1×105个/mL,加入0.5 mL水,反复冻融3次,12000 rpm离心30 min,上清用于阿霉素检测。分析条件为:检测器为荧光监测器,激发和发射波长为495 nm和560 nm。流动相为5 μM的磷酸/甲醇/乙腈/异丙醇:8∶7∶2∶3,使用前用0.45 μM的滤膜过滤,流速为0.8 mL/min。用已知浓度的阿霉素作标准曲线。
1.7 Rhodamine 123在细胞内含量分析
根据参考文献用荧光分光光度计检测[9]。取对数生长期细胞接种在24孔板中,浓度为每孔106个细胞。细胞首先培养4 h,然后加入灵芝酸和阿霉素,孵育4 h,对照为不加灵芝酸处理的细胞。加入Rhodamine123,浓度为20 μM,继续培养 60 min。处理后的细胞以冷PBS洗涤3次,加入0.5 mL水,悬浮细胞,调整细胞浓度保持一致(1×105个/mL),反复冻融3次,12000 rpm离心30 min,上清液用于Rhodamine 123荧光检测。荧光分光光度计的激发和发射波长分别为485 nm和530 nm。
1.8 统计学方法
采用SPSS统计软件对各组数据进行显著差异性分析,组间均数比较采用t检验,在P<0.05水平和P<0.01水平下判断其显著差异性。
2 结果与讨论
2.1 灵芝酸T抑制KB-A-1和KB-A-1/Dox细胞增殖并诱导其凋亡
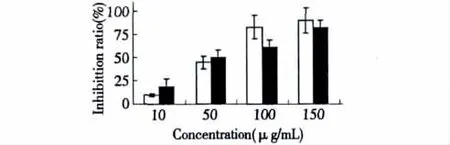
图1 灵芝酸T对KB-A-1和KB-A-1/Dox细胞的细胞毒性作用Fig.1 Cytotoxic effect of ganoderic acid T on KB-A-1 and KB-A-1/Dox cells
从灵芝酸T对阿霉素敏感肿瘤细胞KB-A-1和耐药性肿瘤细胞KB-A-1/Dox的细胞毒性结果可以看出(图 1),在 150 μg/mL的药物浓度下,超过80%的细胞被抑制生长,IC50值均约为50 μg/mL,对两种肿瘤细胞的IC50分析表明没有显著性差异(p<0.01)。结果表明灵芝酸对两种肿瘤细胞均表现出较强的细胞毒性,KB-A-1/Dox细胞的多药耐药性并未影响灵芝酸T作用效果。
肿瘤细胞的凋亡分析表明:灵芝酸T显著地诱导阿霉素敏感肿瘤细胞KB-A-1和耐药性肿瘤细胞KB-A-1/Dox的凋亡(图2)。在药物浓度从50 μg/mL增加到100 μg/mL的情况下,细胞凋亡率从20%增加到80%。结合图1结果,说明灵芝酸T可通过诱导凋亡抑制多药耐药型肿瘤细胞的增殖。

图2 灵芝酸T诱导KB-A-1 and KB-A-1/Dox细胞的凋亡Fig.2 Apoptosis of KB-A-1 and KB-A-1/Dox cells induced by ganoderic acid T
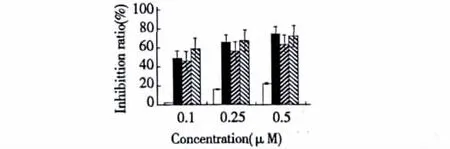
图3 灵芝酸T影响KB-A-1 and KB-A-1/Dox细胞对阿霉素的敏感性Fig.3 Effects of ganoderic acid T on inhibitory activity of KBA-1 and KB-A-1/Dox cells against doxorubicin(DOX)
2.2 灵芝酸T增加多药耐药性KB-A-1/Dox细胞对阿霉素的敏感性
图3表明在具有阿霉素抗性的KB-A-1/Dox细胞过程培养中,添加5 μg/mL灵芝酸T能显著增加阿霉素的细胞毒性。添加灵芝酸T后,阿霉素对多药耐药性细胞作用的IC50值减少到 0.103 μg/mL,与阿霉素对照组的IC502.294 μg/mL相比,细胞毒性增加了22.3倍。而5 μg/mL的灵芝酸T处理没有改变阿霉素敏感细胞株KB-A-1对阿霉素的敏感性,对照和处理组没有显著性差异。

图4 灵芝酸T提高KB-A-1/Dox细胞中阿霉素含量Fig.4 The concentration of DOX in KB-A-1/Dox cells under treatment of ganoderic acid T
2.3 灵芝酸T提高KB-A-1/Dox细胞内阿霉素和Rhodanmin123的含量
图4表明经过灵芝酸T处理过的KB-A-1/Dox细胞均能显著提高对阿霉素的吸收。4 μg/mL的灵芝酸处理后,可以显著提高耐药型肿瘤细胞内阿霉素含量。12 μg/mL的灵芝酸处理后,可以提高细胞内阿霉素含量达40%。结果表明:灵芝酸T能促进KB-A-1/Dox细胞对阿霉素的吸收。

图5 灵芝酸T促进KB-A-1/Dox细胞中Rhodanmin123的积累Fig.5 The accumulation of rhodanmin123 in the KB-A-1/Dox cells under the treatment of ganoderic acid T
KB细胞系的多药耐药性是由于P-gp的过量表达所致[9]。P-gp的作用底物很多,如生物碱、Rhodamine123等。Rhodanmin123是一种无毒的亲脂性的阳离子荧光剂,可以被P-gp介导的MDR细胞高效地泵出细胞。因此,观察细胞内的Rhodanmin123累积量,可以推测出药物对P-gp的影响。这一方法已被多个实验室所采用。图5表明灵芝酸T能增加耐药性KB-A-1/Dox细胞内的Rhodanmin123含量。12 μg/mL的灵芝酸T能使Rhodanmin123的累积量增加20%,而且累积效应是剂量依赖性的。由此可以推测灵芝酸影响了P-gp的表达量(进一步的蛋白质和基因分析正在进行中),降低了P-gp介导的药物泵出效应,减少了细胞对药物的排斥,使细胞内的药物浓度增加。由此可以推测:灵芝酸逆转多药耐药性的机理可能与P-gp的表达相关,即它们可能是P-gp的负调节因子,通过降低Pgp的活性或表达量来控制药物进入细胞的量。
3 结论
结果表明:灵芝酸T在相对较高的浓度条件下对阿霉素敏感型和耐药型肿瘤细胞株均有较强的细胞毒性,灵芝酸T可诱导两种细胞的凋亡。阿霉素诱导出的多药耐药性未影响到灵芝酸的抑制作用。而在较低的浓度条件下,灵芝酸T可以逆转耐药型肿瘤细胞经阿霉素诱导出的多药耐药性,使耐药型肿瘤细胞对阿霉素浓度的敏感性增加。
其次,经5 μg/mL的低浓度灵芝酸T处理后,多药耐药型肿瘤细胞内阿霉素和Rhodanmin123含量增加,提示灵芝酸T可能影响到P-gp蛋白的活性,引起细胞膜上某些载体的活性或含量发生变化,改变了细胞对药物分子的吸收程度。
MDR抑制剂的物化性质具有一定的普遍性,如具有共扼周期性(cyclicity)、亲脂性,在生理pH条件下为中性或带正电核物质。灵芝酸的物化性质与这些性质相类似,它们以羊毛甾醇作为骨架,在分子结构中有电子共扼体系,有强亲脂性,在生理pH条件下中性或带正电核的分子。所以,从物化性质结合本文的结论看,灵芝酸可能是一种潜在的MDR抑制剂。
参考文献
1 Toth O,Luu B,Ourisson G.Les acides ganoderiques taz:triterpens cytotoxiques de Ganoderma lucidum(polyporacee).Tetrahedron Lett,1983,24:1081-1084.
2 Liu RM,Li YB,Zhong JJ.Cytotoxic and pro-apoptotic effects of novel ganoderic acid derivatives on human cervical cancer cells in vitro.Eur J Pharmacol,2012,681(1-3):23-33.
3 Tang W,Liu JW,Zhong JJ,et al.Ganoderic acid T from ganoderma lucidum mycelia induces mitochondria mediated apoptosis in lung cancer cells.Life Sci,2006(80):205-211.
4 Bolhuis H,Veen HW,Poolman B,et al.Mechanisms of multidrug transporters.FEMS Microb Rev,1997,21:55-84.
5 Park JD,Rhee DK,Lee YH.Biological activities and chemistry of saponins from panax ginseng C.A.Meyer.Phytochem Rev,2005,4:159-175.
6 Shi SH(石书红),Zhang H(张辉).Reversal of multidrug resistance by neferin in human gastric carcinoma cell line SGC7901/VCR and its mechanism.Prac J Can(实用肿瘤杂志),2012,27:334-339.
7 Liu JW(刘建文).Methodology of Pharmacological Experiments(药理实验方法学).Beijing:Chemical Industry Press,2003.26-27.
8 Wei D,Mei Y,Liu J.Quantification of doxorubicin and validation of reversal effect of tea polyphenols on multidrug resistance in human carcinoma cells.Biotech Lett,2003,25:291-294.
9 Cho C,Liu Y,Yan X,et al.Carrier medicated uptake of rhodamine 123:implications on its use for MDR research.Biochem Biophys Res Comm,2000,279:124-130.

