SMYD3过表达对人肝内胆管癌细胞miR-124表达及细胞增殖的影响*
郑礼平, 李志花△, 陈汝福, 曾 兵, 周嘉嘉, 龚远锋, 宋亚东
(中山大学孙逸仙纪念医院 1肿瘤科, 2肝胆外科,广东 广州 510120)
SMYD3过表达对人肝内胆管癌细胞miR-124表达及细胞增殖的影响*
郑礼平1, 李志花1△, 陈汝福2, 曾 兵2, 周嘉嘉2, 龚远锋2, 宋亚东1
(中山大学孙逸仙纪念医院1肿瘤科,2肝胆外科,广东 广州 510120)
目的探讨肝内胆管癌细胞HCCC-9810中SET和MYND结构域含有蛋白3(SET and MYND domain-containing protein 3,SMYD3)过表达对miR-124表达及细胞增殖能力的影响。方法瞬时转染 SMYD3 真核表达质粒后, Western blotting 检测细胞中SMYD3 蛋白水平的变化;qRT-PCR 检测细胞中SMYD3 mRNA 和miR-124 表达;甲基化特异性PCR检测miR-124-1、miR-124-2和miR-124-3基因启动子甲基化水平;CCK-8 和平板克隆形成实验检测细胞增殖能力。结果以空白组为对照,肝内胆管癌细胞HCCC-9810在转染pEGFP-SMYD3质粒后,SMYD3蛋白及 mRNA 表达均显著上升(P<0.05),miR-124-1、miR-124-2和miR-124-3基因启动子甲基化显著增加(P<0.05),miR-124表达明显下降(P<0.05),细胞增殖能力显著提高(P<0.05)。结论过表达 SMYD3可引起miR-124基因启动子甲基化增加,导致胆管癌细胞中miR-124 的表达下降,同时过表达SMYD3可增强细胞增殖能力。
HCCC-9810细胞; SET和MYND结构域含有蛋白3; miR-124; 甲基化特异性PCR; 细胞增殖
SET及MYND结构域含有蛋白3(SET and MYND domain-containing protein 3, SMYD3)包含SET和MYND两个锌指型功能结构域。SET结构域具有组蛋白甲基转移酶功能,而MYND结构域则与基因启动子区域的特定序列结合,从而使靶基因发生甲基化,进而影响靶基因的转录,促进肿瘤细胞生长、侵袭和迁移等[1-2]。miR-124在多种肿瘤组织和细胞中表达下调,并受DNA甲基化调控[3-4]。本课题组前期研究发现在胆管癌细胞中转染丙型肝炎病毒核心蛋白(hepatitis C virus core protein,HCV C)可引起miR-124表达下调[5],同时可上调SMYD3的表达[6]。本研究通过上调胆管癌细胞SMYD3的表达,探讨HCV C调控miR-124表达的潜在机制,以进一步阐明丙型肝炎病毒的致癌机制。
材 料 和 方 法
1材料
人肝内胆管癌细胞株HCCC-9810购自中国科学院上海细胞库,RPMI-1640培养基及胰蛋白酶购自Gibco;SMYD3兔抗人单克隆抗体购自Santa Cruz;RNA提取试剂Trizol、DNA提取试剂(PureLinkTMGenomic DNA Kits)和脂质体(lipofectamineTM2000)均购自Invitrogen;qRT-PCR试剂盒购自TaKaRa。SMYD3真核表达质粒pEGFP-SMYD3由本课题组构建[7],无内毒素质粒提取试剂盒购自广州津美公司,重亚硫酸盐转化DNA甲基化检测试剂盒(MethylDetectorTMBisulfite Modification Kit)购自Invitrogen;96孔板购自Corning; CCK-8试剂购自日本同仁化学研究所。
2主要方法
2.1细胞培养和瞬时转染 HCCC-9810细胞培养于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2和相对湿度95%的恒温培养箱中培养。1~2 d换液,当细胞生长接近90%融合时,用质量浓度0.25%胰酶消化细胞,以1∶2或1∶3比例传代。将5×105个RBE细胞重悬于2 mL含10%胎牛血清的RPMI-1640培养基中,转种于6孔培养板中;37 ℃、5%CO2培养箱中培养24 h,待细胞融合达80%~90%时开始转染。转染前2 h更换不含血清的新鲜培养基。实验分组:A组:处理组,转染质粒pEGFP-SMYD3(以下简称SMYD3质粒组);B组:仅转染空载体pEGFP(以下简称空载体组);C组:空白组,仅以无血清培养基培养。按LipofectamineTM2000转染试剂盒说明书进行细胞转染,24~48 h后收集细胞进行转染后检测。如接种在96孔板中,按说明书相应地调整细胞数及转染试剂量。
2.2qRT-PCR检测SMYD3 mRNA及miR-124表达 转染24 h后,Trizol法提取各组细胞的总RNA,用紫外分光光度计检测提取RNA的浓度及纯度,并确定RNA的纯度在1.8~2.0之间。按qRT-PCR试剂盒操作说明书合成cDNA。 SMYD3 mRNA检测所用的引物序列依据GenBank中NM_022743序列设计。SMYD3(106 bp)上游引物5’-GGCAGAGAACACAGCCTGAT-3’,下游引物5’-ACACGCCGTATTTCCCTCT-3’;β-actin (186 bp)上游引物5’-AAGATGACCCAGATCATGTTTGAG-3’,下游引物5’-GCAGCTCGTAGCTCTTCTCCAG-3’。PCR反应参数为:95 ℃ 30 s, 95 ℃ 5 s及60 ℃ 20 s,共40个循环。 miR-124的荧光定量检测试剂盒购自广州锐博公司,U6为内参照。PCR反应条件:95 ℃ 20 s,95 ℃ 10 s,60 ℃ 20 s,70 ℃ 10 s,40个循环。所有标本均重复检测3次,计算出Ct值,采用2-ΔΔCt法进行计算分析。
2.3Western blotting测定SMYD3蛋白的表达 瞬时转染48 h后,按说明书提取总蛋白,BCA法测定蛋白浓度。配制10%SDS-PAGE凝胶电泳,各上样孔加入25 μg蛋白样品,电泳后转印至硝酸纤维素膜(PVDF)膜上。PVDF膜以50 g/L脱脂奶粉封闭2 h,加入SMYD3兔抗人单克隆Ⅰ抗(1∶1 000)于4 ℃孵育过夜。经TBST漂洗3次后,加入辣根过氧化物酶标记的羊抗兔Ⅱ抗(1∶5 000),室温孵育1 h,TBST漂洗3次,ECL化学发光法试剂盒显影、曝光。经Bio-Rad公司的图形分析软件Quantity One对图片进行分析并测定灰度值。取SMYD3/GAPDH的灰度值之比作为蛋白的相对表达量。
2.4甲基化特异性PCR测定miR-124基因启动子甲基化水平 瞬时转染24 h后,按说明书提取各组DNA。按MethylDetectorTMBisulfite Modification Kit试剂盒操作说明书进行甲基化特异性PCR反应。引物序列参照相关文献[8]。miR-124-1(U)上游引物5’- AATAAAGAGTTTTTGGAAGATGTT -3’,下游引物5’- AAAAAAATAAAAAACAACACATATAC -3’;miR-124-1(M)上游引物5’- AAAGAGTTTTTGGAAGACGTC -3’,下游引物5’- AATAAAAAACGACGCGTATA -3’。miR-124-2(U)上游引物5’- GGGGTAATTAATTTGGATTTATGTT -3’,下游引物5’- AAAACCACTATTAATTAATCTATTCCA -3’ ;miR-124-2(M)上游引物5’- GGGTAATTAATTTGGATTTACGTC -3’,下游引物5’- ACCGCTATTAATTAATCTATTCCG -3’。miR-124-3(U)上游引物5’- GGGTGAGGATTTTATGTAAGTTT -3’,下游引物5’- TTCACCACATACCTTAATTATATAAAC -3’;miR-124-3(M)上游引物5’- GCGAGGATTTTACGTAAGTTC-3’,下游引物5’- CCGCGTACCTTAATTATATAA -3’。甲基化特异性PCR条件为:94 ℃预变性3 min;94 ℃变性30 s,退火30 s(miR-124-1退火温度58 ℃,miR-124-2及miR-124-3的退火温度为55 ℃),72 ℃延伸30 s,共35个循环;最后72 ℃ 10 min。PCR产物经2.5%琼脂糖凝胶电泳鉴定,于凝胶成像系统拍摄并分析结果。
2.5CCK-8法检测细胞增殖情况 取处于对数期生长的HCCC-9810细胞,接种于96孔板,每孔接种1 000个细胞。培养24 h,约70%~80%融合后,转染目的质粒。实验分为SMYD3质粒组、空载体组和空白对照组。分别在转染10 h、15 h、20 h、25 h、30 h、35 h和40 h后,更换为不含血清的新鲜培养基,并向每孔加入10 μL CCK-8试剂。置于37 ℃孵育2 h,用酶标仪测定450 nm的吸光值,每个时点每组设5个复孔。
2.6平板克隆形成实验 将3×108/L HCCC-9810细胞接种于6 孔板内,恒温培养箱培养24 h后,按LipofectamineTM2000说明书进行质粒转染。转染24 h后将细胞用胰酶消化后吹散成单细胞悬液, 取1 000个细胞接种于中皿, 每组设3个重复孔,实验分为SMYD3质粒组、空载体组和空白对照组。于37 ℃、5% CO2和相对湿度95%的恒温培养箱中培养7 d。用多聚甲醛固定, 1%结晶紫染色。显微镜下计算克隆形成数(含有10 个细胞以上的集落为1个克隆),克隆形成率(%)=克隆形成数/接种细胞数×100%。
3统计学处理

结 果
1转染后SMYD3mRNA及蛋白表达
qRT-PCR检测显示,转染SMYD3质粒组的SMYD3 mRNA 表达水平均较空白组明显升高,比值为5.146±0.124,差异有统计学意义(P<0.05);而转染空载体组与空白组相比SMYD3 mRNA表达水平则无明显差异,比值为1.213±0.087(P>0.05),见图1。Western blotting 结果显示:转染SMYD3质粒组的 SMYD3蛋白表达水平较空白组明显升高,灰度比值为2.832±0.132,差异有统计学意义(P<0.05);而转染空载体组与空白组的 SMYD3蛋白表达水平则无明显差异,灰度比值为1.115±0.069(P>0.05),见图2。

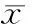
图1HCCC-9810细胞SMYD3mRNA的表达

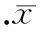
图2HCCC-9810细胞SMYD3蛋白的表达
2甲基化特异性PCR结果
甲基化特异性PCR结果显示,SMYD3质粒组miR-124-1、miR-124-2和miR-124-3基因启动子甲基化水平显著上调,比值分别为3.524±0.105、3.002±0.099和2.892±0.087,差异有统计学意义(P<0.05);而空载体组与空白组相比,三者表达水平则无明显差异(比值分别为1.106±0.033、1.098±0.053和0.998±0.047),见图3。

Figure 3. Methylation ofmiR-124 gene in HCCC-9810 cells. U: unmethylated; M: methylated. 1: blank group; 2: empty plasmid group; 3: SMYD3 plasmid group.
图3HCCC-9810细胞miR-124基因的甲基化
3SMYD3对miR-124表达的影响
qRT-PCR检测显示,转染SMYD3质粒组的miR-124表达水平均较空白组明显下降,比值为0.345±0.014,差异有统计学意义(P<0.05);而转染空载体组与空白组miR-124表达水平则无明显差异,比值为0.976±0.025(P>0.05),见图4。
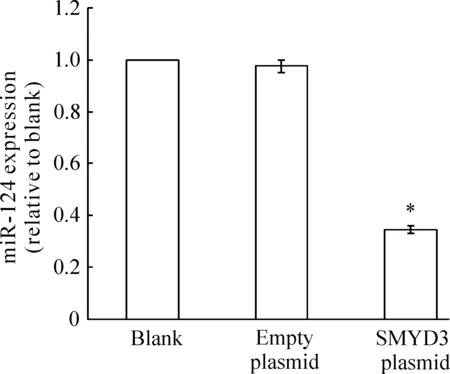
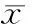
图4HCCC-9810细胞miR-124的表达
4SMYD3对细胞生长曲线的影响
CCK-8实验结果显示:转染SMYD3质粒组细胞在25 h~40 h,吸光度值显著高于空白组细胞,差异有统计学意义(P<0.05);而转染空载体的细胞与空白组细胞相比无显著差异(P>0.05),见图5。
5平板克隆实验
各组克隆形成率:SMYD3质粒组为48.3%±3.3%,空载体组为16.5%±2.1%,空白组为18.3%±2.4%。SMYD3质粒组细胞增殖能力显著强于空白组细胞,差异有统计学意义(P<0.05);而空载体组细胞与空白组无明显差异(P>0.05),见图6。
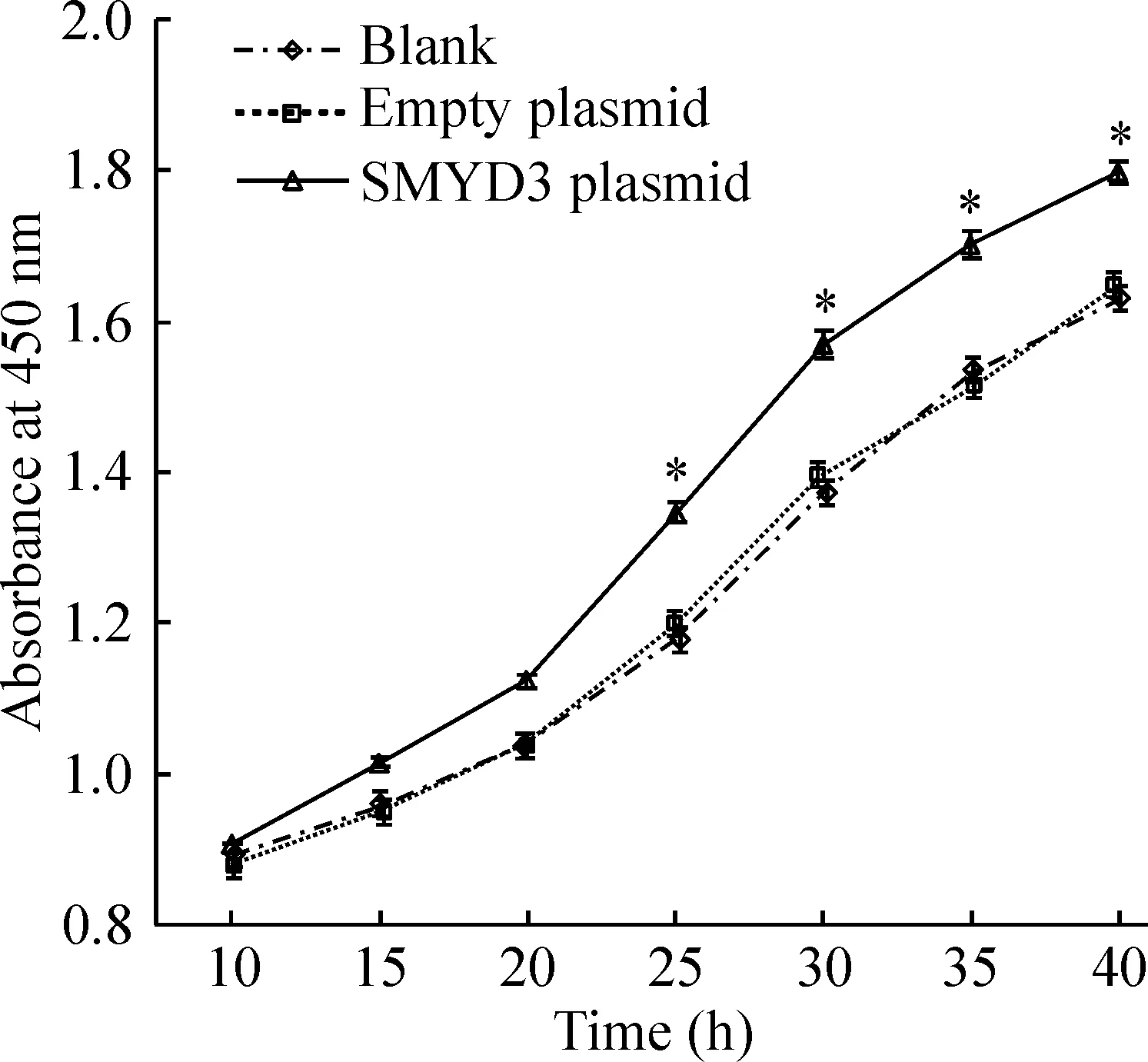
图5HCCC-9810细胞增殖曲线

图6HCCC-9810细胞的克隆形成率
讨 论
MicroRNA (miRNA) 是生物体内长度约为 21~23个核苷酸的非编码小 RNA, 广泛存在于各种动植物中。miRNA 与相关蛋白形成 RNA 诱导沉默复合体,结合靶基因mRNA,通过抑制蛋白质的翻译下调特异性基因的表达[9]。miRNA能控制细胞的生长、分化和凋亡,在肿瘤发生、发展过程中起着非常关键的作用,已成为肿瘤细胞与分子生物学研究领域中最受关注的生物分子之一[9-10]。在肿瘤发生发展过程中存在着miRNA的异常表达。miRNA 基因启动子区域CpG岛发生异常甲基化可以导致某些关键 miRNA 表达紊乱[11]。
miR-124在多种肿瘤组织和细胞中表达下调,包括肝癌、髓母细胞瘤、口腔鳞癌等,miR-124在其中发挥抑制肿瘤细胞生长、降低肿瘤侵袭性的作用[3-5]。成熟的miR-124由3种前体加工而成,miR-124-1(位于染色体8p23.1)、miR-124-2(位于染色体8q12.3)和miR-124-3(位于染色体20q13.33)。SMYD3在肝癌、胆管癌、乳腺癌、宫颈癌等中表达增高,促进肿瘤细胞生长、增殖和侵袭[ 1-2,6,12]。本课题组前期研究发现在胆管癌细胞中SMYD3的表达受miR-124的调控[5-6],且SMYD3可以引起抑癌基因RASSF1A启动子的甲基化,使RASSF1A表达下降,上调SMYD3可以引起DNA甲基化转移酶3B表达升高,促进胆管癌细胞增殖[6,13]。因此,我们推测,SMYD3和miR-124之间可能存在一个负反馈调控的关系:即miR-124在调控SMYD3表达的同时,反过来又受到SMYD3的调控。
本研究中,HCCC-9810细胞在转染SMYD3 质粒后,SMYD3 mRNA及蛋白表达均明显上升,而转染空载体组变化不明显,表明转染是成功的。过表达SMDY3能够显著上调miR-124-1、miR-124-2和miR-124-3基因启动子甲基化水平,miR-124表达亦明显降低,提示SMYD3可以通过诱导miR-124基因启动子区CpG岛甲基化而下调miR-124的表达。本研究提示,在HCV相关胆管癌中,可能存在一个由HCV C诱导形成的SMYD3-miR-124的负反馈通路,有待进一步研究证实。
SMYD3可直接或间接影响细胞中原癌基因蛋白(c-Met、JunD、Wnt10B等)、细胞周期调节蛋白(CDK2、DNA拓扑异构酶Ⅱβ等)、信号转导相关蛋白(RAB40C、GNRF2等)的表达量,促进细胞增殖[14-15]。本研究中,CCK-8及平板克隆增殖结果均提示SMYD3可促进胆管癌细胞增殖,与相关研究结果一致。
综上所述,SMYD3可引起组蛋白的甲基化修饰导致DNA甲基化酶的表达上调,进而诱导miR-124基因启动子甲基化来调控miR-124的表达。此外,过表达SMYD3可以促进胆管癌细胞增殖。本研究揭示了胆管癌中miR-124表达调控的新机制,有望为胆管癌的临床研究提供潜在可行的治疗靶点。
[1] Hamamoto R, Furukawa Y, Morita M , et al. SMYD3 encodes a histone methyltransferase involved in the proliferation of cancer cells[J]. Nat Cell Biol, 2004, 6(8):731-740.
[2] Wang SZ, Luo XG, Shen J, et al. Knockdown of SMYD3 by RNA interference inhibits cervical carcinoma cell growth and invasioninvitro[J]. BMB Rep, 2008, 41(4): 294-299.
[3] Furuta M, Kozaki KI, Tanaka S, et al. miR-124 and miR-203 are epigenetically silenced tumor-suppressive microRNAs in hepatocellular carcinoma[J]. Carcinogenesis, 2010, 31(5):766-776.
[4] Li KK, Pang JC, Ching AK, et al. miR-124 is frequently down-regulated in medulloblastoma and is a negative regulator of SLC16A1[J]. Hum Pathol, 2009, 40(9):1234-1243.
[5] Zeng B, Li Z, Chen R, et al. Epigenetic regulation of miR-124 by hepatitis C virus core protein promotes migration and invasion of intrahepatic cholangiocarcinoma cells by targeting SMYD3[J]. FEBS Lett, 2012, 586(19):3271-3278.
[6] Guo N, Chen R, Li Z, et al. Hepatitis C virus core upregulates the methylation status of the RASSF1A promoter through regulation of SMYD3 in hilar cholangiocarcinoma cells[J]. Acta Biochim Biophys Sin (Shanghai), 2011, 43(5):354-361.
[7] 郭 宁, 陈汝福, 周泉波, 等. SET-及MYND-结构域含有蛋白3真核表达载体的构建及对肝门部胆管癌细胞生物学行为的影响[J]. 中华实验外科杂志, 2012, 29(4):666-668.
[8] Lujambio A, Ropero S, Ballestar E, et al. Genetic unmasking of an epigenetically silenced microRNA in human cancer cells[J]. Cancer Res, 2007, 67(4):1424-1429.
[9] Ambros V. The functions of animal microRNAs[J]. Nature, 2004, 431(7006): 350-355.
[10]Schickel R, Boyerinas B, Park SM, et al. MicroRNAs: key players in the immune system, differentiation, tumorigenesis and cell death[J]. Oncogene, 2008, 27(45): 5959-5974.
[11]Weber B, Stresemann C, Brueckner B, et al. Methylation of human microRNA genes in normal and neoplastic cells[J]. Cell Cycle, 2007, 6(9):1001-1005.
[12]Hamamoto R, Silva FP, Tsuge M, et al. Enhanced SMYD3 expression is essential for the growth of breast cancer cells[J]. Cancer Sci, 2006, 97 (2):113-118.
[13]程 帝, 李志花, 陈汝福,等.上调SMYD3对人胆管癌FRH0201细胞中DNMT3B表达及细胞增殖的影响[J]. 中国病理生理杂志, 2012, 28(3):415-419.
[14] Zou JN, Wang SZ, Yang JS, et al. Knockdown of SMYD3 by RNA interference down-regulates c-Met expression and inhibits cells migration and invasion induced by HGF[J]. Cancer Lett, 2009, 280(1):78-85.
[15] Ren TN, Wang JS, He YM, et al. Effects of SMYD3 over-expression on cell cycle acceleration and cell proliferation in MDA-MB-231 human breast cancer cells[J]. Med Oncol, 2011, 28 (Suppl 1):91-98.
EffectofSMYD3over-expressiononmiR-124expressionandproliferationabilityinhumanintrahepaticcholangiocarcinomacells
ZHENG Li-ping1, LI Zhi-hua1, CHEN Ru-fu2, ZENG Bing2, ZHOU Jia-jia2,GONG Yuan-feng2, SONG Ya-dong1
(1DepartmentofOncology,2DepartmentofHepatobiliarySurgery,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:lzhzsdxsyx@126.com)
AIM: To explore the effect of SET and MYND domain-containing protein 3 (SMYD3) over-expression on miR-124 expression and proliferation ability of human intrahepatic cholangiocarcinoma cells.METHODSTransient transfection of SMYD3 eukaryotic expression plasmid into human intrahepatic cholangiocarcinoma cell line HCCC-9810 were performed. The expression of SMYD3 at mRNA and protein levels was measured by qRT-PCR and Western blotting, respectively. The expression ofmiR-124 was detected by qRT-PCR, and the methylation status ofmiR-124 gene was determined by methylation-specific PCR. Cell proliferation was examined by CCK-8 assay and colony formation experiment.RESULTSAfter transfected with SMYD3 eukaryotic expression plasmid, the over-expression of SMYD3 in HCCC-9810 cells was observed. Compared with the blank cells, the expression level of miR-124 was significantly decreased andmiR-124 gene promoter methylation was significantly increased. In addition, SMYD3 over-expression significantly promoted the proliferation of HCCC-9810 cells.CONCLUSIONThe transient transfection of SMYD3 plasmid increases the methylation ofmiR-124 gene promoter and induces under-expression of miR-124. Over-expression of SMYD3 promotes the proliferation of cholangiocarcinoma cells.
HCCC-9810 cells; SET and MYND domain-containing protein 3; miR-124; Methylation-specific PCR; Cell proliferation
R735. 8
A
10.3969/j.issn.1000-4718.2013.01.012
1000-4718(2013)01-0076-05
2012-07-20
2012-10-29
国家自然科学基金资助项目(No. 30872485)
△通讯作者 Tel: 020-81332107; E-mail: lzhzsdxsyx@126.com

