microRNA-21转染的心肌细胞移植对低温条件下心力衰竭大鼠的影响*
唐 艳, 王梦洪
(1南昌大学第一附属医院心血管内科,江西 南昌330006; 2南华大学附属第一医院心血管内科,湖南 衡阳 421001)
·论著·
microRNA-21转染的心肌细胞移植对低温条件下心力衰竭大鼠的影响*
唐 艳1,2, 王梦洪1△
(1南昌大学第一附属医院心血管内科,江西 南昌330006;2南华大学附属第一医院心血管内科,湖南 衡阳 421001)
目的探讨microRNA-21对低温条件下心力衰竭大鼠的影响。方法利用阿霉素及气候箱建立常/低温条件下心力衰竭大鼠模型,以心功能、心肌组织凋亡率及病理改变作为建模成功的观察指标。采用定量荧光PCR(qRT-PCR)检测各组心肌组织microRNA-21的表达。体外培养新生大鼠心肌细胞,标记BrdU,构建过表达microRNA-21的重组慢病毒表达载体并转染入心肌细胞。建模成功后将低温条件下心力衰竭的大鼠随机分为3组,分别注射转染了过表达microRNA-21的重组慢病毒表达载体的心肌细胞 (I组)、单纯心肌细胞 (II组)和DMEM培养基 (III组)。超声心动图检测各组心功能。处死大鼠,留取心脏标本进行HE病理染色及免疫组化检测。结果低温条件下心力衰竭大鼠(d组)的心功能低于常温条件下心力衰竭大鼠(c组);c组明显低于常温条件下正常大鼠(a组)。a组的心功能与低温条件下正常大鼠(b组)无明显差异。d组的心肌组织凋亡率高于c组;c组明显高于a组。a组的心肌组织凋亡率与b组无明显差异。microRNA-21在c组心肌组织中的表达低于a组;microRNA-21在d组心肌组织中的表达低于c组; microRNA-21在b组心肌组织中的表达低于a组;Ⅰ组microRNA-21的表达高于Ⅱ组(P<0.05);超声检测心功能提示I组和II组的心功能障碍轻于III组(P<0.05),尤以I组更显著(P<0.05);免疫组化检测显示,移植的心肌细胞在移植区存活;HE染色显示I组和II组的心力衰竭病理变化比Ⅲ组明显减轻(P<0.05),尤以I组更显著(P<0.05)。结论心肌细胞移植于低温条件下心力衰竭大鼠能改善心功能,减轻心肌组织的心衰病理变化,其中microRNA-21转染入心肌细胞后移植效果更显著,为microRNA-21未来诊断及治疗低温条件下心力衰竭提供了新思路。
心力衰竭; 心肌细胞; MicroRNA-21; 移植
随着环境的变化,恶劣气候等自然灾害已经成为严重威胁人类健康重要因素,对于已有基础心脏疾病的患者,恶劣环境是导致患者死亡的主要因素之一。Feldman等[1]在1990~1998年期间对加拿大魁北克和法国充血性心衰患者的季节性病死率和住院率进行了队列分析,发现每年1月的病死率和住院率最高,9月最低,呈现明显季节性变化趋势。Sun等[2]发现低温能通过增强交感神经系统和肾素-血管紧张素-醛固酮系统活性从而触发多种心血管并发症如中风、心肌梗死、心衰等的发生。然而,目前对低温条件下心力衰竭的概念一直不是很清晰,关于其病理生理分子机制和诊治的研究迄今为止在国内外仍未正式开展。
MicroRNA是真核生物中一种长度约为22个核苷酸大小、参与基因转录后调控的非编码单链小分子RNA,可特异性识别靶mRNA的3’-非编码区(3’-UTR)并与之结合,从而降解靶mRNA,抑制翻译,发挥其对基因的转录后表达调控,调节重要的细胞活动,参与众多心血管疾病的病理生理过程[3-4]。迄今为止,已经发现上千余种microRNA,其中microRNA-21在许多心血管疾病如心肌梗死[5]、心力衰竭[6]、心脏肥大中呈差异性表达,参与多种心血管疾病的病理生理分子机制。近年来研究发现外界温度的变化可能影响microRNA-21的表达。Biggar等[7]发现冰冻(-3 ℃,24 h)条件下青蛙肝脏和骨骼肌上microRNA-21的表达分别是非冰冻(5 ℃,24 h)条件下的1.5倍和1.3倍。Yin等[8]发现暴露于热休克状态下的小鼠心脏中microRNA-21的表达明显上调。Gammell等[9]通过用生物测序和RT-PCR检测人类、大鼠和小鼠microRNA的表达量,发现在中国仓鼠卵巢细胞中有26种microRNA在37 ℃和在31 ℃条件下呈差异性表达,其中microRNA-21在31 ℃明显上调。但是microRNA-21是否在低温条件下的心力衰竭中发挥重要的作用,目前尚不清楚。
心肌细胞移植是目前治疗心力衰竭的一个热门领域,它又称细胞心肌成形术。近年来部分动物实验已证实心肌细胞移植可以部分地替代凋亡坏死的心肌细胞而有效改善心功能。然而单纯的心肌细胞移植却因为宿主凋亡受损的心肌组织限制了移植的心肌细胞的存活与分化,大大降低了移植效率。如果能在心肌细胞移植的同时,通过某种措施增加某种抗心肌细胞凋亡因子,势必能同时抗宿主心肌细胞凋亡,提高移植功效,最终恢复宿主心功能[10]。近年来研究发现,microRNA-21是许多心血管疾病中的一个抗凋亡因子[11]。如果将能够过表达microRNA-21的心肌细胞移植于受损的心肌组织,理论上一方面能改善宿主心功能,另一方面还有利于移植心肌细胞的存活和生长分化,防止心室重构。本研究基于以上设想,将慢病毒介导的、过表达microRNA-21的乳鼠心肌细胞移植于低温条件下心力衰竭大鼠的心肌组织中,观察移植心肌细胞在宿主心肌组织的存活及对宿主心功能的影响。
材 料 和 方 法
1材料
1.1动物 Sprague-Dawley乳鼠数百只(出生1~3 d), 成年雄性SD大鼠91只, 体重250~270 g, 由南昌大学第一附属医院实验动物中心提供。
1.2主要试剂及仪器 阿霉素(Sigma), TUNEL试剂盒(Promega),气候箱(青岛海尔集团公司) , 超声心动仪(GE), DMEM培养基、新生小牛血清、胰蛋白酶及胶原酶II(Gibco), BrdU及BrdU抗体(Sigma), 过表达microRNA-21重组慢病毒表达载体(上海吉凯基因公司), 总RNA提取试剂Trizol(Invitrogen), qRT-PCR试剂盒(北京天根生化科技有限公司), 台式低温高速离心机(Sigma), 定量荧光PCR仪(ABI PRISM 7500), 倒置显微镜(Olympus), β-actin鼠抗多克隆抗体(Santa Cruz)。
2方法
2.1心力衰竭动物模型制备及分组 雄性SD大鼠52只, 喂养3 d后随机分为常温正常组(a组)、低温正常组(b组)、常温心衰组(c组)和低温心衰组(d组), 每组13只,心衰组采用腹腔注射阿霉素造模, 阿霉素用量为每次2.5 mg/kg,每周星期一和星期四各注射1次,共5周, 常温正常组和低温正常组同时腹腔注射等体积生理盐水。所有组放在常温条件下(25~28 ℃)5周, 5周后低温正常组和低温心衰组放置于气候箱中(4 ℃, 3 h; 重复4 d), 常温正常组和常温心衰组仍放置于常温条件下(25~28 ℃)。最后1 d行心脏彩超检查及HE组织病理检测, TUNEL法测心肌凋亡, 荧光定量PCR测心肌组织中microRNA-21的表达。
2.2超声心动图检查 选用GE vivid7彩色多谱勒超声诊断仪,高频探头(12 MHz),Gain 50 dB,深度2.5 cm。(1) 心力衰竭动物模型:于心力衰竭动物模型造模最后1 d,腹腔注射3%戊巴比妥钠麻醉,仰卧固定于木板上,胸部脱毛,接心电图,取大鼠胸骨旁左室长轴切面测量左室舒张末径(left ventricular internal dimension at end-diastole, LVIDd)、左室收缩末径(left ventricular internal dimension at end-systole,LVIDs)、射血分数(ejection fraction, EF)和缩短分数(fractional shortening, FS)。(2) 用于细胞移植的低温条件下心力衰竭动物模型:移植前和移植2周后,用同法检测各组心功能指标。
2.3组织学检查 (1) 心力衰竭动物模型: 于心力衰竭动物模型造模最后1 d,超声检查完毕后, 戊巴比妥钠过量麻醉处死大鼠, 取出左室心肌部分, 以10%甲醛固定, 常规石蜡包埋, 病理切片,将切片用二甲苯脱蜡,乙醇梯度脱水, HE染色, 光镜下观察。(2) 用于细胞移植的低温条件下心力衰竭动物模型:于移植2周后,用HE染色检测各组心肌组织的病理变化。
2.4TUNEL法检测心肌组织凋亡率 实验步骤严格按照TUNEL检测试剂盒说明书进行。取出左室心肌部分、依次按照固定、包埋、切片、脱蜡、封闭、加TUNEL反应液孵育、加抗荧光素抗体、DAB显色、复染、脱水、封片等步骤进行。以不加TdT酶者为阴性对照, 分别以用DNase I(10 mg/L)消化的左心室心肌切片为阳性对照。正常心肌细胞核呈蓝色, 凋亡心肌细胞核呈棕黄色。每只大鼠(光镜下)观察4张切片,每张切片在40倍视野下, 随机计数5个不同视野的凋亡细胞及细胞总数, 计算凋亡细胞数占总细胞的百分率, 取其平均值为凋亡指数(AI)。
2.5组织及细胞总RNA提取和qRT-PCR检测 取一定量的组织及细胞经干预后,依据产品说明书用Trizol裂解, 氯仿抽提总RNA。MicroRNA及内参U6逆转录反应合成模板cDNA, 条件为37 ℃ 60 min,37 ℃ 60 min,-20 ℃保存。MicroRNA-21引物序列: 上游5’ -CCTGCCTGAGCACCTCGTGC-3’,下游5’ -GACTGTGACGACTACCCCAA-3’。产物片段长度为75 bp, 退火温度为60 ℃,PCR反应循环次数为40次。以U6为内参照,其引物序列:上游5’ -CTCGCTTCGGCAGCACA-3’, 下游5’ -AACGCTTCACGAATTTGCGT-3’。产物片段长度为109 bp, 退火温度为60 ℃, PCR反应循环次数为40次。以上引物均由上海捷瑞生物有限公司合成提供的。数据采用2-ΔΔCT法分析。以20 μL反应体系进行PCR, 取2 μL逆转录反应产物分别与microRNA-21引物和内参照U6引物进行反应。反应条件为: 94 ℃预变性2 min, 94 ℃ 20 s, 60 ℃ 30 s, 72 ℃ 30 s。重复40次循环。在ABI PRISM 7500 REAL TIME PCR System上操作反应, 检测microRNA-21的相对表达量。
2.6用于细胞移植的低温条件下心力衰竭动物模型制备及分组 雄性SD大鼠39只, 喂养3 d后随机分为移植转染了lenti-microRNA-21的心肌细胞组(I组)、移植单纯心肌细胞组(II组)和移植DMEM培养基组(III组), 每组13只, 各组采用腹腔注射阿霉素造模, 阿霉素的量每次2.5 mg/kg, 每周注射2次, 共5周, 各组均放在常温条件下(25~28 ℃)5周,5周后各组放置于气候箱中(4 ℃, 3 h; 重复4 d), 最后1 d行心脏彩超检查并进行细胞移植。
2.7Lenti-microRNA-21转染心肌细胞及microRNA-21检测 原代培养48 h后, 选生长良好的心肌细胞(贴壁伸展良好、细胞搏动佳),转染lenti-microRNA-21 (MOI=10,n=3),设置单纯心肌细胞组(只加培养基,n=3)。2组终末体积用含10%新生牛血清DMEM调至5 mL,24 h后换液加入含10%新生牛血清DMEM 10 mL, 37℃、5% CO2条件下培养,隔天换液。于第5 d(此时达到转染高峰)收集心肌细胞,利用qRT-PCR检测心肌细胞中microRNA-21的表达,并进行心肌细胞移植。
2.8移植细胞的准备及移植 选生长良好的已转染或未转染lenti-microRNA-21的乳鼠心肌细胞,用0.25%胰蛋白酶消化,离心后,用不含血清的DMEM培养基配成2×1010/L的细胞悬液。移植方法:20%乌拉坦(300 mg/kg,ip)联合1.5%戊巴比妥(20 mg/kg,ip)复合麻醉及呼吸机支持下,经左胸4或5肋间开胸,将100 μL细胞悬液或DMEM培养基多点斜行注射到大鼠心肌组织中,注射深度约0.5~0.8 mm。关胸并继续饲养2周。术前24 h及术后每天予以环孢菌素A(诺华制药)5 mg/kg皮下注射抑制免疫排斥反应,注射3 d左右,青霉素105U/kg皮下注射抗感染,注射3 d。
2.9抗BrdU免疫组化检查 实验步骤严格按照抗BrdU免疫组化检测试剂盒说明书进行,简述如下:脱蜡、洗涤,0.5% H2O2室温孵育封闭,正常马血清室温孵育,Ⅰ抗4 ℃孵育过夜,Ⅱ抗孵育45 min,亲合素-生物素复合物(avidin-biotin complex,ABC)室温孵育60 min,二氨基联苯胺(diaminobenzidine,DAB)和H2O2孵育2~10 min,苏木素复染,脱水,透明,封片,显微镜下观察。
3统计学处理
数据以均数±标准差(mean±SD)表示。应用SPSS 12.0统计学软件对实验结果进行单因素方差分析或t检验比较,以P<0.05为差异有统计学意义。
结 果
1实验动物存活评价
1.1心力衰竭动物模型 52只大鼠用于制作心力衰竭模型,建模过程中共计5只死亡,总死亡率9.6%,其中常温正常组和低温正常组无一死亡,常温心衰组死亡2只,死亡率为15.4%,低温心衰组死亡3只,死亡率为23.1%。
1.2用于细胞移植的低温条件下心力衰竭动物模型 39只大鼠用于制作低温条件下心力衰竭模型,在建立模型过程中共计9只死亡,总死亡率23%,其中每组的死亡数目均为3只。存活的30只大鼠入选移植实验。移植术后共有6只大鼠死亡,总死亡率20%,其中DMEM培养基移植组死亡3只,死亡率为30%,单纯心肌细胞移植组死亡2只,死亡率为20%,转染了lenti-microRNA-21的心肌细胞移植组死亡1只,死亡率为10%。
2各组心脏功能的变化
2.1心力衰竭动物模型 与常温正常组相比,常温心衰组LVIDd和LVIDs明显增加(P<0.05), FS明显降低(P<0.05)。而低温心衰组相比常温心衰组LVIDd和LVIDs进一步增加(P<0.05), FS和EF进一步降低(P<0.05), 提示低温能恶化心力衰竭的进展, 心功能进一步降低。低温正常组的LVIDd、LVIDs、FS和EF与常温正常组相比差异无统计学意义(P>0.05),见图1。
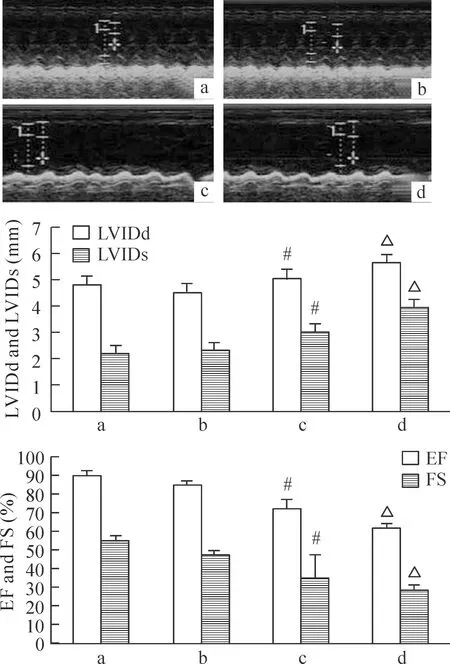
Figure 1. Cardiac functions of heart failure rats in the normal or cold environment detected by echocardiogram. LVIDd: left ventricular internal dimension at end-diastole; LVIDs: left ventricular internal dimension at end-systole; EF: ejection fraction; FS: fractional shortening. Group a: normal rats in the normal environment (n=13); group b: normal rats in the cold environment (n=13); group c: heart failure rats in the normal environment (n=11); group d: heart failure rats in the cold environment (n=10). Mean±SD.#P<0.05vsgroup a;△P<0.05vsgroup c.
图1心脏彩超检测正常或低温条件下心衰大鼠的心功能
2.2用于细胞移植的低温条件下心力衰竭动物模型 细胞移植后2周, 检查显示: I组和Ⅱ组中EF与移植前相比有明显差别。与III组相比, I组和II组的LVIDd和LVIDs减小(P<0.05), EF和FS增加(P<0.05)。与II组相比, I组EF和FS增加(P<0.05),LVIDd和LVIDs减小(P<0.05)。I组及Ⅱ组移植后较移植前心脏射血功能增加,室壁变厚,心腔变小; III组移植后较移植前室壁运动、室壁厚度和心腔大小无差别。上述结果提示移植单纯心肌细胞组和移植转染了microRNA-21的心肌细胞组较移植单纯DMEM培养基组心功能明显改善,尤以移植转染了microRNA-21的心肌细胞组更明显,见图2和表1。
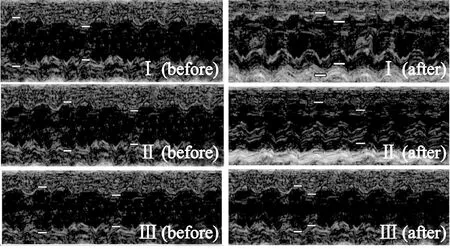
Figure 2. Cardiac functions of heart failure rats in the cold environment before and 2 weeks after cardiomyocyte transplantation detected by echocardiogram. Group I: transplanted with microRNA-21-transfected cardiomyocytes; group II: transplanted with untransfected cardiomyocytes; group III: transplanted with DMEM.
图2心脏彩超检测心肌细胞移植前和移植2周后低温心衰大鼠的心功能
表1低温心衰大鼠心肌细胞移植前和移植2周后心功能各指标的变化
Table 1. The changes of cardiac functions of heart failure rats in the cold environment before and 2 weeks after cardiomyocyte transplantation (mean±SD)
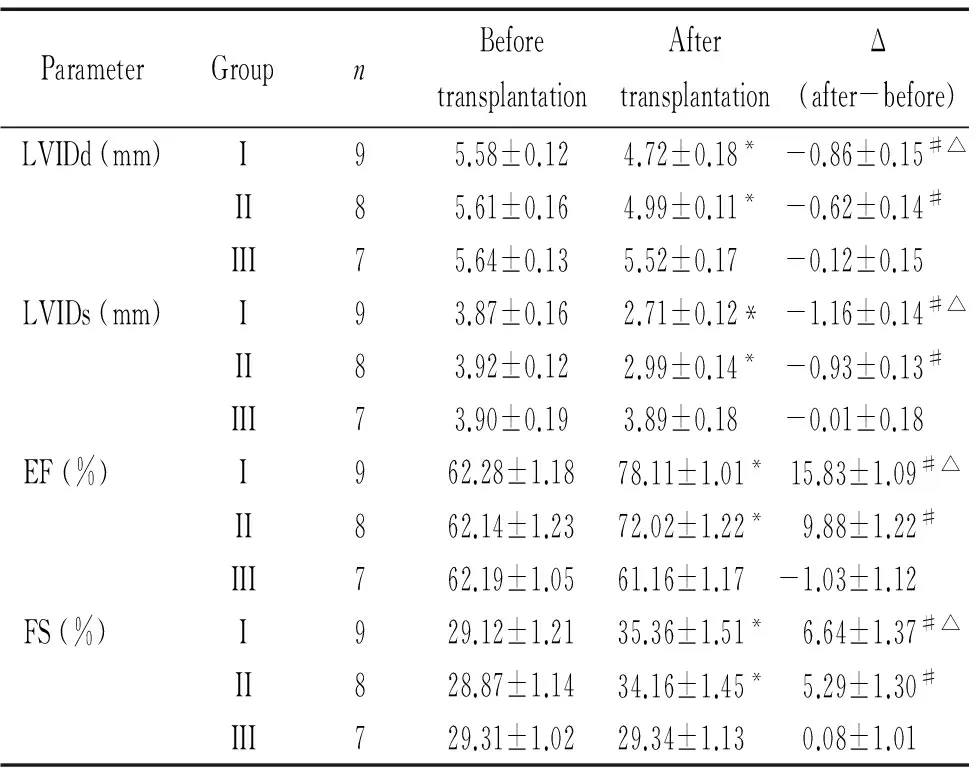
ParameterGroupnBeforetransplantationAftertransplantationΔ(after-before)LVIDd(mm)I95.58±0.124.72±0.18*-0.86±0.15#△II85.61±0.164.99±0.11*-0.62±0.14#III75.64±0.135.52±0.17-0.12±0.15LVIDs(mm)I93.87±0.162.71±0.12*-1.16±0.14#△II83.92±0.122.99±0.14*-0.93±0.13#III73.90±0.193.89±0.18-0.01±0.18EF(%)I962.28±1.1878.11±1.01*15.83±1.09#△II862.14±1.2372.02±1.22*9.88±1.22#III762.19±1.0561.16±1.17-1.03±1.12FS(%)I929.12±1.2135.36±1.51*6.64±1.37#△II828.87±1.1434.16±1.45*5.29±1.30#III729.31±1.0229.34±1.130.08±1.01
LVIDd: left ventricular internal dimension at end-diastole; LVIDs: left ventricular internal dimension at end-systole; EF: ejection fraction; FS: fractional shortening. Group I: transplanted with microRNA-21-transfected cardiomyocytes; group II: transplanted with untransfected cardiomyocytes; group III: transplanted with DMEM.*P<0.05vsbefore transplantation;#P<0.05vsgroup III;△P<0.05vsgroup II.
3各组心肌组织的病理表现
3.1心力衰竭动物模型 光镜下可见常温条件下正常组和低温条件下正常组心肌细胞形态、胞质、间质及横(纵)纹均为正常;常温条件下心力衰竭组存在心肌细胞横(纵)纹不清, 部分区域肌质纤维溶解, 胞浆空泡变性, 不同程度的炎症细胞浸润和间质水肿病变表现;低温条件下心力衰竭组的病变较常温条件下心力衰竭组明显严重,见图3。
3.2用于细胞移植的低温条件下心力衰竭动物模型 病理切片HE染色显示植入的心肌细胞体积较小, 核浆比例明显增大, 表现出幼稚细胞的特征。I组和II组较III组病理改变(肌质纤维溶解、胞浆空泡变性、炎症细胞浸润和间质水肿病变)明显减轻,尤以I组减轻得更明显, 提示移植单纯心肌细胞组和移植转染了microRNA-21的心肌细胞组较移植DMEM培养基组心肌病理改变明显改善,尤以移植转染了microRNA-21的心肌细胞组更明显,见图4。
4TUNEL检测各组心肌组织的凋亡率
光镜下常温条件下正常组和低温条件下正常组偶见TUNEL阳性细胞,常温条件下心力衰竭组可见明显TUNEL染色阳性细胞, 低温条件下心力衰竭组可见更多TUNEL染色阳性细胞,见图5。常温条件下心力衰竭组和低温条件下心力衰竭组凋亡指数分别为28.79±3.10和23.56±2.20, 均显著高于常温条件下正常组和低温条件下正常组的3.56±1.21和4.21±0.88(P<0.05), 常温条件心衰组凋亡指数又显著低于低温条件下心力衰竭组(P<0.05)。常温条件下正常组和低温条件下正常组凋亡指数差异无统计学意义(P>0.05)。上述结果提示常温正常组和低温正常组无明显心肌组织凋亡,常温心衰组心肌凋亡明显,低温心衰组心肌凋亡更明显。
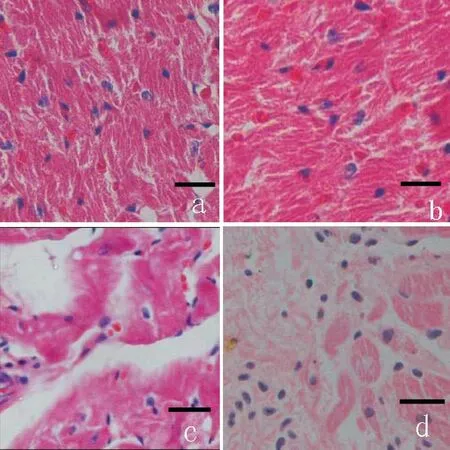
Figure 3. Pathological changes of myocardial tissues from heart failure rats in the normal or cold environment (HE staining, scale bar=20 μm). Group a: normal rats in the normal environment; group b: normal rats in the cold environment; group c: heart failure rats in the normal environment; group d: heart failure rats in the cold environment.
图3HE染色检测正常或低温条件下心衰大鼠心肌组织的病理变化

Figure 4. Pathological changes of myocardial tissues from heart failure rats in the cold environment 2 weeks after cardiomyocyte transplantation (HE staining, scale bar=20 μm). Group I: transplanted with microRNA-21-transfected cardiomyocytes; group II: transplanted with untransfected cardiomyocytes; group III: transplanted with DMEM.
图4HE染色检测心肌细胞移植2周后低温心衰大鼠心肌组织的病理变化
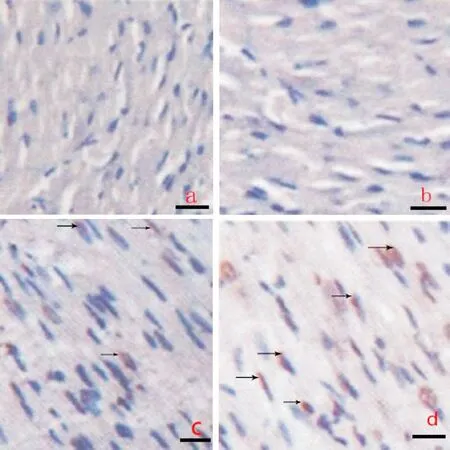
Figure 5. Apoptosis of myocardial tissues from heart failure rats in the normal or cold environment (TUNEL, scale bar=20 μm). Group a: normal rats in the normal environment; group b: normal rats in the cold environment; group c: heart failure rats in the normal environment; group d: heart failure rats in the cold environment. Arrows indicate apoptotic cells.
图5TUNEL法检测正常或低温条件下心衰大鼠心肌组织的凋亡情况
5MicroRNA-21的相对表达量
5.1心力衰竭动物模型 各样本反应达到预设荧光信号时,常温条件下正常组microRNA-21和内参照U6的循环数分别为21.63±0.04和14.27±0.02,低温条件下正常组分别为23.71±0.05和16.69±0.06,常温条件下心力衰竭组分别为28.91±0.02和15.73±0.05,低温条件下心力衰竭组分别为29.88±0.06和16.52±0.03。2-ΔΔCt法分析结果显示,与常温件下正常组相比, 低温条件下正常组的microRNA-21的表达量下调, 约0.5倍(P<0.05);常温条件下心力衰竭组的microRNA-21的表达量明显下调, 约1/16倍(P<0.05);低温条件下心力衰竭组的microRNA-21的表达量下调更明显, 约1/32(P<0.05),见图6。
5.2细胞移植 正常心肌细胞组microRNA-21和U6循环数分别为33.65±0.18和21.43±0.63, 转染了过表达microRNA-21的重组慢病毒载体的心肌细胞组分别为30.71±0.47和26.51±0.43。2-ΔΔCt法分析结果显示, 转染了过表达microRNA-21重组慢病毒表达载体的心肌细胞中microRNA-21的表达显著高于未转染组(P<0.05), 约3倍,见图7。
6移植的心肌细胞的存活情况
I组和II组心肌组织抗BrdU免疫组化染色显示心肌细胞胞浆淡染, 宿主心肌细胞胞核较细长, 呈深蓝色,移植的乳鼠心肌细胞胞核多呈卵圆形, 棕褐色,提示移植的心肌细胞在低温条件下心力衰竭大鼠的心肌组织中能存活,见图8。
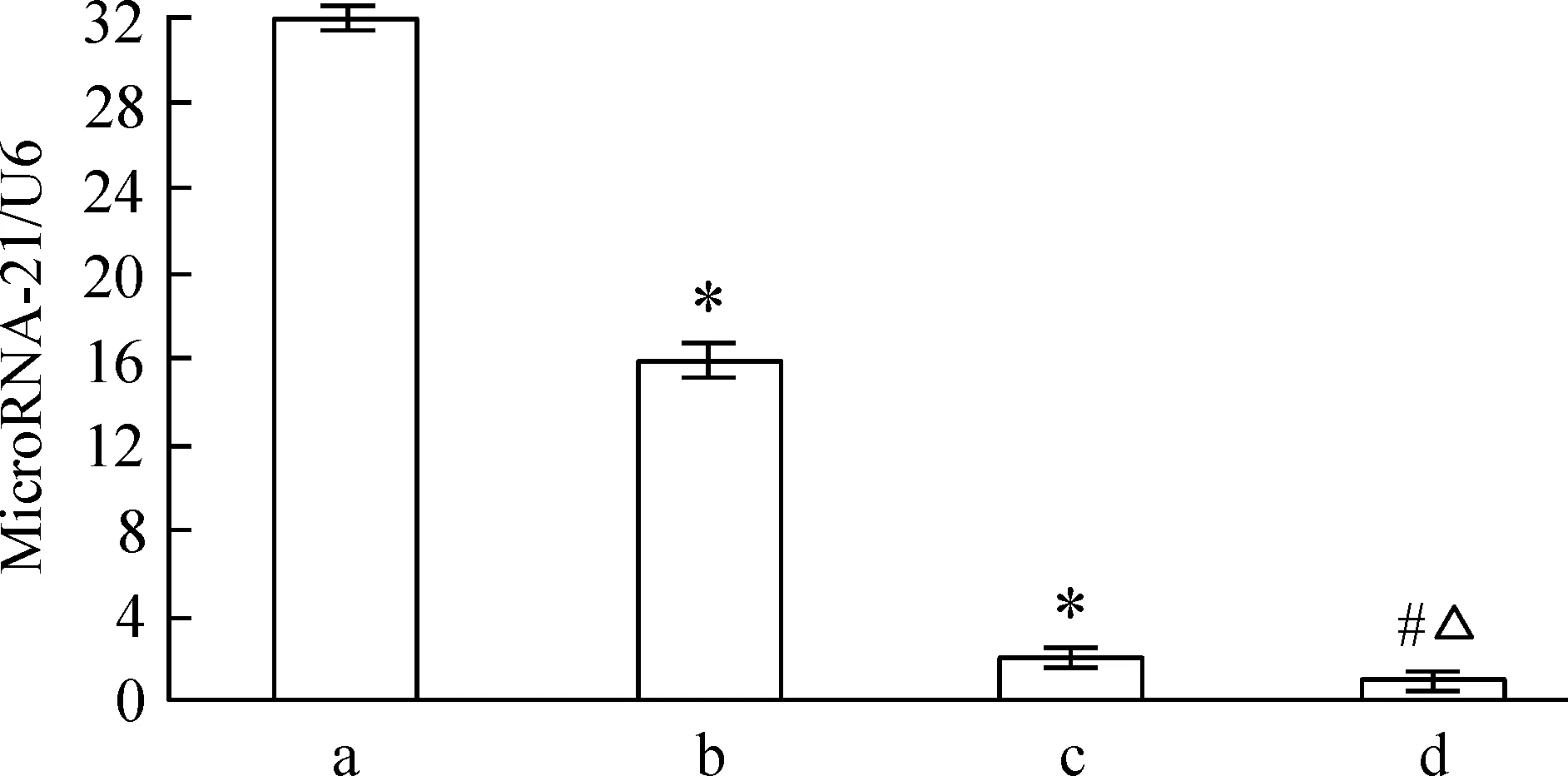
Figure 6. The expression of microRNA-21 in myocardial tissues from heart failure rats in the normal or cold environment detected by qRT-PCR. Group a: normal rats in the normal environment; group b: normal rats in the cold environment; group c: heart failure rats in the normal environment; group d: heart failure rats in the cold environment. Mean±SD.*P<0.05vsgroup a;#P<0.05vsgroup b;△P<0.05vsgroup c.
图6qRT-PCR检测正常或低温条件下心衰大鼠心肌组织中microRNA-21的表达
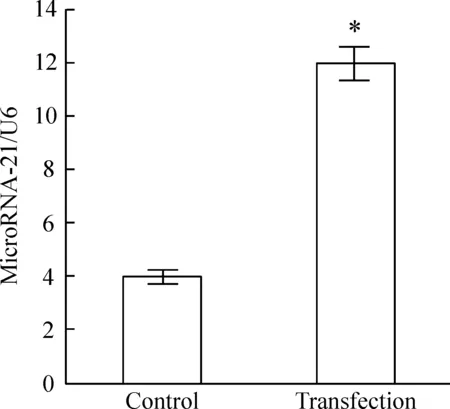
Figure 7. The expression of microRNA-21 in cardiomyocytes in microRNA-21 transfection group and control group detected by qRT-PCR.Mean±SD.*P<0.05vscontrol group.
图7qRT-PCR法检测转染后心肌细胞中microRNA-21的表达
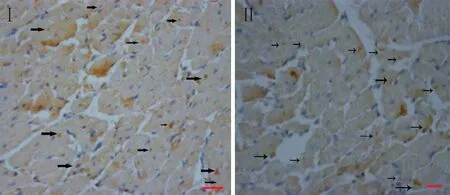
Figure 8. Survival of cardiomyocytes transplanted into myocardial tissues of heart failure rat in the cold environment (immunohistochemical staining for BrdU, scale bar=20 μm). Group I: transplanted with microRNA-21-transfected cardiomyocytes; group II: transplanted with untransfected cardiomyocytes. The cytoplasm of cardiomyocytes was stainless, while the nuclei of transplanted cardiomyocytes were ovate and stained in brown (arrows).
图8抗BrdU免疫组化染色法检测低温心衰大鼠心肌组织中移植的心肌细胞的存活情况
讨 论
心力衰竭(心衰)仍是目前导致死亡和致残的主要原因,每年死亡率高达7.2%。当今社会随着生态环境的不断被破坏,极端气候已经成为21世纪危害人类健康的第一杀手,成为心脏疾病患者诱发心衰的主要因素之一[12]。然而目前对于低温条件下心力衰竭的研究尚未在国内外完全开展。本研究通过利用阿霉素及气候箱模拟构建低温条件下心力衰竭模型,结果发现低温对正常大鼠的心功能及心肌细胞凋亡率无明显影响,但对心衰大鼠具有明显影响,能明显降低心功能及增加心肌细胞凋亡率,故本研究以低温条件下心力衰竭大鼠模型作为研究基石,以寻找治疗低温条件下心力衰竭的有效基因及探讨相关机制。
本研究通过利用qRT-PCR检测常/低温条件下正常大鼠及心力衰竭大鼠心肌组织中的microRNA-21的表达,结果显示microRNA-21对阿霉素和低温都敏感。阿霉素能明显下调心肌组织中microRNA-21的表达,提示microRNA-21可能参与氧化应激及心肌细胞凋亡相关的心血管疾病如心力衰竭的病理生理过程;在低温条件下的大鼠模型中,低温条件能更明显下调心肌组织中microRNA-21的表达,提示microRNA-21可能参与低温条件下的心血管疾病如低温条件下心力衰竭的病理生理过程。总而言之,在低温条件下心力衰竭大鼠心肌组织中microRNA-21明显下调,与心肌组织凋亡程度及心功能呈负相关,揭示microRNA-21可能是保护性因子,故本研究通过心肌细胞移植及慢病毒转染法上调低温条件下心力衰竭大鼠心肌组织中microRNA-21的表达以达到治疗作用。
随着基础和临床研究的不断开展,细胞移植治疗心力衰竭已取得了很大的进展[13-14]。心肌细胞移植治疗时,所移植的细胞必须能到达心脏受损部位并在疤痕组织存活、分化;移植或分化后的细胞需具有收缩能力,并和疤痕外的自身心肌细胞形成有效细胞缝隙连接及电生理偶联。目前大量动物实验证实心肌细胞移植于宿主心肌组织中不仅能存活,并且能与宿主心肌组织建立缝隙连接并改善宿主心功能。然而单纯的细胞移植有一定的局限性,移植细胞的存活与进一步分化成熟很大程度上决定了心功能的改善程度[15]。而衰竭的心肌组织不利于细胞生存,降低了移植效果。因此近年来有学者将microRNA与细胞移植联合进行注射,发现能更良好地改善心功能[10]。Sayed等[6]发现过表达microRNA-21的转基因大鼠能抑制PTEN及FasL的表达上调,缩小梗死面积及减轻心衰的进展。本研究将过表达microRNA-21的心肌细胞移植于低温条件下心力衰竭大鼠的心肌组织中,显著改善了衰竭心肌组织的心功能。本研究选择出生24 h内的乳鼠心肌细胞为研究对象,抗BrdU免疫组化结果显示大部分移植细胞抗BrdU染色呈阳性,提示移植的乳鼠心肌细胞在宿主衰竭的心肌组织中大部分能存活,其中部分具有复制及分裂增生能力。心脏彩超结果显示,在单纯心肌细胞移植组,细胞移植后其左室前壁厚度增厚,左室舒张末期容积减小,与单纯DMEM培养基移植组相比有明显差异,说明抑制心室扩大及重构的主要因素在于移植细胞对瘢痕组织的替代作用和细胞性心肌塑形作用。在lenti-microRNA-21转染的心肌细胞移植组,心功能的改善优于单纯心肌细胞移植组,左室舒张末期容积减小及室壁厚度增厚更明显,进一步说明心功能的改善有利于移植细胞的存活,提高了移植存活细胞数量,而存活的移植细胞防止了瘢痕区进一步扩张,从而抑制了宿主心室重构。HE染色病理切片也证实移植单纯心肌细胞及转染了过表达microRNA-21的重组慢病毒表达载体的心肌细胞后能减轻宿主心肌组织病理改变,其中以后者更显著,这对于移植心肌细胞的存活是至关重要的。总而言之, 新生乳鼠心肌细胞移植能够在宿主大鼠心肌组织中存活并改善其心功能;转染了microRNA-21的心肌细胞更能够明显改善宿主心功能,从而揭示microRNA-21可能在未来治疗低温条件下的心力衰竭中发挥重要的作用。
在移植实验中,移植单纯培养基组移植后有3只大鼠死亡,可能与低温条件下心力衰竭大鼠心功能差导致大鼠不能承受开胸有关。在移植后,移植心肌细胞(包括转染组)的2组共计3只大鼠死亡,可能与持续应用免疫抑制剂有关。因此,如何选择合适的免疫抑制剂治疗剂量和疗程还有待进一步研究。
[1] Feldman DE, Platt R, Déry V, et al. Seasonal congestive heart failure mortality and hospitalization trends, Quebec 1990-1998 [J].J Epidemiol Community Health, 2004, 58(2): 129-130.
[2] Sun Z. Cardiovascular responses to cold exposure [J]. Front Biosci (Elite Ed), 2010, 2: 495-503.
[3] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function [J].Cell, 2004, 116(2):281-297.
[4] Pushparaj PN, Aarthi JJ, Kumar SD, et al. RNAi and RNAa: the Yin and Yang of RNAome [J].Bioinformation,2008,2(6):235-237.
[5] Roy S, Khanna S, Hussain SR, et al. MicroRNA expression in response to murine myocardial infarction: miR-21 regulates fibroblast metalloprotease-2 via phosphatase and tensin homologue [J]. Cardiovas Res, 2009, 82(1):21-29.
[6] Sayed D, He M, Hong C, et al. MicroRNA-21 is a downstream effector of AKT that mediates its anti-apoptotic effects via suppression of Fas ligand [J]. J Biol Chem, 2010, 285(26): 20281-20290.
[7] Biggar KK, Dubuc A, Storey K. MicroRNA regulation below zero:differential expression of miRNA-21 and miRNA-16 during freezing in wood frogs[J]. Cryobiology, 2009, 59(3): 317-321.
[8] Yin C, Wang X, Kukreja RC. Endogenous microRNAs induced by heat-shock reduce myocardial infarction following ischemia-reperfusion in mice [J]. FEBS Lett, 2008, 582(30): 4137-4142.
[9] Gammell P, Barron N, Kumar N, et al. Initial identification of low temperature and culture stage induction of miRNA expression in suspension CHO-K1 cells[J]. J Biotechnol, 2007, 130(3): 213-218.
[10]de Muinck ED. Gene and cell therapy for heart failure [J]. Antioxid Redox Signal, 2009, 11(8): 2025-2042.
[11]Li S, Liang Z, Xu L, et al. MicroRNA-21: a ubiquitously expressed pro-survival factor in cancer and other diseases [J]. Mol Cell Biochem, 2012, 360(1-2):147-158.
[12]Cohn JN, Bristow MR, Chien KR, et al. Report of the National Heart, Lung and Blood Institute. Special Emphasis Panel on Heart Failure Research [J].Circulation, 1997, 95(4):766-770.
[13]张 勇,蔡振杰,陈如坤.自体骨髓基质干细胞移植治疗兔缺血心肌的实验研究[J].中国病理生理杂志,2005,21(2):356-360.
[14]蒙艳斌,贺莉萍,钱海燕.胚胎干细胞移植治疗急性心肌梗死后心肌病理形态学及血流动力学变化[J].中国病理生理杂志,2005,21(3):601-603.
[15]郎明建,曾秋棠,关思虞,等. 血管内皮生长因子基因转染的心肌细胞移植对心肌梗死大鼠心功能的影响[J].中国病理生理杂志,2006,22(9):1684-1688.
EffectofmicroRNA-21-transfectedcardiomyocytetransplantationonheartfailureratsunderlow-temperaturecondition
TANG Yan1,2, WANG Meng-hong1
(1DepartmentofCardiology,theFirstAffiliatedHospitalofNanchangUniversity,Nanchang330006,China;2DepartmentofCardiology,theFirstAffiliatedHospitalofNanhuaUniversity,Hengyang421001,China.E-mail:wmh666888@sina.com)
AIM: To investigate the effects of microRNA-21 on heart failure rats under the low-temperature condition.METHODSThe rat model of heart failure was constructed by injection of adriamycin and the rats were placed in a climate box. The cardiac functions, the apoptotic index and pathological changes of the myocardium were determined. The expression of microRNA-21 in the myocardium of the rats was detected by qRT-PCR. Neonatal cardiomyocytes were culturedinvitro, labeled with BrdU and transferred with lenti-microRNA-21 by DNA transfection. The heart failure rats in the cold environment were randomly divided into 3 groups: the rats in group I were transplanted with lenti-microRNA-21-transfected neonatal cardiomyocytes, the rats in group II were transplanted with untransfected cardiomyocytes and the rats in group III were transplanted with culture medium into the failure myocardium. The echocardiography was applied to evaluate the heart functions. The rats were then executed and the hearts were harvested for histological (HE staining) and immunohistological (anti-BrdU staining) examinations.RESULTSThe cardiac functions of the heart failure rats in the cold environment (group d) were significantly worse than those in the normal environment (group c). The cardiac functions in group c were significantly worse than those in the normal rats in the normal environment (group a). No obvious difference of the cardiac functions between group a and group b (the normal rats in the cold environment) was observed. The apoptotic index of the myocardium in group d was significantly higher than that in group c, and that in group c was significantly higher than that in group a. No obvious difference of the apoptotic index of myocardium between group a and group b was found. The expression level of microRNA-21 in the myocardium in group c was significantly lower than that in group a, that in group d was lower than that in group c, and that in group b was also lower than that in group A. The expression of microRNA-21 in the transfected groups was higher than that in untransfected groups. Improvement of ejection fraction (EF) in group I and group II was greater than that in group III. The transplanted cardiomyocytes survived in the failure myocardium. The pathological changes of the myocardium in group I and group II were improved as compared with those in group III. The cardiac functions and pathological improvement in the myocardium were better in group I than those in group II.CONCLUSIONTransplantation of microRNA-21-transfected cardiomyocytes into the myocardium of heart failure rats under the low-temperature condition improves the cardiac functions and relieves the pathological changes.
Heart failure; Cardiomyocytes; MicroRNA-21; Transplantation
R363
A
10.3969/j.issn.1000-4718.2013.01.001
1000-4718(2013)01-0001-08
2012-03-27
2012-10-29
国家科技支撑计划(No.2008BAI68BA02)
△通讯作者 Tel: 0791-88692501; E-mail:wmh666888@sina.com

