原核表达和制备EB 病毒GST/BFRF3融合蛋白用于鼻咽癌的诊断筛查*
胡 波, 陈忠城, 王东宁, 李 林△
(中山大学附属第三医院 1检验科, 2血液内科,广东 广州 510630)
·实验技术·
原核表达和制备EB 病毒GST/BFRF3融合蛋白用于鼻咽癌的诊断筛查*
胡 波1, 陈忠城1, 王东宁2, 李 林1△
(中山大学附属第三医院1检验科,2血液内科,广东 广州 510630)
目的构建表达EB病毒衣壳抗原BFRF3基因的原核细胞表达载体并探讨其在鼻咽癌血清学诊断中的应用。方法以EB病毒 DNA为模版,采用PCR法扩增目的基因BFRF3,与原核表达载体PGEX-5X-1连接,构建PGEX-5X- BFRF3重组质粒,转化大肠杆菌BL21(DE3),IPTG诱导表达GST/BFRF3融合蛋白。表达产物经SDS-PAGE和免疫印迹法鉴定后,纯化目的蛋白作为包被抗原,制备ELISA试剂检测鼻咽癌患者和正常人群BFRF3-IgA抗体。结果在大肠杆菌中成功地表达了GST/BFRF3融合蛋白,相对分子质量为44 kD,免疫印迹证实目的蛋白带有免疫原性,目的蛋白经纯化后作为包被抗原检测鼻咽癌患者的灵敏度和特异度分别为65%和87%。结论采用原核表达系统成功构建并表达了GST/BFRF3融合蛋白,其在鼻咽癌血清筛选中具有诊断价值。
鼻咽肿瘤; EB病毒衣壳抗原; 原核表达
EB病毒(Epstein-Barr virus,EBV)为双链DNA病毒,与鼻咽癌(nasopharyngeal carcinoma,NPC) 关系密切。广东省为NPC高发区,发病率居世界首位,NPC的早期诊断和治疗是提高患者生存率、改善生存质量的重要手段之一。NPC的早期症状不明显,原发部位隐蔽不易发现,明显症状直到疾病晚期才被认识,确诊往往因此而受到延误,从而令病人错过最佳治疗时机。研究证明绝大多数NPC患者癌细胞中均存在着EBV基因组成分,NPC患者血清中具有针对多种EB病毒抗原的抗体谱,其中包括病毒衣壳抗原(viral capsid antigen,VCA)、早期抗原(early antigen,EA)和EB病毒核抗原1(Epstein-Barr virus nuclear antigen1,EBNA1)等,且针对这些抗原的特异性抗体效价的升高常发生在临床发现肿瘤之前。因此在NPC高发区人群进行该类抗体普查对于NPC的早期诊断、抗肿瘤治疗进程的监控以及流行病学调查有着重要的意义[1-3]。
EBV VCA是重要诊断抗原,其IgA抗体出现在大多数NPC病人和NPC易患者的血清内,检测血清中VCA-IgA抗体在NPC的早期诊断上意义重大。但VCA蛋白复合物成份复杂,至少由30种不同的蛋白组成,在体外很难对VCA家族的蛋白水平和抗原数量进行完全定义,针对NPC病人VCA-IgA抗体的相关靶抗原分子仍无法充分定位[4]。为及时而准确地对NPC患者进行早期诊断和治疗,利用DNA重组技术寻找理想的基因工程EBV VCA抗原用于制备诊断试剂,已成为亟待解决的问题。p18是VCA的主要抗原多肽之一,由EB病毒基因组中BFRF3基因编码。本实验室曾在酵母中分泌表达了BFRF3重组蛋白[5],当用发酵罐进行大批量发酵时,表达的BFRF3重组蛋白活性与产率却均过低。本研究采用原核表达系统,将VCA中的BFRF3基因与原核表达载体PGEX-5X-1连接,构建PGEX-5X-BFRF3原核表达质粒,在大肠杆菌BL21(DE3)中表达GST/BFRF3重组融合蛋白,并将其作为包被抗原,制备ELISA试剂对NPC 病人和健康对照人群进行检测,分析其灵敏度和特异度,探讨BFRF3重组融合蛋白在NPC免疫检测中的应用及意义,期望能够得到有价值的大量表达BFRF3重组蛋白的PGEX-5X-BFRF3原核表达菌株。
材 料 和 方 法
1材料
1.1标本来源 300份病理确诊为NPC患者的血清样本来自中山大学附属肿瘤医院和江苏省肿瘤医院。男性221例,女性79例,平均年龄(45±25)岁,均为首次发现,未经治疗。500份健康对照组标本来自中山大学附属第三医院健康体检者,男性372例,女性128例,平均年龄(43±22)岁(采集时间2003~2005年)。372份EB病毒 PCR阳性或阴性的血清[阳性75份,阴性297份,平均年龄(42±20)岁,采集时间2005年]来自南方医科大学附属南方医院及附属珠江医院,EB病毒 PCR定量检测试剂盒购自中山大学达安基因有限公司, PCR仪为Roche LightCycler及BioRad MJ Option II型;单纯疱疹病毒抗体检测试剂盒检出的IgM、IgG阳性标本21份、巨细胞病毒IgM、IgG检测试剂盒检出的阳性标本27份均来自中山大学附属第三医院门诊患者,试剂购自ZENS SCIENTIFIC INC。
1.2病毒DNA模板、质粒与关键试剂 EB病毒转化的淋巴瘤细胞株B95-8细胞购自中山大学基础医学院,大肠杆菌JM109用于所有质粒扩增,原核表达载体pGEX-5X-1、E.coliBL21(DE3)和GST·BindTMKits 购自Novagen。病毒DNA抽提试剂盒购自上海生物工程公司。DNA回收及纯化试剂盒QIAquick Gel Extraction Kit购自Qiagen。所有内切酶及T4 DNA连接酶均购自New England Biolabs。EBV VCA-IgA抗体检测试剂盒购自北京贝尔生物工程有限公司。
2方法
2.1重组质粒的构建及鉴定 EBV DNA的提取参照文献[5],以EBV DNA为模板扩增BFRF3基因(531 bp),扩增引物由上海博亚公司合成,引物序列如下:上游引物5’-GGAATTCATGGCACGCCGGCTGCC-3’,下游引物5’-CGGCGGCCGCTTACTGTTTCTTACGTGCCCCGCGT-3’。PCR 产物经琼脂糖凝胶电泳纯化回收后,定向克隆到原核表达载体pGEX-5X-1中,转化E.coliBL21(DE3) 感受态细胞,在含氨苄青霉素的LB 平板上筛选阳性克隆,提取质粒DNA,双酶切电泳及DNA 序列分析鉴定重组质粒pGEX-5X-BFRF3。
2.2BFRF3重组蛋白的诱导表达 挑选构建成功的重组质粒pGEX-5X-BFRF3和空质粒pGEX-5X-1转化E.coliBL21(DE3)感受态细胞,37 ℃培养过夜后,分别挑取重组载体和空载体的单克隆菌落接种于5 mL含氨苄青霉素的LB培养基中,37 ℃培养过夜。各取上述过夜菌100 μL转接入10 mL含氨苄青霉素的新鲜LB中,37 ℃振荡培养至A600为0.5时,加入IPTG至终浓度为0.6 mmol/L,35 ℃诱导培养4 h,离心去上清,收集培养物。菌体重悬于8倍于菌体总量的PBS缓冲液中,冰浴条件下超声破菌,加入Triton X-100至1%,抑肽酶至1 mg/L,DNase I(终浓度为10 mg/L),室温放置30 min,作用至菌液不再黏稠,SDS-PAGE和薄层蛋白扫描定量分析目的蛋白表达。
2.3筛选IPTG 诱导目的蛋白表达的最佳浓度和时间 将阳性转化菌培养物分装于5支试管中,加入不同浓度(1.0 mmol/L、0.8 mmol/L、0.6 mmol/L、0.4 mmol/L和0.2 mmol/L) 的IPTG 诱导目的蛋白表达,在诱导表达4 h 时,分别收集样本,超声破菌后收集细胞裂解液,采用ELISA 法对目的蛋白进行分析。选取IPTG 的最佳诱导浓度,分别于诱导后1 h、2 h、3 h、4 h和5 h收集样本,超声破菌后,再用ELISA 法测定目的蛋白的效价,以确定最佳诱导时间。
2.4重组BFRF3蛋白的鉴定 取步骤2.2项所得样品,经SDS-PAGE电泳后转染PVDF膜,加入兔抗GST多克隆抗体(1∶1 000稀释),然后加入HRP标记的羊抗兔Ⅱ抗(1∶2 000稀释),进行Western blotting检测。
2.5重组BFRF3蛋白的纯化 收集IPTG诱导表达后的pGEX-5X-BFRF3阳性转化菌的培养物,超声破菌后,弃上清。沉淀用8 mol/L尿素变性,待沉淀充分溶解后,4 ℃、12 000 r/min离心15 min,弃去沉淀,梯度稀释复性,使用GST·BindTMKits,过GST柱层析纯化融合蛋白,收集样品用SDS-PAGE和ELISA检测蛋白活性和纯度。
2.6VCA-IgA抗体的检测 稀释纯化的BFRF3重组蛋白,每孔100 ng∶100 μL包被聚丙乙烯反应板,PBS封闭。HRP标记的羊抗人IgA Fab段作为探针,用间接ELISA法检测NPC患者和健康体检标本的血清BFRF3-IgA水平,四甲基联苯胺为底物,450 nm波长处测定吸光度(A)。固相抗原及酶标记物的最佳工作浓度用方阵滴定确定。通过ROC曲线确定临界值(cut-off值)。灵敏度为NPC患者标本中的阳性检出率,特异度为健康对照组中的阴性检出率。相同标本同时用北京贝尔生物工程有限公司 EBV VCA-IgA抗体检测试剂盒进行检测。
2.7特异度评价 EB病毒PCR检测阳性或阴性血清、单纯疱疹病毒I型、II型IgM、IgG抗体阳性血清、巨细胞病毒IgM、IgG抗体阳性血清分别用上述BFRF3重组蛋白制备的EBV VCA-IgA抗体检测试剂进行检测。
3统计学处理
统计分析用SPSS 12.0软件。数据以均数±标准差(mean±SD)表示。各组间计数资料的比较采用2检验。以P<0.05为差异有统计学意义。
结 果
1PCR扩增BFRF3基因
以质粒EBV DNA为模板扩增BFRF3基因,PCR产物经琼脂糖电泳鉴定,在531 bp处可见到清晰条带,与理论上BFRF3基因的大小完全符合,见图1。
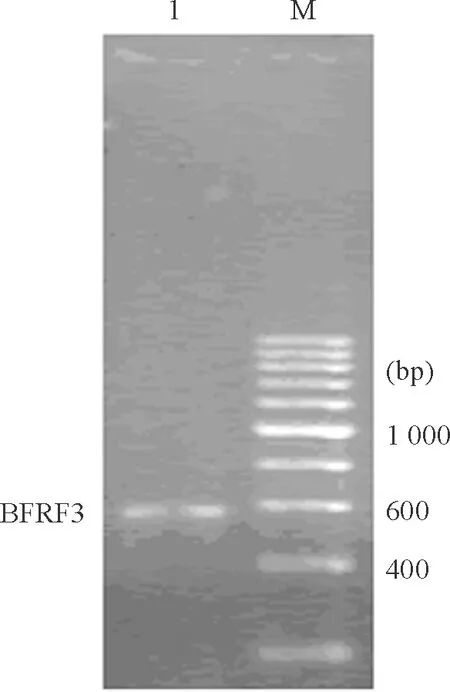
Figure 1. PCR amplication ofBFRF3 gene. 1: PCR product ofBFRF3 gene (531 bp); M: DGL2000 DNA marker.
图1PCR扩增BFRF3基因
2pGEX-5X-BFRF3载体构建和蛋白表达
BFRF3经PCR扩增后,插入载体pGEX-5X-1的相应位点,得到重组质粒pGEX-5X- BFRF3,经序列分析及双酶切鉴定表明,BFRF3基因序列正确,基因插入方向无误,见图2。
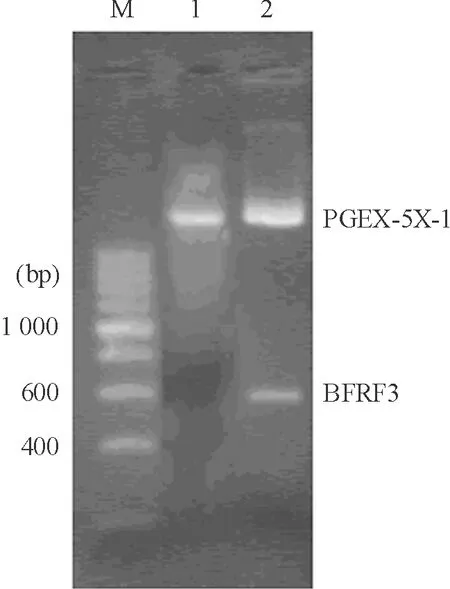
Figure 2. Double digestion of recombinant plasmid PGEX-5X-BFRF3 byEcoR I andNotI. M:DGL2000 DNA marker;1:double digestion of PGEX-5X-1 plasmid byEcoR I+NotI; 2:double digestion of recombinant plasmid PGEX-5X-BFRF3 byEcoR I+NotI.
图2重组质粒PGEX-5X-BFRF3的双酶切分析
含空质粒pGEX-5X-1与含重组质粒PGEX-5X-BFRF3的工程菌株BL21(DE3),在对数生长期,即A600约为0.5时,0.6 mmol/L IPTG诱导4 h后,进行SDA-PAGE分析结果表明,含PGEX-5X-BFRF3重组质粒的菌株诱导后在分子量约44 kD处有明显的蛋白表达带,与预测的GST/BFRF3融合蛋白的相对分子质量相符,表达水平约占总蛋白的30%, 见图3。而含空质粒菌株诱导后在分子量约26 kD处有明显的蛋白表达带,与理论上的GST相对分子质量相符。诱导重组蛋白表达的诱导剂 IPTG 最佳浓度为0.6 mmol/L,最佳诱导时间为4 h,ELISA检测效价为1∶25 600。
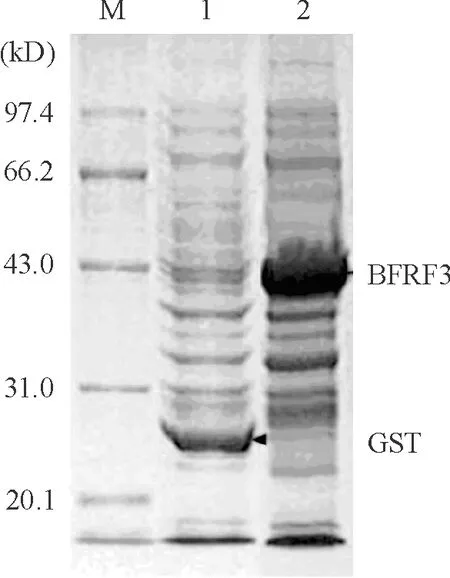
Figure 3. SDS-PAGE analysis of recombinant protein. M: low molecular weight protein marker; 1: the total protein of induced PGEX-5X-1/BL21(DE3);2: the total protein of induced PGEX-5X-BFRF3/BL21(DE3).
图3重组蛋白的SDS-PAGE分析
3重组GST/BFRF3融合蛋白的鉴定
将诱导表达的菌株总蛋白经SDS-PAGE电泳后,电转移到PVDF膜上进行Western blotting分析,以抗GST的多克隆抗体为Ⅰ抗,结果显示重组质粒PGEX-5X-BFRF3转化菌在44 kD处出现一特异性的反应条带,与预测的GST/BFRF3融合重组蛋白的相对分子质量相符,空质粒转化菌则在26 kD处出现一特异性的反应条带,见图4。
4重组GST/BFRF3融合蛋白的纯化
SDS-PAGE考马斯亮蓝染色可见经包涵体洗涤、复性,GST亲和层析柱纯化后的PGEX-5X-BFRF3重组蛋白带,相对分子质量为44 kD,纯度达90%,见图5。将纯化后的抗原倍比稀释后包被聚丙乙烯板条,以EBV阳性和阴性血清为标准,检测GST/BFRF3重组融合蛋白的效价,发现GST/BFRF3重组融合蛋白的效价为1∶51 200。
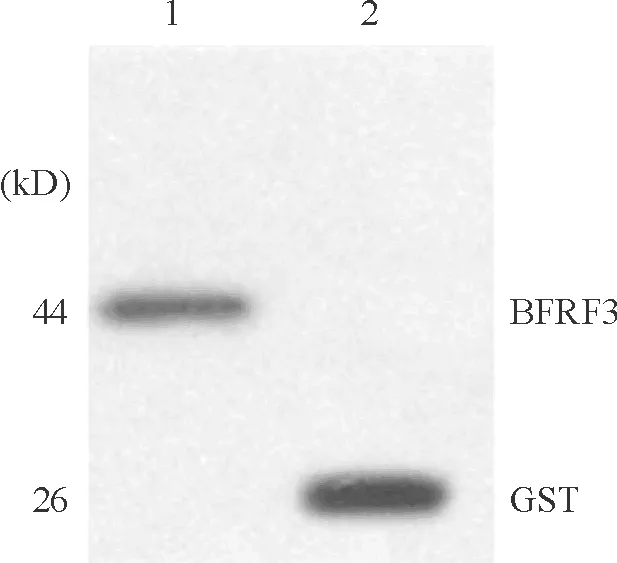
Figure 4. Western blotting analysis of recombinant protein identified by GST polyclonal antibody.1. the total protein of induced PGEX-5X-BFRF3/BL21(DE3);2. The total protein of induced PGEX-5X-1/BL21(DE3).
图4重组蛋白的Westernblotting分析
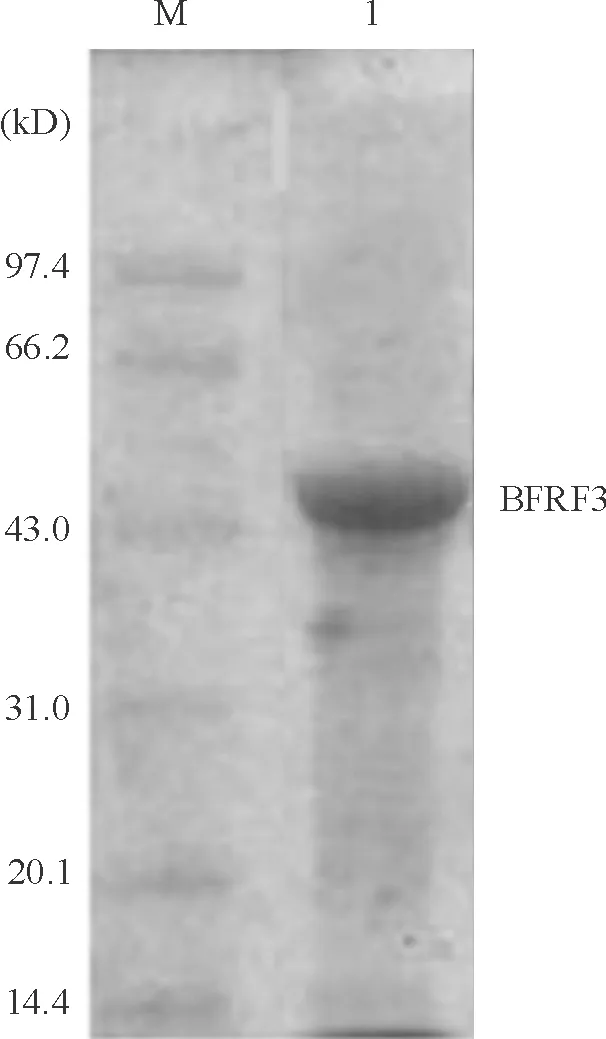
Figure 5. The purified recombinant protein detected by 12% SDS-PAGE. M: low molecular weight protein mar-ker; 1:the purified PGEX-5X-BFRF3/BL21(DE3) recombinant protein.
图5纯化重组蛋白的SDS-PAGE分析
5BFRF3-IgA的检测
用纯化后的GST/BFRF3蛋白作为包被抗原分别对鼻咽癌患者及健康体检标本进行检测,结果如表1(通过ROC曲线确定其cut-off值),在NPC患者和健康对照中,阳性率分别为65%和13%。北京贝尔生物工程有限公司 EBV VCA-IgA抗体检测试剂盒检测相同组别的NPC患者和健康对照,阳性率分别为64%和10%,与GST/BFRF3-IgA的检测差异无统计学意义(P>0.05),见表1。
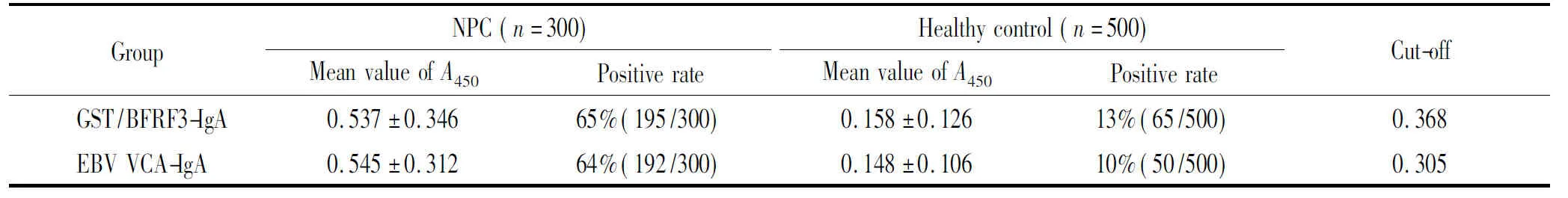
表1 GST/BFRF3-IgA和EBV VCA-IgA 试剂盒检测NPC患者和健康人群结果的比较
6特异度评价
用BFRF3重组蛋白制备的IgA抗体试剂检测297份EBV PCR阴性标本未出现阳性结果;在75份EBV PCR阳性标本中,有20份BFRF3-IgA检测阳性。阳性结果均出现在EBV PCR 阳性的标本中,抗体检测相对于核酸检测的特异度为100%。单纯疱疹病毒I型、II型IgM、IgG抗体阳性血清21份中,BFRF3-IgA检测未出现阳性;巨细胞病毒IgM、IgG抗体阳性血清27份中,BFRF3-IgA检测也未见阳性。
讨 论
NPC在我国是一种常见的头颈部恶性肿瘤,EBV感染与NPC的发生发展密切相关。NPC的显著特征是病人血清中的EBV VCA抗体(尤其是IgAs亚型)水平普遍升高,借此可区分NPC和健康携带者。这种血清学变化在NPC发病前期将先于症状出现,因此,EBV VCA-IgA抗体的检测可用于NPC的早期诊断和流行病学调查。目前国内外EBV的血清学检测采用免疫荧光法、免疫酶法和酶联免疫吸附分析法等[6-8]。免疫荧光法因操作繁琐、特异性差且需特殊仪器,已被逐渐淘汰;免疫酶法涂片细胞表达抗原因载量不稳定、阳性细胞计数受主观因素影响等缺点,使得试剂的批间差异大,不同检验人员得出的结果也存在较大差异。因此人们试图以ELISA方法取代免疫荧光法和免疫酶法用于大规模血清流行病学调查,但受抗原来源和纯化方法的限制,无法获得足够的抗原用以大规模筛查,因此有必要利用DNA重组技术在不同表达系统中高效表达EBV相关抗原制备诊断试剂[9]。
VCA是NPC的重要诊断抗原,由病毒核衣壳和完整病毒颗粒包膜的多肽组成。p18是VCA的主要抗原多肽之一,由EBV基因组中BFRF3基因编码,有极强的免疫原性,是检测EBV VCA 相关抗体的主要抗原。本研究采用原核表达系统构建表达BFRF3基因并对其在NPC免疫检测中的意义进行分析,希望能得到一个针对NPC患者VCA 特异性抗体的良好抗原。
大肠杆菌表达系统已成为外源基因的首选表达系统[10-11],它具有遗传背景清楚、成本低廉、高生产率、操作简单、容易培养等优点。近年来出现的重组大肠杆菌的高密度发酵技术,不仅可以提高菌体的发酵密度,减少培养体积还可以缩短生产周期、降低生产成本,从而极大地提高了大肠杆菌表达系统在生产基因工程产品市场上的竞争力。本研究采用原核表达载体PGEX-5X-1对目的蛋白进行表达,由于PGEX-5X-1带有GST纯化标签,所表达的融合蛋白产物可通过GST层析柱快速、简便地纯化,也可以通过凝血酶、x因子等切割后快速释放,为生产高纯度高活性的基因工程产品创造了有利条件。
BFRF3片段与其它单纯疱疹病毒没有同源性,其主要表位集中在BFRF3第119~176氨基酸区域内,在NPC病人的诊断和监控中具有一定价值。我们在大肠杆菌中表达了BFRF3全长片段,所获得的GST/BFRF3融合蛋白主要以不溶性包涵体形式存在。通过洗涤包涵体、变性溶解、复性、GST亲和层析等过程,得到了纯度达90%以上的重组融合蛋白。GST/BFRF3融合蛋白的相对分子量为44 kD,Western blotting证实该蛋白有免疫原性,ELISA检测的效价显示了表达产物与NPC病人血清间具有良好的免疫反应性。将经GST亲和层析柱纯化后的GST/BFRF3重组蛋白,包被聚丙乙烯反应板,与辣根过氧化物酶标记的抗人IgA抗体配对,制备ELISA试剂,对NPC的病人和健康人群EBV IgA抗体进行检测,发现在NPC病人中,阳性率为65%,与van Grunsven等[12]对香港NPC人群的研究结果相似(61%)。同时与北京贝尔生物工程有限公司EBV VCA-IgA抗体检测试剂盒相比,其对NPC检测的相对灵敏度及特异度二者无显著差异。本研究在大肠杆菌中成功表达了GST/BFRF3融合蛋白,与本实验室前期使用酵母系统表达的BFRF3重组蛋白在NPC人群中的阳性率(71%)无明显差异,由于前期研究中酵母表达的BFRF3重组蛋白在转为发酵罐进行大量培养时,表达的BFRF3重组蛋白活性与产率却均过低,所以我们期望使用重组大肠杆菌的高密度发酵技术能够大量制备有活性的GST/BFRF3重组蛋白。GST/BFRF3重组蛋白在NPC中的阳性检出率为65%,仍无法满足筛选所有NPC患者的需要,目前尚未发现任何单个血清学标志物可以用来诊断所有的NPC患者。可能对于EBV基因重组抗原来说,需要将不同抗原进行联合检测,才能提高NPC早期诊断的灵敏度和特异度。但具体需与哪种抗原片段进行联合检测,还有待于进一步探讨。
本实验用EB病毒PCR阳性和阴性血清、同属疱疹病毒科的单纯疱疹病毒抗体阳性标本及巨细胞病毒抗体阳性标本对BFRF3作为检测抗原的特异度进行评价,阳性结果均出现在EB病毒PCR阳性血清中,在EBV PCR阴性标本、单纯疱疹病毒抗体阳性标本和巨细胞病毒抗体阳性标本中均未出现阳性,证明BFRF3用于EBV IgA抗体检测时,具有较高的特异度。
总之,本研究采用原核系统成功构建表达了GST/BFRF3重组融合蛋白,并对其在NPC血清学中的诊断价值进行了初步评估,表明BFRF3重组蛋白可以有效地用于NPC患者相关抗体的检测,为寻找理想的基因工程EBV抗原用于制备NPC诊断试剂奠定了基础。
[1] Wong M, Lye M, Cheng H, et al. Epstein-Barr virus serology in the diagnosis of nasopharyngeal carcinoma[J]. Asian Pac J Allergy Immunol, 2005, 23(1): 65-67.
[2] Fachiroh J, Schouten T, Hariwiyanto B, et al. Molecular diversity of Epstein-Barr virus IgG and IgA antibody responses in nasopharyngeal carcinoma: a comparison of Indonesian, Chinese, and European subjects[J]. J Infect Dis, 2004, 190(1): 53-62.
[3] 尹志华,蒋卫红, 李 峰,等. 鼻咽癌组织中EB病毒潜伏相关基因的表达[J]. 中国病理生理杂志,2007, 23(12): 2374- 2378.
[4] Nystad T, Myrmel H. Prevalence of primary versus reactivated Epstein-Barr virus infection in patients with VCA IgG-, VCA IgM- and EBNA-1-antibodies and suspected infectious mononucleosis[J]. J Clin Virol, 2007, 38(4): 292-297.
[5] 胡 波,李朝霞,盛 平,等. EB病毒VCA基因片段在毕赤酵母中的表达及临床应用[J]. 中华微生物学和免疫学杂志,2010,30(4):365-370.
[6] Cheng W,Chan K, Chen H,et al. Assessing the risk of nasopharyngeal carcinoma on the basis of EBV antibody spectrum[J]. Int J Cancer, 2002,97(4): 489-492.
[7] Karray H, Ayadi W, Fki L, et al. Comparison of three different serological techniques for primary diagnosis and monitoring of nasopharyngeal carcinoma in two age groups from Tunisia[J]. J Med Virol, 2005, 75(4): 593-602.
[8] Hsu M, Hsu W, Sheen T, et al. Specific IgA antibodies to recombinant early and nuclear antigens of Epstein-Barr virus in nasopharyngeal carcinoma[J]. Clin Otolaryngol Allied Sci, 2001, 26(4): 334-338.
[9] Hu B, Hong G, Li Z, et al. Expression of VCA (viral capsid antigen) and EBNA1 (Epstein-Barr-virus-encoded nuclear antigen 1) genes of Epstein-Barr virus inPichiapastorisand application of the products in a screening test for patients with nasopharyngeal carcinoma[J]. Biotechnol Appl Biochem, 2007, 47(Pt 1):59-69.
[10] 付涌水, 江朝富, 李树浓, 等. 抗- D 抗体Fab 段基因的克隆及其在大肠杆菌中的表达[J].中国病理生理杂志,2006, 22(1):152-155.
[11] 杨文理, 陈守春, 陈毅荣. 人自剪切TRAIL胞外段融合蛋白表达条件的优化[J].中国病理生理杂志,2010, 26(6): 1237-1239,1248.
[12] van Grunsven WM, Spaan WJ, Middeldorp JM. Localization and diagnostic application of immunodominant domains of the BFRF3-encoded Epstein-Barr virus capsid protein[J]. J Infect Dis, 1994,170(1): 13-19.
ProkaryoticexpressionandpreparationofGST/BFRF3fusionproteinofEpstein-Barrvirusforscreeningnasopharyngealcarcinomas
HU Bo1, CHEN Zhong-cheng1, WANG Dong-ning2, LI Lin1
(1DepartmentofLaboratoryMedicine,2DepartmentofHematology,TheThirdAffiliatedHospitalofSunYat-senUniversity,Guangzhou510630,China.E-mail:lilin5786@263.net)
AIM: To construct a prokaryotic expression plasmid containing Epstein-Barr viral (EBV) capsid antigenBFRF3 gene and to observe the application of recombinant BFRF3 protein in the serological diagnosis of nasopharyngeal carcinoma (NPC).METHODSDNA extracted from the B95-8 cells was used as the templates. Polymerase chain reaction (PCR) was used to generate a DNA fragment ofBFRF3 gene, and a 531-bp DNA fragment was inserted into a PGEX-5X-1 vector. The recombinant plasmid was transformed intoE.coliBL21 (DE3). The expression of GST/BFRF3 fusion protein was induced by IPTG, identified by both SDS-PAGE and Western blotting, and then purified by glutathione-sepharose beads. The purified recombinant protein was coated to microplate for ELISA detection of EBV-IgA antibody in NPC patients.RESULTSThe GST/BFRF3 fusion protein was successfully expressed inE.coli. The molecular weight of the product was approximately 44 kD. The recombinant fusion protein GST/BFRF3 showed good immunoreactivity. A novel ELISA was established using GST/BFRF3 protein. Serum samples collected from the NPC patients and healthy controls were tested by this ELISA. The sensitivity and specificity of GST/BFRF3 tests for NPC patients were 65% and 87%, respectively.CONCLUSIONThe recombinant protein GST/BFRF3 is expressed inE.coli, and it has diagnostic value for screening of NPC patients.
Nasopharyngeal neoplasms; Epstein-Barr viral capsid antigen; Prokaryotic expression
R365
A
10.3969/j.issn.1000- 4718.2013.06.033
1000- 4718(2013)06- 1147- 06
2013- 01- 24
2013- 05- 09
教育部第44批留学回国人员科研启动基金[教外司留(2012)940]
△通讯作者 Tel: 020-85252885; E-mail: lilin5786@263.net

