TRPM2通道在星形胶质细胞氨中毒中的作用*
陈 赛, 蔡诗达, 张 楚, 邓 琳, 赵 阳, 于德钦, 刘海旺, 张友才, 李树壮
(大连医科大学生理学教研室,辽宁 大连 116044)
TRPM2通道在星形胶质细胞氨中毒中的作用*
陈 赛, 蔡诗达, 张 楚, 邓 琳, 赵 阳, 于德钦, 刘海旺, 张友才, 李树壮1△
(大连医科大学生理学教研室,辽宁 大连 116044)
目的通过建立星形胶质细胞氨中毒的模型,探讨瞬时受体电位M2 (TRPM2)阳离子通道在其中发挥的作用。方法分离并培养小鼠原代星形胶质细胞。实验分为5组:对照组、氯化铵处理组、氯化铵+3-氨基苯甲酰胺 (3-AB)处理组、氯化铵+PJ-34 处理组和TRPM2基因敲除小鼠+氧化铵处理组。测定细胞的活性、caspase-3 活性、细胞坏死和体积大小,以此来衡量氨中毒的程度。用全细胞膜片钳记录TRPM2通道电流变化。结果氯化铵引起细胞肿胀伴随着细胞坏死。聚腺苷二磷酸核糖聚合酶(PARP)抑制剂3-AB和PJ-34抑制了氯化铵引起的阳离子电流,并减轻了氯化铵引起的相应细胞伤害。TRPM2基因敲除小鼠组细胞的伤害明显减轻(P<0.01)。结论TRMP2通道的激活是细胞暴露于氯化铵后发生肿胀、坏死的必要步骤;氯化铵诱导的星形胶质细胞肿胀与坏死密切相关。
瞬时受体电位M2阳离子通道;星形细胞;聚腺苷二磷酸核糖聚合酶
星形胶质细胞肿胀和脑水肿引起的颅内压增高是急性肝衰竭(acute liver failure, ALF)的并发症之一[1]。已有很多体内和体外实验表明,高血氨均可导致星形胶质细胞肿胀。有研究证实,氨可通过激活p38信号途径引起星形胶质细胞水肿[2],但尚不能解释氨中毒引起星形胶质细胞水肿的所有机制。谷氨酰胺是氨解毒过程中生成的,尽管已有研究表明脑水肿的进展依赖于星形胶质细胞中谷氨酰胺的聚集,但Jayakumar等[3]的研究表明,谷氨酰胺的聚集引起细胞产生大量活性氧,继而引起细胞肿胀,并非谷氨酰胺的聚集引起细胞内渗透压增高而导致细胞肿胀。因此,活性氧造成星形胶质细胞肿胀并死亡的机制尚不明确。
瞬时受体电位M2(transient receptor potential melastatin 2,TRPM2)阳离子通道是近年来研究的热点之一。它起初曾被命名为TRPC7 和 LTRPC2,属于非选择性阳离子热敏通道,在大量免疫细胞内均有表达[4]。它可允许钠、钾和钙离子通过,且可被腺苷二磷酸核糖和过氧化氢激活[5]。此外,激活的TRPM2通道还可介导氧化应激反应引起的细胞死亡[6]。既然TRPM2通道的激活能引起钠和钙离子超载,那么TRPM2通道也可能参与氨诱导的星形胶质细胞肿胀的过程。通过本实验,我们探讨TRPM2通道在氨中毒诱导的星形胶质细胞肿胀中所起到的作用。
材 料 和 方 法
1细胞及培养
原代星形胶质细胞分离自出生2~3 d后的C57BL/6小鼠和C57BL/6种系中TRPM2基因敲除(knockout,KO)小鼠的大脑皮质(由大连医科大学动物实验中心和日本国立自然科学研究机构提供)。取材过程如下,麻醉新生小鼠后,取其大脑皮质在冰冷的Leibovitz’s L-15培养液(Invitrogen)中剪碎。然后将其放入富含木瓜蛋白酶(1×104U/L; Worthington Biochemical)的Earle’s平衡盐溶液中,置于37 ℃恒温环境下消化30 min。用70 μm尼龙滤器过滤细胞,然后以2.5×105cells/cm2的密度植入培养瓶。细胞培养参照文献[7]:将DMEM细胞培养基置于CO2浓度为5% 的潮湿空气中培养细胞,并加入10% FBS、4×104U/L青霉素、0.1 g/L链霉素和1.5 g/L NaHCO3。每2~3 d更换培养液。对培养瓶中细胞作传代培养并在2~3周内利用。某些实验中,细胞在使用前需转移到96孔板或包被聚乙烯亚胺的盖玻片上培养1~2 d。
2方法
2.1细胞活性的鉴定 参照文献[8],用MTT比色分析法确定细胞活性 (Cell Counting Kit-8; Dojindo)。使用caspase-3、-7试剂盒(Apo-ONE Homogeneous Caspase-3/7 Assay; Promega)检测caspase-3、-7的活性,评估细胞凋亡程度;采用具有数码相机的倒置IX71显微镜来观察用Hoechst 33342(2 mg/L)和碘化丙啶(PI; 5 mg/L)双重染色的细胞,进而评估细胞坏死及细胞凋亡。
2.2细胞体积的测量 室温下通过CDA-500颗粒分析仪(Sysmex)测量平均细胞体积。将仪器用已知体积的乳胶微球校准后,细胞群的平均体积可通过测量细胞体积分布计算得出。
2.3膜片钳实验 在室温下进行全细胞膜片钳记录。膜片电极由硼硅玻璃毛坯管通过P-2000激光微电极拉引器(Sutter Instrument)拉制而成,当管内充满细胞内液时会产生2~4 MΩ的电阻。用Axopatch 200B膜片钳放大器做记录(Molecular Devices);同时用pCLAMP 9.2软件(Molecular Devices)控制数据的采集与分析。串联电阻<5 MΩ。给予控制电压为0 mV持续时间为2 s的 ±60 mV的交变阶梯脉冲,监控电流激活和恢复的时程,每15 s重复运用1次。使用预电压0 mV持续时间为600 ms、增量为20 mV、测试电压±100 mV的阶梯脉冲,观察电流分布的电压相关性。标准的细胞外液成分(mmol/L)为:140 NaCl, 4 KCl, 2 MgCl2, 1 CaCl2, 5葡萄糖, 10 TEA-Cl, 10 HEPES (pH 7.4, 305 mosmol/kg H2O)。 如果实验需要避免Na+的干扰,可用N-甲基-D-葡萄糖胺氯化物[N-methyl-D-glucamine (NMDG)-Cl]取代NaCl。细胞内液的成分(mmol/L)为:140 CsOH, 140葡萄糖酸, 8 NaCl, 2 MgCl2, 3 Na2ATP, 0.15 Na2GTP, 10 HEPES (pH 7.2, 295 mosmol/kg H2O)。
2.4RT-PCR 快速解冻冷冻的星形胶质细胞。用RNeasy(Qiagen)分离出总RNA, 经过Oligotex(Qiagen)分离纯化得到Poly(A)+RNA,再通过逆转录得到单链cDNA。得到的cDNA中加入寡核苷酸(正义寡核苷酸5’-AGCGCCCGGCATCTCCTCTATC-3’,反义寡核苷酸5’-ATTGTCTGTGTTCCTTGGGTCATCC-3’),设立94 ℃ 20 s,50 ℃ 30 s,72 ℃ 2 min作为1个反应循环,共30个循环。
3统计学处理
以上实验用不同批次的星形胶质细胞重复做4~8次,数据通过单因素方差分析和Turkey两两比较法处理。数据用均数±标准差(mean±SD)表示,以P<0.05为差异有统计学意义。
结 果
1由氯化铵引起的细胞坏死需要聚腺苷二磷酸核糖聚合酶[poly(ADP-ribose)polymerase,PARP]的活化
3-氨基苯甲酰胺(3-aminobenzamide,3-AB)和PJ-34明显抑制了由氯化铵诱导的细胞肿胀(图1A)及细胞活性降低(图1B)。并且,暴露在氯化铵中PI阳性的细胞在3-AB或PJ-34存在的条件下数量有所减少,说明细胞坏死的数量下降(图2)。尽管如此,对照组细胞随着氯化铵浓度以及暴露时间的改变其caspase-3活性并无明显区别(图3)。这些结果表明PARP影响由氯化铵引起的细胞坏死,而不影响细胞凋亡。
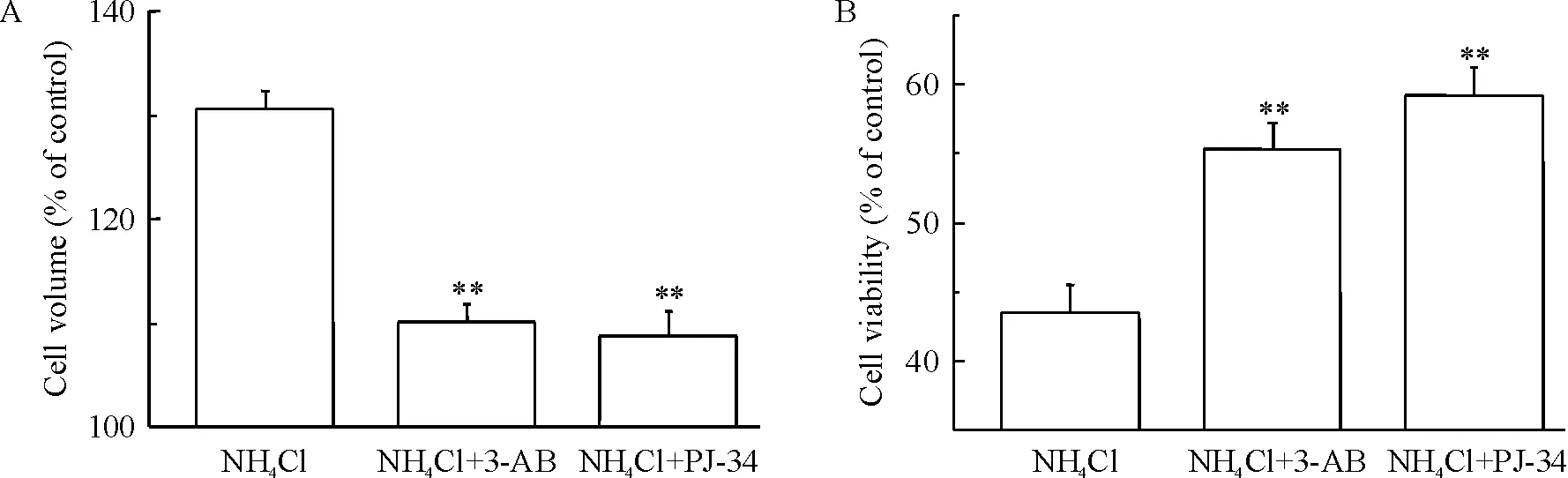
Figure 1. Both 3-AB and PJ-34 significantly inhibited NH4Cl-triggered cell death in astrocytes. A: 3-AB (100 μmol/L) and PJ-34 (1 μmol/L) attenuated NH4Cl (5 mmol/L)-induced astrocyte swelling; B: 3-AB and PJ-34 increased astrocyte viability.Mean±SD.n=4~5.**P<0.01vsNH4Cl.
图13-AB和PJ-34抑制NH4Cl引起的小鼠星形胶质细胞损害
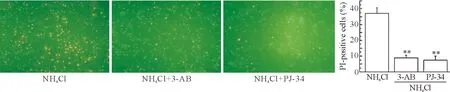
Figure 2. Both 3-AB (100 μmol/L) and PJ-34 (1 μmol/L) inhibited NH4Cl (5 mmol)-triggered necrosis of astrocytes, but not apoptosis [Hoechst 33342 (green) and propidium iodide (red) staining, ×200]. Mean±SD.n=5.**P<0.01vsNH4Cl.
图23-AB和PJ-34抑制NH4Cl引起的小鼠星形胶质细胞坏死
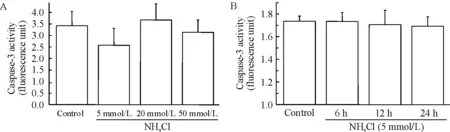
Figure 3. Caspase-3 activity was not significantly changed after exposure to NH4Cl in a time- and concentration-dependent manner. A: no marked difference of caspase-3 activity was observed in the astrocytes exposed to different concentrations of NH4Cl; B: caspase-3 activity was not significantly changed in a time-dependent manner.
图3各组caspase-3活性无明显差异
2非选择性阳离子流的触发与暴露于氯化铵后诱导的细胞肿胀有关
在没有氯化铵存在的条件下,除了一些小的基础电流,我们没有检测到其它电流。而细胞在5 mmol/L的氯化铵处理8~16 h后,一些大的宏观电流可被测到。细胞外液中用NMDG+取代Na+后,这种大电流被抑制(图4)。这表明该电流是非选择性阳离子流。有趣的是,电流在超极化电位时很快失活。
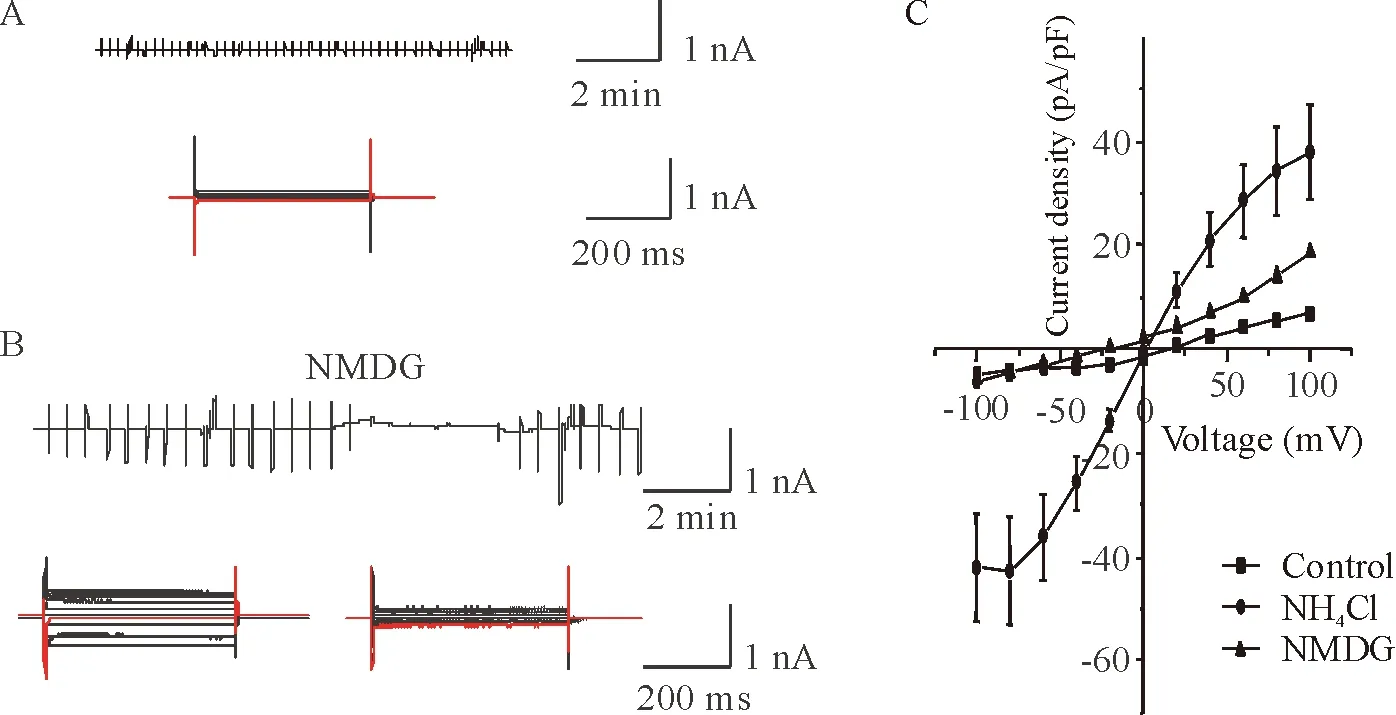
Figure 4. Representative records of whole-cell current on astrocytes. A: normal cells; B: cells treated with 5 mmol/L NH4Cl for 8~16 h (the current was inhibited by NMDG); C:I-Vrelationships for the current density in response to step pulses. Each point represents the mean data obtained from 10 different cells.
图4NH4Cl激发小鼠星形胶质细胞阳离子通道开放
氯化铵在 3-AB或PJ-34存在的条件下不能触发阳离子流(图5)。这个结果说明离子流的触发是由PARP的激活介导的,并且通过氨激活阳离子通道所致的离子内流诱导了细胞肿胀。

Figure 5. Both 3-AB and PJ-34 inhibited whole-cell current on astrocytes.A:NH4Cl (5 mmol/L)+3-AB (100 mmol/L);B: NH4Cl (5 mmol/L)+PJ-34 (1 μmol/L);C:I-Vrelationships for the current density in response to step pulses. Each point represents the mean data obtained from 10 different cells.
图53-AB和PJ-34抑制NH4Cl触发的小鼠星形胶质细胞阳离子电流
3TRPM2通道促进了由氯化铵引起的细胞坏死
氨处理星形胶质细胞后6 h、12 h、24 h,TRPM2的表达增强(图6)。这些结果表明,在星形胶质细胞中,氨会刺激TRPM2基因蛋白表达。GFAP为星形胶质细胞的内参照蛋白,CD11为小胶质细胞的内参照蛋白,βⅢ-tubulin为神经元的内参照蛋白,图6所示也说明实验组织来源于星形胶质细胞,而无小胶质细胞和神经元(这2种细胞无需刺激就表达TRPM2)的污染。
氯化铵能使野生型(wild-type,WT)小鼠的星形胶质细胞TRPM2表达增加,但不能增加KO小鼠TRPM2的表达(图7)。氯化铵在KO小鼠星形细胞中不能触发阳离子流(图8)。氯化铵不能诱导KO小鼠的星形胶质细胞肿胀(图9A),并且KO小鼠的星形胶质细胞对氯化铵中毒具有一定的抵抗能力(图9B)。KO小鼠的星形胶质细胞暴露于氯化铵后坏死数减少(图10)。这些结果都强有力地证明了TRPM2通道参与了由氯化铵引起的星形胶质细胞坏死。
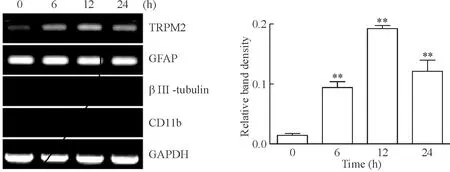
Figure 6. Up-regulation of TRPM2 mRNA in NH4Cl (5 mmol/L)-treated astrocytes. Mean±SD.**P<0.01vs0 h.
图6NH4Cl引起小鼠星形胶质细胞TRPM2表达
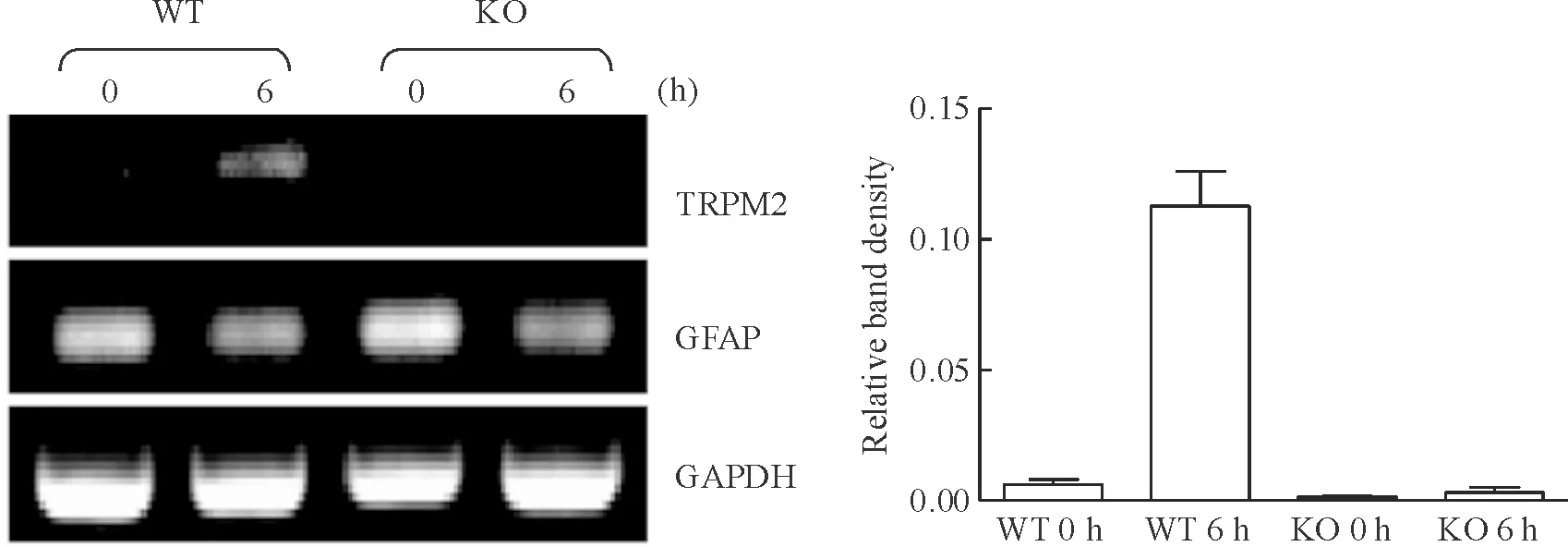
Figure 7. TRPM2 mRNA expression in wild-type (WT) andTRPM2 knockout (KO) astrocytes treated with (6 h) or without (0 h) NH4Cl (5 mmol/L).
图7WT和KO小鼠的星形胶质细胞分别在不用NH4Cl处理和用NH4Cl处理6h后,其TRPM2mRNA的表达情况
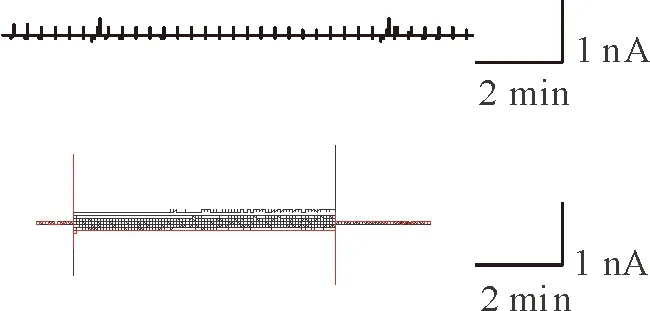
Figure 8. Representative record of whole-cell current on 5 mmol/L NH4Cl-treated astrocytes isolated fromTRPM2 KO mice.
图8TRPM2基因敲除小鼠星形胶质细胞的电流情况
讨 论
目前的研究证实,高浓度氯化铵可导致原代培养的星形胶质细胞肿胀和坏死。氯化铵引发的细胞肿胀和坏死是由PARP的活化介导的。我们发现暴露在氯化铵中的星形胶质细胞的TRPM2通道可通过PARP激活。在敲除TRPM2基因的星形胶质细胞中,氨不能引发细胞肿胀和坏死。这些结果说明TRPM2通道的激活是氨引起星形胶质细胞坏死的基础。
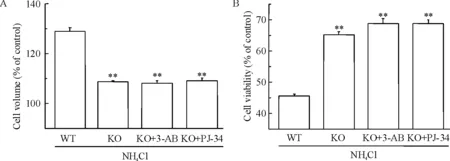
Figure 9.TRPM2 knockout eliminated NH4Cl (5 mmol/L)-induced astrocyte injury.A:TRPM2 knockout attenuated NH4Cl-induced astrocyte swelling; B:TRPM2 knockout increased astrocyte viability.Mean±SD.n=3~5.**P<0.01vsWT.
图9TRPM2基因敲除对NH4Cl引起的小鼠星形胶质细胞肿胀与活性改变的影响

Figure 10.TRPM2 knockout reduced NH4Cl (5 mmol)-induced necrosis of astrocytes [Hoechst 33342 (green) and propidium iodide (red) staining, ×200]. Mean±SD.n=3~5.**P<0.01vsWT+NH4Cl.
图10TRPM2基因敲除对NH4Cl引发的小鼠星形胶质细胞坏死的影响
氨是一种神经毒素,可造成机体的多种紊乱。谷氨酰胺合成酶可以解除星形胶质细胞的氨毒,以达到防止神经元氨中毒的目的。氨浓度上升可导致星形胶质细胞的形态学变化和细胞损伤。因此,星形胶质细胞被认为是阐明氨中毒原理的模型。目前的研究表明,氨引起的细胞死亡与caspase无关,并且细胞用氨处理后,PI染色阳性的星形胶质细胞数量有所增加。这些都表明氨造成了星形胶质细胞坏死。持续的细胞肿胀,又称为细胞坏死性体积膨胀,与细胞坏死有关[9]。通过本实验可得知星形胶质细胞暴露在氯化铵中可发生细胞肿胀,这与先前的研究结果一致,因此进一步证明了星形胶质细胞的死亡是坏死性的。
氨诱导星形胶质细胞肿胀的机制现在还不十分明确。起初认为氨解毒过程中过度积累的谷氨酰胺渗透到星形胶质细胞中导致了细胞肿胀。虽然谷氨酰胺合成酶抑制剂在防止脑肿胀和星形胶质细胞肿胀方面有效[4],然而,并没有证据表明细胞肿胀与细胞内谷氨酸盐的含量有关[5]。Jayakumar等[6]的报告称暴露在氨中的星形胶质细胞内谷氨酸盐浓度升高的速度要快于细胞肿胀发生的速度,并且在发生肿胀的星形胶质细胞中并没有观察到谷氨酸盐的积累。因此,我们重点观察其它有关谷氨酸盐代谢的反应是否与氨诱导的星形胶质细胞肿胀有关。
通过一系列的研究,我们证实了PARP抑制剂(3-AB和PJ-34)可防止星形胶质细胞的氨中毒。PARP是一种核酶。氧化应激反应可引起DNA的损伤,从而活化该酶。活化的PARP水解β-烟酰胺腺嘌呤二核苷酸(β-nicotinamide adenine dinucleotide,NAD+),并在受体蛋白上形成腺苷二磷酸核糖聚合物[10]。PARP在温和的应力条件下可以修复DNA[11]。另一方面,大量PARP会水解NAD+,从而促进细胞的死亡。此过程中NAD+的消耗与ATP的消耗同步[12]。PARP介导的细胞死亡是坏死性的[13]。因此,PARP参与了由氨引起的星形胶质细胞坏死这一过程也是理所当然的。
那么这些信号是如何诱导星形胶质细胞肿胀的呢?我们已经知道离子通道在细胞体积的调节和细胞死亡中起到了重要的作用[9]。目前的研究表明在暴露于氨的星形胶质细胞中可以观察到非选择性阳离子通道。这个通道在处于超极化电位时展现出了时间依赖性失活现象,这与 TRPM2通道的特点相似。其余的几个实验也进一步证实了氨可能触发能通过TRPM2通道的离子流。首先,由氨触发的阳离子流可被3种已知的TRPM2通道阻断剂所抑制。其次,施加 PARP抑制剂后,在暴露于氨的星形胶质细胞中不能检测出阳离子流;因为PARP抑制剂阻碍腺苷二磷酸核糖的产生,进而抑制TRPM2通道激活。再次,在缺乏TRPM2通道的星形胶质细胞内,我们观察不到氨触发的离子流。重要的是,TRPM2通道离子的功能表达与氨引发的细胞肿胀和坏死有着密切的关系。这些结果表明TRPM2通道的激活在星形胶质细胞的氨中毒方面起到关键作用。
(致谢:对日本国立自然科学研究机构生理学研究所Okada教授给于部分实验支持表示衷心感谢。)
[1] Jayakumar AR, Valdes V, Norenberg MD,et al. The Na-K-Cl cotransporter in the brain edema of acute liver failure[J]. J Hepatol, 2011,54(2):272-278.
[2] 潘彩飞,祝胜美. 异丙酚通过抑制p38激活下调氨处理的大鼠脑星形胶质细胞AQP4的表达并减轻细胞水肿[J]. 中国病理生理杂志, 2010, 26(1): 96-100.
[3] Jayakumar AR, Rao KV, Murthy CR,et al. Glutamine in the mechanism of ammonia-induced astrocyte swelling[J]. Neurochem Int,2006, 48(6-7):623-628.
[4] Kashio M, Sokabe T. Redox signal-mediated sensitization of transient receptor potential melastatin 2 (TRPM2) to temperature affects macrophage functions[J].Proc Natl Acad Sci U S A,2012,109(17):6745-6750.
[6] Yang KT, Chang WL, Yang PC, et al. Activation of the transient receptor potential M2 channel and poly(ADP-ribose) polymerase is involved in oxidative stress-induced cardiomyocyte death[J]. Cell Death Differ, 2006,13(10): 1815-1826.
[7] Liu HT, Tashmukhamedov BA, Inoue H,et al. Roles of two types of anion channels in glutamate release from mouse astrocytes under ischemic or osmotic stress[J]. Glia,2006, 54(5):343-357.
[8] Maeno E, Ishizaki Y, Kanaseki T,et al. Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis[J]. Proc Natl Acad Sci U S A, 2000,97(17): 9487-9492.
[9] Wang HY, Shimizu T, Numata T,et al. Role of acid-sensitive outwardly rectifying anion channels in acidosis-induced cell death in human epithelial cells[J]. Pflugers Arch, 2007,454(2): 223-233.
[10] D’Amours D, Desnoyers S, D’Silva I,et al. Poly(ADP-ribosyl)ation reactions in the regulation of nuclear functions[J]. Biochem J, 2009,342(Pt 2): 249-268.
[11] de Murcia G, Schreiber V, Molinete M,et al. Structure and function of poly(ADP-ribose) polymerase[J]. Mol Cell Biochem, 1994,138(1-2): 15-24.
[12] Virag L, Szabo C. The therapeutic potential of poly(ADP-ribose) polymerase inhibitors[J]. Pharmacol Rev,2002,54(3):375-429.
[13] Ha HC, Snyder SH. Poly(ADP-ribose) polymerase is a mediator of necrotic cell death by ATP depletion[J]. Proc Natl Acad Sci U S A, 1999,96(24): 13978-13982.
TRPM2channelisessentialforammoniaintoxicationinastrocytes
CHEN Sai, CAI Shi-da, ZHANG Chu,DENG Lin, ZHAO Yang, YU De-qin, LIU Hai-wang, ZHANG You-cai, LI Shu-zhuang
(DepartmentofPhysiology,DalianMedicalUniversity,Dalian116044,China.E-mail:shuzhuangli@126.com)
AIM: To study the effects of transient receptor potential melastatin 2 (TRPM2) cation channel on ammonia intoxication in astrocytes.METHODSPrimary astrocytes were isolated, cultured and divided into 5 groups: control group, ammonium chloride (NH4Cl) treatment group, NH4Cl+3-aminobenzamide (3-AB) treatment group, NH4Cl+PJ-34 treatment group, andTRPM2 knockout+NH4Cl treatment group. Cell viability, caspase-3 activity, cell necrosis and cell volume were measured to assess the extent of ammonia toxicity. Whole-cell patch-clamp was performed to record the currents via TRPM2 channels.RESULTSNH4Cl caused cell swelling accompanied with cell necrosis. The poly(ADP-ribose) polymerase (PARP) inhibitors, 3-AB and PJ-34, inhibited the cation currents activated by NH4Cl, and attenuated NH4Cl-induced cell damage. InTRPM2-deficient astrocytes, decreased cell damage was observed.CONCLUSIONTRPM2 activation is essential for cell swelling and necrosis in astrocytes exposed to NH4Cl. NH4Cl-triggered astrocyte swelling is closely correlated with necrosis.
Transient receptor potential melastatin 2 cation channel; Astrocytes; Poly(ADP-ribose) polymerase
R741.02
A
10.3969/j.issn.1000- 4718.2013.06.015
1000- 4718(2013)06- 1039- 07
2012- 05- 17
2013- 01- 17
国家自然科学基金资助项目(No.30971065);大连市科技计划项目(No.2012E12SF074);辽宁省教育厅基金资助项目(No.2009A194)
△通讯作者Tel: 0411-86110353; E-mail: shuzhuangli@126.com

