EGFR-p38 MAPK信号通路参与机械通气肺损伤大鼠肺组织HMGB1的表达*
唐春林, 丁 宁, 程傲冰
(1广州医学院附属肿瘤医院麻醉科,广东 广州 510095; 2广州市第一人民医院麻醉科,广东 广州 510180)
EGFR-p38 MAPK信号通路参与机械通气肺损伤大鼠肺组织HMGB1的表达*
唐春林1, 丁 宁2△, 程傲冰2
(1广州医学院附属肿瘤医院麻醉科,广东 广州 510095;2广州市第一人民医院麻醉科,广东 广州 510180)
目的研究表皮生长因子受体(epidermal growth factor receptor, EGFR)-p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在机械通气肺损伤(ventilator-induced lung injury, VILI)大鼠肺组织高迁移率族盒蛋白1 (high mobility group box 1 protein, HMGB1)表达中的作用。方法健康SD大鼠32只随机分为4组:对照组(A组)不行机械通气,保留自主呼吸;小潮气量通气组(B组)潮气量(VT)为8 mL/kg;大潮气量通气组(C组)VT为40 mL/kg;大潮气量通气+EGFR拮抗剂AG-1478组为D组。机械通气4 h后处死动物,测定支气管肺泡灌洗液中总蛋白水平、白细胞计数以及肺湿干重比值(W/D)和髓过氧化物酶(MPO)活性,采用HE染色观察肺组织病理学改变,Western blotting方法检测肺组织磷酸化EGFR、磷酸化p38和HMGB1蛋白表达,RT-PCR方法检测EGFR mRNA的表达。结果通气4 h后,与A组比较,C组肺组织病理学改变明显,总蛋白水平、白细胞计数、肺W/D、MPO活性、EGFR mRNA表达和磷酸化水平、p38磷酸化水平以及HMGB1蛋白表达均显著增加(P<0.05);与C组比较,D组上述各项指标的变化均显著降低(P<0.05)。结论大潮气量机械通气可引起大鼠急性肺损伤,其机制可能与通过EGFR-p38 MAPK信号通路介导HMGB1蛋白的表达有关。
机械通气; 急性肺损伤; 受体,表皮生长因子; 高迁移率族盒蛋白1; 丝裂原激活蛋白激酶类
机械通气(mechanical ventilation, MV)在临床危重症患者的救治中具有无可替代的作用,更是急性肺损伤/急性呼吸窘迫综合征(ALI/ARDS)治疗的革命性进步。然而,机械通气亦可作为一种损伤因素诱发或加重肺损伤,即机械通气所致肺损伤(ventilator-induced lung injury, VILI)[1-2]。我们的前期研究表明,“晚期”炎症介质高迁移率族盒蛋白1(high mobility group box 1 protein, HMGB1)是介导VILI的关键性炎症因子,但其调控机制有待阐明[3-5]。表皮生长因子受体(epidermal growth factor receptor, EGFR)是细胞生长、分化、增殖、迁移和存活的重要调节因子,近年发现,EGFR作为机械传感器介导了多种类型细胞对机械应激的反应[6-7]。本研究通过复制大鼠VILI模型,探讨EGFR-p38丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号通路在VILI大鼠肺组织表达HMGB1中的作用,旨在阐明EGFR在VILI中的作用机制,并为VILI提供新的药物靶位和新的治疗途径。
材 料 和 方 法
1材料
雄性SD大鼠32只,8~12周龄,体重220~280 g,由南方医科大学实验动物中心提供。Oligo(dT)12-18、M-MLV逆转录酶和Taq DNA聚合酶(Promega),RNA提取试剂(Boehringer Mannhein),PCR引物由上海生物工程公司合成,EGFR拮抗剂AG-1478(Calbiochem),兔抗鼠EGFR抗体、磷酸化EGFR (p-EGFR)抗体、p38抗体、磷酸化p38 (p-p38)抗体、HMGB1抗体和辣根过氧化物酶标记山羊抗兔IgG(Abcam),ECL化学发光试剂盒(Amersham)。
2方法
2.1模型复制与分组 32只SD大鼠随机分为4组,每组8只。A组为对照组,不行机械通气;B组为小潮气量通气组,潮气量(tidal volume,VT)=8 mL/kg,C组为大潮气量通气组,VT=40 mL/kg,D组为大潮气量通气+AG-1478组。机械通气参数设置为呼气末正压(positive end-expiratory pressure,PEEP)=0 mmHg,吸呼比1∶1,调节呼吸频率(RR)使呼气末二氧化碳分压(end-tidal carbon oxide partial pressure,PETCO2)维持在35~45 mmHg,通气时间为4 h。右颈总动脉置管测动脉压,左股静脉置管用于输液和给药。监测动物血压、心率、心电图和PETCO2。机械通气达到预定时间后,放血处死大鼠。
2.2观察指标与测定方法
2.2.1肺组织湿/干重比值(W/D) 取大鼠右肺中叶组织,称湿重(wet weight,W)后于干燥箱中80 ℃烤至恒重并称干重(dry weight,D),计算肺W/D。
2.2.2支气管肺泡灌洗液(bronchoalveolar lavage fiuid,BALF)中白细胞(white blood cell,WBC)计数和总蛋白含量测定 左肺行肺灌洗,回收后800 r/min离心10 min,沉淀物用PBS稀释后行瑞氏染色,光镜下行白细胞计数。BALF中总蛋白的测定采用考马斯亮蓝染色法。
2.2.3肺组织髓过氧化酶(myeloperoxidase,MPO)活性测定 肺组织MPO活性测定采用MPO ELISA试剂盒(Hycult Biotech)。
2.2.4EGFR mRNA表达的测定 按Trizol一步法提取总RNA,逆转录合成cDNA。取逆转录产物进行PCR反应(94 ℃ 1 min,54 ℃ 1 min,72 ℃ 1 min,30个循环)。EGFR的扩增引物为5’-CCG TAA CGA TAC AGT ACA TAC CAC TGA -3’,5’-TCT AAT TGG TCC CAT CCA TTC AAT ATT ACA-3’;内参照GAPDH的扩增引物为5’-CCC ATC ACC ATC TTC CAG GA-3’,5’-TGC TTC ACC ACC TTC TTG AT-3’。2%琼脂糖凝胶电泳,采用凝胶成像系统(Kodak)采集图像并进行半定量分析,以EGFR/GAPDH灰度比值表示各组EGFR mRNA的水平,各组实验重复3次。
2.2.5EGFR、p38活性和HMGB1蛋白水平的测定 肺组织加入细胞裂解液后冰上匀浆,蛋白质定量采用Bradford法,样品加入2×SDS加样缓冲液,行SDS-PAGE凝胶分离,蛋白条带半干电转移到PVDF膜上。室温下用TTBS(100 mmol/L Tris-HCl,0.9 % NaCl,0.1 % 吐温-20)阻断1 h,先后分别用p-EGFR、p38、p-p38、HMGB1 Ⅰ抗和IgG-HRP Ⅱ抗孵育,最后用增强化学发光法检测阳性信号。采集图像并进行半定量分析,以p-EGFR/β-actin、HMGB1/β-actin以及p-p38/p38的灰度比值表示各组蛋白表达水平,各组实验重复3次。
3统计学处理
数据用均数±标准差(mean±SD)表示,应用SPSS 13.0软件处理。采用单因素方差分析进行不同组别间的比较,以P<0.05为差异有统计学意义。
结 果
1肺组织病理学改变
A组大鼠为正常肺组织,未见明显的病理学改变;B组大鼠亦未见或仅见轻微的病理学改变;与A组比较,C组大鼠肺组织可见较显著的炎症损伤,包括弥漫性肺泡壁增厚和中性粒细胞浸润等;与C组比较,D组大鼠仅见轻微的上述组织病理学改变,见图1。
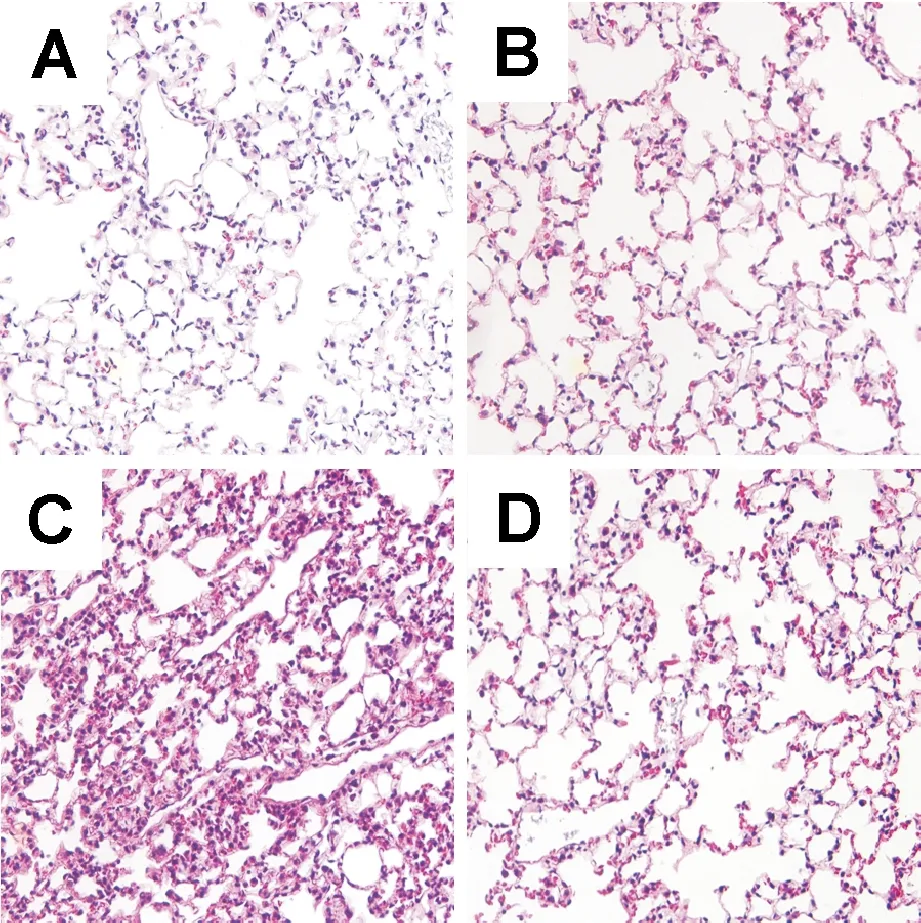
Figure 1. Pathological changes of the lung tissues in the 4 groups (HE staining, ×200). A: control group; B: small tidal volume ventilation group; C: large tidal volume ventilation group; D: large tidal volume ventilation+AG-1478 group.
图1各组大鼠肺组织病理学改变
2各组总蛋白、肺W/D、WBC计数和MPO活性的比较
与A组比较,B组总蛋白、肺W/D、WBC计数和MPO活性等指标的变化均无统计学意义(P>0.05),而C组上述各指标均显著增加(P<0.05);与C组比较,D组上述各指标均显著降低(P<0.05),见表1。
表1各组总蛋白、肺W/D、WBC计数和MPO活性的比较
Table 1. Comparison of total protein content, wet/dry weight ratio (W/D), WBC count and MPO activity in the lung tissues among the 4 groups(Mean±SD.n=8)
*P<0.05vsgroup A;#P<0.05vsgroup C.
3肺组织EGFR磷酸化的变化
Western blotting结果显示,A组EGFR磷酸化水平较低,p-FGFR与β-actin的灰度值比值为0.113±0.022;与A组比较,B组p-EGFR的变化无统计学意义(0.175±0.034,P>0.05),而C组的p-EGFR水平显著增加(0.614±0.127,P<0.05);与C组比较,D组p-EGFR水平显著降低(0.185±0.036,P<0.05),见图2。
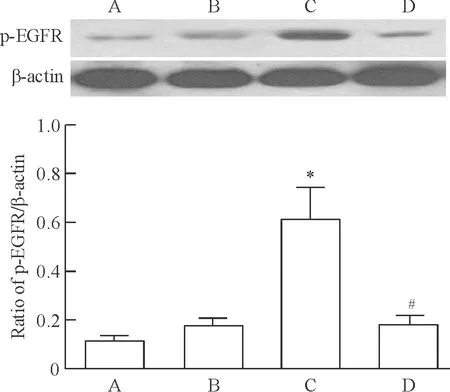
Figure 2. Detection of phosphorylated EGFR in the 4 groups by Western blotting. A: control group; B: small tidal volume ventilation group; C: large tidal volume ventilation group; D: large tidal volume ventilation+AG-1478 group.Mean±SD.n=8.*P<0.05vsgroup A;#P<0.05vsgroup C.
图2Westernblotting检测各组大鼠肺组织EGFR的磷酸化水平
4肺组织EGFRmRNA表达的变化
RT-PCR结果显示,A组EGFR mRNA表达水平为0.093±0.019;与A组比较,B组EGFR mRNA的表达变化无统计学意义(0.179±0.059,P>0.05),而C组的EGFR mRNA表达显著增加(0.511±0.124,P<0.05);与C组比较,D组的EGFR mRNA表达水平显著降低(0.185±0.067,P<0.05),见图3。

Figure 3. The expression of EGFR mRNA in the 4 groups determined by RT-PCR. A: control group; B: small tidal volume ventilation group; C: large tidal volume ventilation group; D: large tidal volume ventilation+AG-1478 group.Mean±SD.n=8.*P<0.05vsgroup A;#P<0.05vsgroup C.
图3RT-PCR检测各组大鼠肺组织EGFRmRNA的表达
5肺组织p38的活性变化
Western blotting结果显示,A组的p-p38为0.087±0.023;与A组比较,B组p-p38的变化无统计学意义(0.108±0.033,P>0.05),而C组的p-p38显著增加(0.851±0.171,P<0.05);与C组比较,D组的p-p38水平显著降低(0.173±0.053,P<0.05),见图4。
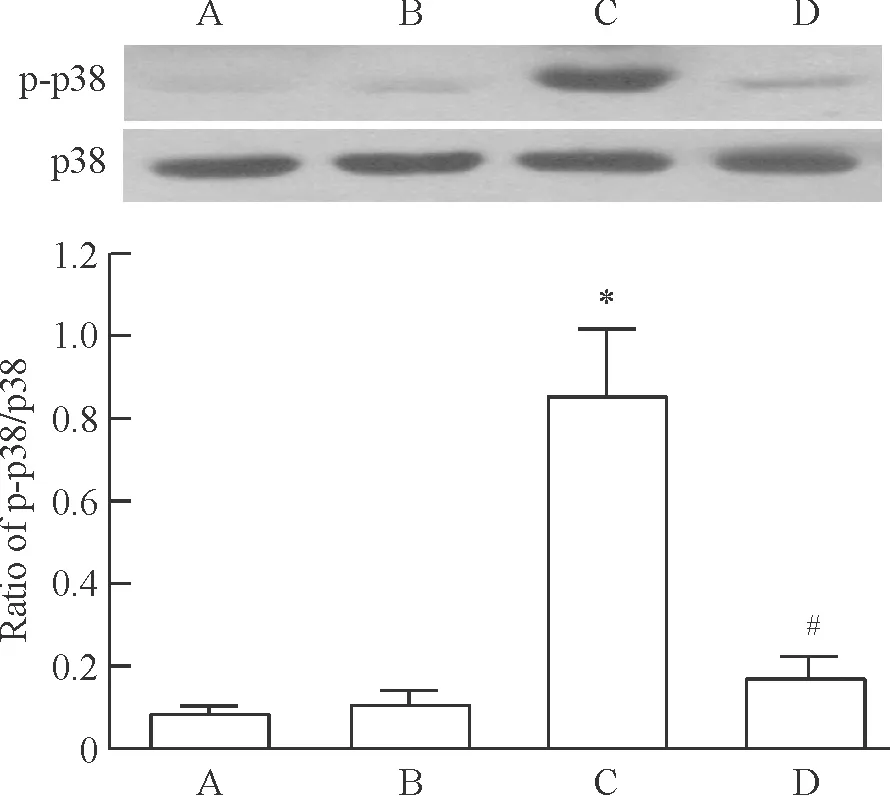
Figure 4. The activation of p38 in the 4 groups determined by Western blotting. A: control group; B: small tidal volume ventilation group; C: large tidal volume ventilation group; D: large tidal volume ventilation+AG-1478 group.Mean±SD.n=8.*P<0.05vsgroup A;#P<0.05vsgroup C.
图4Westernblotting检测各组大鼠肺组织p38的激活情况
6肺组织HMGB1表达的变化
Western blotting结果显示,A组肺组织HMGB1蛋白表达水平较低(0.129±0.042),与A组比较,B组HMGB1蛋白表达的变化无统计学意义(0.205±0.084,P>0.05),而C组的HMGB1蛋白表达显著增加(0.633±0.132,P<0.05);与C组比较,D组的HMGB1蛋白表达水平显著降低(0.182±0.087,P<0.05),见图5。
讨 论
VILI发生机制复杂,目前尚未完全阐明。近年的研究结果表明,异常的机械力除了可作用于肺组织直接造成机械损伤外,还可以激活肺内效应细胞引起炎症反应,即“生物伤(biotrauma)”。机械刺激(如牵拉、剪切力)作用于肺泡上皮细胞的压力感受器和细胞内张力元件,通过机械转导机制(mechanotransduction)激活细胞内MAPK、NF-κB等信号转导通路,诱导多种炎症介质的表达与释放,进而引起或加重肺损伤[8]。本研究中,大鼠以40 mL/kg的大潮气量通气4 h后,反映肺渗出和肺水肿程度的指标肺W/D、总蛋白含量以及反映肺组织白细胞浸润的MPO活性和白细胞计数均较对照组明显增加,肺组织病理学观察亦显示较为明显的炎症改变,提示大鼠发生了急性肺损伤。因此,从细胞和分子生物学基础来探讨机械力学导致和加重肺损伤的炎症反应机制,使VILI的防治不仅采取适当的保护性通气策略以减少机械损伤,更要从限制或调整炎症反应着手,从而避免生物学损伤,这对于改善机械通气患者的预后具有十分重要的意义。

Figure 5. The expression of HMGB1 protein in the 4 groups determined by Western blotting. A: control group; B: small tidal volume ventilation group; C: large tidal volume ventilation group; D: large tidal volume ventilation+AG-1478 group.Mean±SD.n=8.*P<0.05vsgroup A;#P<0.05vsgroup C.
图5Westernblotting检测各组大鼠肺组织HMGB1蛋白的表达
EGFR是具有配体介导的酪氨酸激酶活性的多功能跨膜糖蛋白,是定位于人第7号染色体短臂的原癌基因c-erb-B1的表达产物,分子量为170 kD。EGFR是细胞生长、分化、增殖、迁移和存活的重要调节因子,其中一个重要机制是EGFR作为机械传感器介导了多种类型细胞对机械应激的反应。周期性牵张心肌细胞5 min后即可激活EGFR,并且其磷酸化程度与牵拉强度呈正相关,而应用EGFR抑制剂AG-1478则显著减弱这种磷酸化激活[9]。EGFR不但在维持正常细胞的功能和存活中非常重要,还与多种疾病的发生发展密切相关,如肿瘤、慢性气道炎症疾病和急性肺损伤等。Tschumperlin等[10]在研究哮喘的发病机制时发现EGFR在气道上皮细胞对损伤性机械力引起的细胞反应中起关键性作用。本研究发现,大潮气量机械通气(VT=40 mL/kg)可诱导大鼠肺组织EGFR磷酸化激活,表明EGFR参与了VILI的病理生理过程。
作为MAPK信号通路的重要成员之一,p38通路与炎症和应激反应的调控密切相关[11-12]。本研究显示,大潮气量机械通气时p38发生磷酸化,提示p38信号通路参与了VILI。EGFR抑制剂AG-1478显著抑制p38磷酸化激活,表明机械牵张通过EGFR引起p38信号通路激活。HMGB1是新近发现的“晚期”炎症介质,作为关键性炎症因子参与了VILI。在动物实验中观察到大潮气量通气组(VT=30 mL/kg)家兔BALF中HMGB1水平是小潮气量通气组(VT=8 mL/kg)的5倍,而给予抗HMGB1抗体则明显降低机械通气引起的肺微血管通透性增加及BALF中的TNF-α含量[13]。临床研究证实,正常人血清中HMGB1为阴性,长期应用机械通气的呼吸衰竭患者血清中HMGB1水平显著升高[14]。我们在体内和体外实验中均发现,机械牵张可诱导HMGB1在mRNA和蛋白水平的表达增加,且其表达量与牵张强度成正比[3-5]。进一步研究证实,HMGB1还可诱导多种炎症介质表达释放,导致炎症反应的放大和加强,并可能影响机体的凝血及免疫机能[15]。因此,HMGB1在炎症网络中可能处于关键环节。本研究初步探讨了EGFR抑制剂对HMGB1表达的影响,发现EGFR 拮抗剂AG-1478可有效抑制肺组织HMGB1蛋白的表达,从而减轻肺损伤程度。其抗炎作用可能是通过对EGFR酪氨酸激酶活性及其下游有丝分裂信号通路p38的抑制作用实现的。
本实验证实机械通气可诱导肺组织EGFR磷酸化激活,进而通过p38 MAPK信号通路诱导HMGB1表达增加,最终引起肺损伤,而应用EGFR拮抗剂可阻断配体依赖途径的EGFR激活,在VILI的病理形成过程中,抑制HMGB1蛋白表达,表现出减轻肺损伤的效应,故探讨EGFR阻断剂应用于VILI患者的可能性,将为VILI的防治提供新的思路。
[1] Ngiam N, Kavanagh BP. Ventilator-induced lung injury: the role of gene activation[J]. Curr Opin Crit Care, 2012, 18(1):16-22.
[2] Halbertsma FJ, Vaneker M, Scheffer GJ, et al. Cytokines and biotrauma in ventilator-induced lung injury: a critical review of the literature[J]. Neth J Med, 2005, 63(10):382-392.
[3] 丁 宁, 肖 慧, 高 巨, 等. p38 MAPK在周期性机械牵张诱导肺泡巨噬细胞表达HMGB1中的作用[J]. 中国病理生理杂志, 2009, 25(10):1979-1982.
[4] 丁 宁, 肖 慧, 许立新, 等. 机械牵张诱导THP-1细胞高迁移率族蛋白B1移位出核[J]. 中国病理生理杂志, 2011, 27(2):382-385.
[5] 丁 宁, 肖 慧, 许立新, 等. 不同机械牵张应力对大鼠肺泡巨噬细胞HMGB1表达的影响[J]. 中华麻醉学杂志, 2009, 29(4):311-313.
[6] Balestreire EM, Apodaca G. Apical epidermal growth factor receptor signaling: regulation of stretch-dependent exocytosis in bladder umbrella cells[J]. Mol Biol Cell, 2007, 18(4):1312-1323.
[7] Iwasaki H, Eguchi S, Ueno H, et al. Mechanical stretch stimulates growth of vascular smooth muscle cells via epidermal growth factor receptor[J]. Am J Physiol Heart Circ Physiol, 2000, 278(2):H521- H529.
[8] Rocco PR, Dos Santos C, Pelosi P. Pathophysiology of ventilator-associated lung injury[J]. Curr Opin Anaesthesiol, 2012, 25(2):123-130.
[9] Yarden Y, Sliwkowski MX. Untangling the ErbB signaling network[J]. Nat Rev Mol Cell Biol, 2001, 2(2):127-137.
[10] Tschumperlin DJ, Dai G, Maly IV, et al. Mechanotransduction through growth-factor shedding into the extracellular space[J]. Nature, 2004, 429(5):83-86.
[11] 丁 宁, 肖 慧, 许立新, 等. 羟乙基淀粉130/0.4对大鼠内毒素性急性肺损伤ICAM-1表达的影响及MAPK信号通路在其中的作用[J]. 中国药理学通报, 2009, 25(3):394-398.
[12] Uramoto H, Izumi H, Nagatani G, et al. Physical interaction of tumour suppressor p53/p73 with CCAAT-binding transcription factor 2 (CTF2) and differential regulation of human high-mobility group 1 (HMG1) gene expression[J]. Biochem J, 2003, 371(Pt 2):301-310.
[13] Ogawa EN, Ishizaka A, Tasaka S, et al. Contribution of high-mobility group box-1 to the development of ventilator-induced lung injury[J]. Am J Respir Crit Care Med, 2006, 174(4):400-407.
[14] van Zoelen MA, Ishizaka A, Wolthuls EK, et al. Pulmonary levels of high-mobility group box 1 during mechanical ventilation and ventilator-associated pneumonia[J]. Shock, 2008, 29(4):441-445.
[15] Klune JR, Dhupar R, Cardinal J, et al. HMGB1: endogenous danger signaling[J]. Mol Med, 2008, 14(7-8):476-484.
EGFR-p38MAPKsignalingpathwayisinvolvedinexpressionofHMGB1inpulmonarytissuesofratswithventilator-inducedlunginjury
TANG Chun-lin1, DING Ning2, CHENG Ao-bing2
(1DepartmentofAnesthesiology,AffiliatedTumorHospitalofGuangzhouMedicalCollege,Guangzhou510095,China;2DepartmentofAnesthesiology,GuangzhouFirstPeople’sHospital,Guangzhou510180,China.E-mail:dingninggz@hotmail.com)
AIM: To investigate the role of epidermal growth factor receptor (EGFR)-p38 mitogen-activated protein kinase (MAPK) pathway in the expression of high mobility group box 1 protein (HMGB1) in the lung tissues of rats with ventilator-induced lung injury (VILI).METHODSThirty-two healthy Sprague-Dawley (SD) rats were randomly divided into 4 groups (n=8 each): group A, spontaneous breathing; group B, small tidal volume ventilation (VT=8 mL/kg); group C, high tidal volume ventilation (VT=40 mL/kg); group D, high tidal volume ventilation plus EGFR antagonist AG-1478. The rats in group B, group C and group D were mechanically ventilated for 4 h and then all animals were sacrificed.Total protein content and white blood cell (WBC) count in bronchoalveolar lavage fluid (BALF), the lung wet/dry weight ratio (W/D) and myeloperoxidase (MPO) activity were determined. The histological changes of lung tissues were observed by HE staining. The EGFR protein and mRNA expression, p38 MAPK activity and HMGB1 protein expression in the lung tissues were also detected.RESULTSThe inflammatory responses as evidenced by lung HE staining, total protein and WBC in BALF, the lung W/D and MPO activity were significantly higher in group C than those in group A (P<0.05). The mRNA expression of EGFR, EGFR activity, p38 activity and HMGB1 protein level also significantly increased in group C (P<0.05) as compared with group A. Significant decreases in the above indexes in group D were observed as compared with group C.CONCLUSIONHigh tidal volume ventilation induces acute lung injury, which may be related to up-regulation of HMGB1 expression through EGFR-p38 MAPK signal pathway.
Mechanical ventilation; Acute lung injury; Receptors,epidermal growth factor; High mobility group box 1 protein; Mitogen-activated protein kinases
R563.8
A
10.3969/j.issn.1000- 4718.2013.06.013
1000- 4718(2013)06- 1029- 05
2013- 01- 04
2013- 05- 02
国家自然科学基金资助项目(No. 81272136);广东省科技计划项目(No. 2010B031600011);广东省医学科研基金资助项目(No. A2012278);广州市科技计划重点项目(No. 2012J4100034);广州市医药卫生科技重点项目(No. 20121A021001)
△通讯作者 Tel: 020-81048310; E-mail: dingninggz@hotmail.com

