一个新的水稻幼苗黄叶突变体的遗传分析及其基因的初步定位
葛绍兴,马晓静,林冬枝,董彦君
(上海师范大学生命与环境科学学院,上海200234)
0 引言
绿色植物的光合作用被称为地球上最重要的化学反应.据统计,水稻植株中90% ~95%的碳水物质来自叶片光合作用的产物,植物光合作用对光能的利用是从光合色素对光能的捕获开始的.一般来说,正常的水稻绿色叶片中叶绿素a和叶绿素b的比例约为3∶1[1],而当叶绿素含量比例失调时,水稻叶片就表现出不正常的叶色,从而影响其光合作用.
水稻叶色突变体研究日渐成为水稻功能基因组学的重要研究内容之一.目前,除了天然自发突变外,还可以通过适当的核辐射诱变[2-3]、化学诱变剂处理[4-5]、T - DNA 插入突变[6]、转座子(Ac/Ds系统)插入突变[7]以及逆转座子(逆转录转座子Tosl7)插入突变[8]等方法获得水稻叶色突变体.水稻叶色突变体的主要特点是突变体苗期叶色表型发生变异,表现为白化、黄化、浅绿、绿白、白翠、黄绿、绿黄、和条纹等不同类型[9],并可致使控制叶绿素生物合成和叶绿体发育的关键基因沉默或失活,直接或间接影响叶绿素的合成和降解,改变叶绿素含量[10-15].大量研究结果显示,水稻叶色突变体不仅可以应用于作物育种、植物光合作用、遗传转化、基因调控等基础研究中,而且其还是研究叶绿素生物合成途径、叶绿体的结构功能和遗传发育调控机制的理想材料[16-17].因此,发掘和鉴定新的控制植物叶色突变的基因,并开展新的突变基因的定位、克隆及其作用机理等方面的研究,不仅具有重要的理论意义,更具有实际的应用价值.
关于水稻叶色突变性状的遗传,国内外的学者进行了大量的相关研究,除了李贤勇等[18]报道的由1对显性单基因控制的深绿色水稻突变体和钱前等[19]在秀水11/春江03F4株系中发现的细胞质遗传的白绿苗突变体之外,多数水稻叶色突变体都是受一对隐性核基因控制的.目前,除了第12号染色体,已经报道了近80个水稻叶色突变基因[20-21].本研究不仅对水稻幼苗黄叶突变体syl11的不同时期叶色表型、形态特征等进行了观察和分析,还对其突变基因进行了遗传分析,并利用SSR及InDel分子标记对该突变基因进行了初步定位,以期为该基因的分子克隆及其作用机理的研究奠定基础.
1 材料与方法
1.1 材 料
水稻幼苗黄叶突变体syl11是从日本晴经60Coγ射线诱变处理的M2代群体后代中筛选获得的.突变体syl11经多次自交繁殖和选择,其突变性状和各种农艺性状均已稳定.
1.2 方 法
1.2.1 突变体的表型观察
为了进一步确定突变体syl11幼苗叶色黄化的突变性状,将突变体s yl11及其野生型日本晴的种子在32℃条件下催芽4 d后,播种在装有水稻土的塑料盆内,放置在32℃的光照培养箱(GXZ智能型,宁波,江南仪器厂)内,每天光照12 h(光照强度为180μmol·m-2·s-1)进行培养,观察突变体syl11及其野生型日本晴苗期叶色变化,并对其进行拍照.
1.2.2 叶片光合色素含量的测定
待幼苗黄叶突变体syl11与野生型日本晴长至二、三、四叶期时,参照沈伟其[22]描述的水稻叶片叶绿素浸提法,分别提取syl11第二叶、第三叶以及四叶期的第3叶的光合色素,然后使用BECKMANCOULTER-DU720分光光度计分别测定470,645,663 nm 3个波长下的吸光值,分别计算叶绿素a、b和类胡萝卜素的含量,实验均重复3次.
1.2.3 遗传分析以及定位群体的构建
2010年夏,在上海以突变体syl11和培矮64S杂交配组获得的F1代种子,同年冬季在海南省陵水县浙江省农科院南繁基地实验田加代种植,获得F2代种子.取适量F2代种子在32℃条件下,催芽5 d之后,播种在带有少量湿润水稻土的托盘内,并用保鲜膜密封.然后将其放置于32℃光照培养箱(GXZ智能型,宁波江南仪器厂)内进行培养,并保持光照强度为180μmol·m-2·s-1,每天光照12 h.待约一周之后,开始观察幼苗叶色表型分离情况,并进行遗传分析.与此同时,将从突变体培矮64S/syl11F2群体中挑出的具有突变表型的幼苗,仍然放置在原光照培养箱内继续生长,待长至四叶期后,进行DNA的提取及基因定位.
1.2.4 水稻DNA的提取
采用改良后的CTAB法[23],提取亲本以及F2代遗传群体基因组DNA.
1.2.5 突变体syl11的基因定位
本研究首先选取82对GRAMENE网站(http://www.gramene.org/)上公布的以及本实验室开发保存的SSR及InDel的分子标记检测突变体syl11和培矮64S的多态性,然后选取均匀分布在水稻12条染色体上的有多态性的引物,对22株突变表型F2遗传群体进行连锁分析,初步确定突变基因在染色体上的位置.接着进一步扩大F2群体进行遗传定位,并在目标区域内根据NCBI网站(http://www.ncbi.nlm.nih.gov/)上公布的日本晴和9311的全基因组序列差异寻找InDel位点,然后在此基础上使用Primer Premier 5.0软件设计引物.引物由上海生工生物工程技术服务公司合成.25μL的PCR反应体系包括:100 mmol/L Tris - HCl(pH 9.0)、100 mmol/L KCl、20 mmol/L MgSO4、80 mmol/L(NH4)2SO4、2.5 mmol/L dNTP、10μmol/L引物、5 U/mL Taq酶和20 ng模板DNA.在Eppendorf和东胜PCR仪上进行扩增,PCR反应程序为:94℃预变性4 min,94℃变性30 s,55℃退火30 s(退火温度随不同引物变化),72℃延伸30 s,35个循环;72℃延伸10 min.反应产物用2.5% ~3.5%的琼脂糖凝胶电泳检测,经溴化乙锭染色后在UVP凝胶成像仪上成像,而对于多态性不明显的引物的PCR产物,用8%的非变性聚丙烯酰胺凝胶电泳检测,银染之后用冷光源胶片观察灯观察,并拍照记录.
1.2.6 连锁分析
本研究将F2遗传群体中与syl11突变体DNA带型一致的单株记作A,与培矮64S带型一致的单株记作B,而与F1带型一致的单株记作H,缺失的单株记作-,应用MAPMAKER/EXP3.0[24]作图软件,构建目的基因区域的分子标记连锁遗传图谱.
2 结果与分析
2.1 突变体syl11的表型及光合色素含量分析
试验表明(图1),突变体syl11第二,三叶未展开之前均呈黄色,随着生长的展开,自其顶端开始转绿,完全展开时,叶片呈正常绿色;至第四叶时完全转绿,和野生型日本晴的表型一致.同时,与野生型日本晴相比较,突变体syl11第二叶叶绿素a、b和类胡萝卜素含量分别下降了82.93%、75%和41.67%,第三叶分别下降了82.3%、67.65% 和 73.68%,并且叶绿素 a/b也明显小于野生型日本晴;而转绿后的四叶期幼苗第三叶的光合色素含量均接近日本晴.以上结果表明,突变体syl11的黄叶突变性状只在幼叶三期之前表达,引起其光合色素含量下降引.

图1 野生型日本晴(左)和突变体syl11(右)的幼苗叶色表型
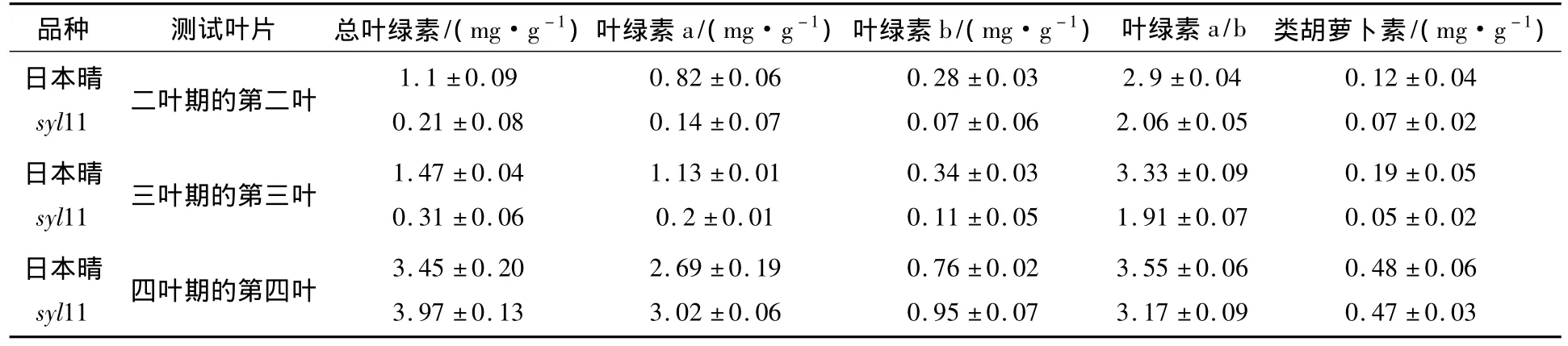
表1 幼苗突变体syl11与野生型日本晴光合色素的含量分析
2.2 突变体syl11的遗传分析
突变体syl11与籼稻培矮64S的正反交杂交后代中,所有的F1代幼苗单株个体均表现正常的绿色表型.与此同时,通过随机调查突变体syl11与籼稻培矮64S杂交产生的F2遗传群体中的754株幼苗,发现野生型正常植株为582株,突变型植株为172株,其分离比例符合3∶1(χ2=1.81< χ20.05=3.84).表明该突变性状是由一对隐性核基因控制的,命名为syl11.
2.3 突变体syl11的基因定位
利用筛选出的28对在syl11和培矮64S之间表现出多态性的引物,对F2遗传群体随机分离出的22株突变体表型单株进行连锁分析,结果发现该突变基因syl11与水稻第11号染色体长臂上的分子标记ID20872和RM287(图2)连锁,从而确定syl11基因在水稻第11号染色体上.然后根据NCBI网站公布的粳稻日本晴的序列和籼稻9311的序列,设计27对SSR和InDel标记引物,但经检测只有5对引物在两亲本间表现出明显多态性(表2).并利用这5对分子标记对230株突变表型单株进行DNA带型分析,将syl11基因定位在水稻第11号染色体的MM1431和MM1193之间,其遗传距离分别为3.1 cM和2.9 cM.然后进一步把定位群体扩大至958株,从而最终把目的基因syl11定位在长臂上的RM26652和处于着丝粒附近的ID11974分子标记之间,其遗传距离分别为0.5 cM和0.7 cM(图3).

图2 分子标记RM287在亲本其及部分具有突变表型F2代单株的DNA分离带型
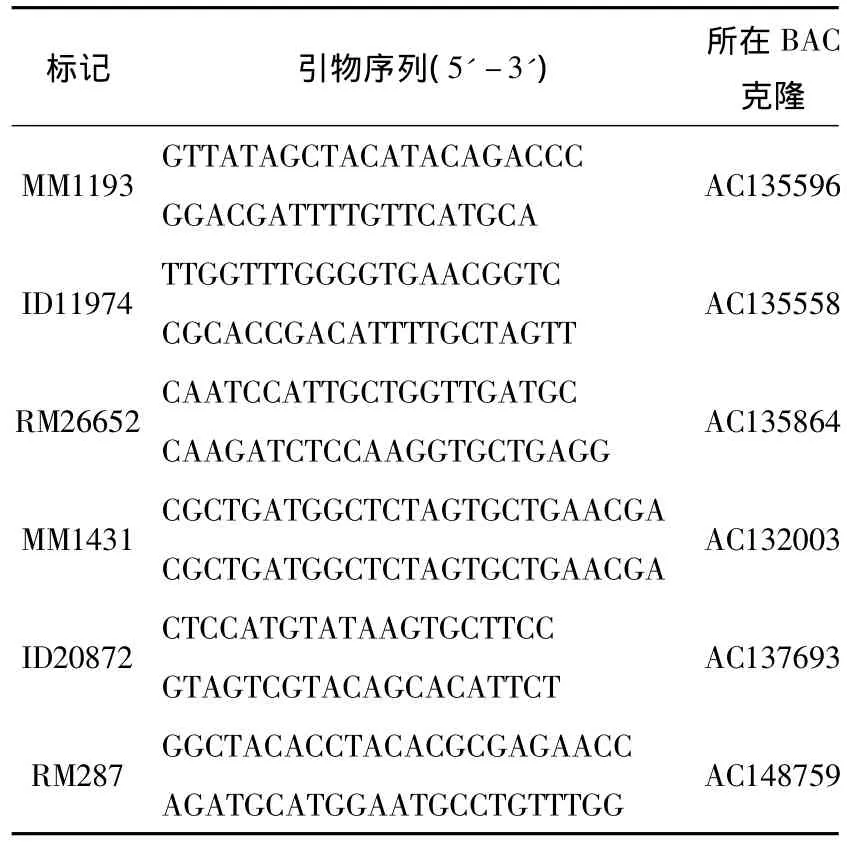
表2 本研究新发展的有多态的分子标记
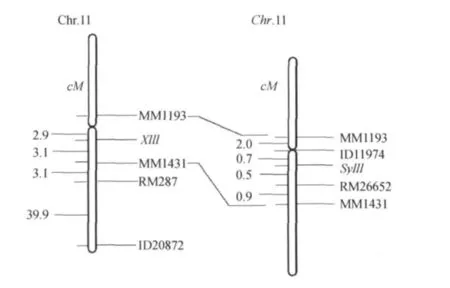
图3 幼苗黄叶突变基因syl11在水稻第11号染色体上的遗传位置
3 讨论
叶色突变体是比较常见的一类水稻突变体,其表型丰富,有如叶片上只有白化、黄化(包括黄绿和淡绿)、紫叶和暗绿叶等1种颜色的单色突变,也有如叶片为条斑叶、斑马叶、斑点叶等含有2种或2种以上颜色的杂色突变.这些丰富的突变体为揭示水稻叶色变化的分子机制提供了有用材料.
伴随水稻全基因组测序的完成,到目前为止,在水稻第1~11号染色体上均有水稻叶色突变基因的报道,其中6个相关基因被克隆[20-21].与本研究突变体syl11位于同一条的第11号染色体的水稻叶色突变体共有9 个,其中包括2 个为“斑马叶”z1、z2[25]的杂色突变,5 个为白化突变体 sgra[26]、tsc-11[27]、gwgl[28]、v4[29]、v9[30]以及 2 个为黄叶突变体 xnt[31]、yl11[32]的单色突变.从表型来看,突变体 z1、z2 以及sgra、tsc-11、gwgl、v4、v9显然不同于本研究中的突变体;突变体xnt和yl11其在整个生育期呈黄化,而本研究中的突变体syl11仅限在第二叶和第三叶呈现黄色表型.此外,突变体xnt、突变体yl11分别定位在第11号染色体的短臂的RM7283和ID9201之间[30]以及长臂的MM2199和ID21039之间[31],均与本研究的定位区间相差甚远.所以,无论从表型上还是从定位区间上分析,本研究中的突变体syl11都是一个新的突变体.另外,还发现突变体syl11第二、三黄叶的光合色素含量下降,四叶期后,其光合色素含量得到了恢复.由此推断,syl11基因不仅与光合色素的合成相关,而且其表达与幼苗的叶龄有关,仅限在苗期早期表达.今后,将在此基础上扩大定位群体,发展更多新的分子标记,进一步对该基因进行克隆和功能分析,将有助于加深对水稻早期叶绿素分子作用机理的了解.
[1]潘瑞炽.植物生理学[M].北京:高等教育出版社,2004.
[2]陈善福,舒庆尧,吴殿星,等.利用60Coγ射线辐照诱发水稻龙特甫B叶色突变[J].浙江大学学报:农业与生命科学版,1999,25(6):569 -572.
[3]魏玉波,梁乃亭,布哈丽且木,等.60Coγ射线辐照诱发水稻茎叶超绿突变体[J].核农学报,2003(6):409-411.
[4]MESKAUSKIENE R,NATER M,DAVID G.A negative regulator of chlorophyll biosynthesis in Arabidopsis thaliana[J].Proc Natl Acad Sci USA,2001,98:12826 -12831.
[5]MOCHIZAUKI N,BRUSSLAN JA,LARKINI R.Arabidopsis genomes uncoupled 5(GUN5)mutant reveals the involvement of Mg-chelatase H subunit in plastid-to-nucleus signal transduction[J].Proc Natl Acad Sci USA,2001,98:2053-2058.
[6]JEON J S,LEE S,JUNG K H.T-DNA insertional mutagenesis for functional genomics in rice[J].The Plant Journal,2000,22:561 -570.
[7]KUNZE R,STOCHAJ U,LAUFSJ,et a1.Transcription of tnmsposable element Activator(Ac)of Zea mays[J].Embo Journal,1987(6):1555 -1563.
[8]HIROCHIKA H,SUGIMOTOK,OTSUKI Y,et a1.Retrotransposons of rice involved in mutations induced by tissue culture[J].Proc Natl Acad Sci USA,1996,993(15):7783 -7788.
[9]AWAN M,KONZAK D F,RUTGER J N.Mutagenic effect of Sodium Azide in rice[J].Crop Science,1980,20:663-668.
[10]HIROKI S,KUSUMI K,TOZAWA Y,et a1.The virescent- 2 mutation inhibits translation of plastid transcripts for the plastid genetic system at an early stage of chloroplast differentiation[J].Plant and Cell Physiology,2004,45(8):985-996.
[11]ANNA L,PESABESI P,VAROTTOC,et a1.Mutants for photosystem Isubunit Dof Arabidopsis thaliana:effects on photosynthesis,photosystem I stability and expression of nuclear genes for chloroplast functions[J].The Plant Journal,2004,37:839-852.
[12]NAGATA N,TANAKA R,SATOH S,et a1.Identification of a vinyl reductase gene for chlorophyll synthesis in Arabidopsis thaliana and implications for the evolution of Prochlorococcus species[J].The Plant Cell,2005,17(1):233 - 240.
[13]CHEN G,YU E B,NING L.EGYI encodes a membrane-associated and ATP-independent metalloprotease that is required for chloroplast development[J].The Plant Journal,2005,41:364 - 375.
[14]JUNG K H,HUB J,RYU CH.Characterization of a rice chlorophyll-deficient mutant using the T-DNA gene-trap system[J].Plant Cell Physiology,2003,44:463 -472.
[15]MAEKAWA M,RIKISHI T,MATSUURA T,et a1.Non-segregation of albino character in rice plant heterozygous for variegated albino[J].Rice Genetics Nesletter,2000,17:51 -54.
[16]LARKIN R M,ALONSO J M,ECKER J R,et al.GUN4,A regulator of chlorophyll synthesis and intracellular signaling[J].Science,2003,299:902 -906.
[17]DONG F G,ZHU X D,XIONG Z M,et al.Breeding of a photo-thermoperiod sensitive genie male sterile indica rice with a pale-green-leaf marker[J].China Rice Sci,1995,9(2):65 -70.
[18]李贤勇,王楚桃,李顺武,等.一个水稻高叶绿素含量基因的发现[J].西南农业学报,2002,15(4):122-123.
[19]钱前,朱旭东,曾大力,等.细胞质基因控制的新特异材料白绿苗的研究[J].作物品种资源,1996,4:11-12.
[20]ZHANG H T,LI J J,YOOJH,et al.Rice Chlorina -1 and Chlorina -9 encode ChlD and ChlI subunits of Mg-chelatase,a key enzyme for chlorophyll synthesis and chloroplast development[J].Plant Mol Biol,2006,62(3):325 - 337.
[21]WU Z M,ZHANG X,HE B,et al.A chlorophyll-deficient rice mutant with impaired chlorophyllide esterification in chlorophyll biosynthesis[J].Plant Physiol,2007,145(1):29 -40.
[22]沈伟其.测定水稻叶片叶绿素含量的混合提取法[J].植物生理学通讯,1998(3):62-64.
[23]MURAY M G,THOMPSON W F.Rapid isolation of high molecular weight plant DNA[J].Nucl Acids Res,1980,8(19):4321-4325.
[24]LINCOLN S,DALY M,LANDER E.Constructing genetics maps with MAPMAKER/EXP3.0.Whitehead Institute Technical Report.3rd ed[R].Cambridge,Massachusetts:Whitehead Institute,1992.
[25]PARKSB M,QUAIL P H.Phytochrome-deficient hy1 and hy2 long hypocotyl mutants of Arabidopsis are defective in phytochrome chromophore biosynthesis[J].Plant Cell,1991,3:1177 - 11186.
[26]张向前,李晓燕,朱海涛,等.水稻阶段性返白突变体的鉴定和候选基因分析[J].科学通报,2010,55:2296-2301.
[27]DONG Y J,DONG WQ,SHI SY,et al.Identification and genetic analysis of a thermo-sensitive seedling-colour mutant in rice(Oryza sativa L.)[J].Breeding Sci,2001,51:1 -4.
[28]李育红,王宝和,戴正元,等.一个水稻新型叶色突变体的形态结构与遗传定位[J].中国水稻科学,2011,25(6):587-593.
[29]SALLAUD C,GAY C,LARMANDE P.High throughput T-DNA insertion mutag enesis in rice:a first step towards in silico reverse genetics[J].The Plant Journal,2004,39:450 - 464.
[30]KIM SR,LEE J,JUNSH.Transgene structures in T-DNA inserted rice plants[J].Plant Molecular Biology,2003,52:761-773.
[31]CHI X F,ZHOU X S,SHU Q Y.Fine mapping of a xantha mutation in rice(Oryza sativa L.)[J].Euphytica,2010,172:215-220.
[32]刘朝辉,李小艳,张建辉,等.一个新的水稻叶绿素缺失黄叶突变体的特征及基因分子定位[J].遗传,2012,34(2):223-229.

