活动期溃疡性结肠炎凝血功能分析
刘闻莺 刘欣艳 杨根妹 常 英
上海中医药大学附属普陀医院老年科1(200062) 上海交通大学附属第六人民医院消化内镜中心2
溃疡性结肠炎(ulcerative colitis,UC)属于炎症性肠病(inflammatory bowel disease,IBD)的一种亚型,是病因不明的肠道慢性非特异性炎症性疾病,病变主要局限于结直肠黏膜和黏膜下层,呈连续性弥漫分布,临床多表现为持续或反复发作的腹泻、腹痛、黏液脓血便、里急后重和不同程度的全身症状。近年来,我国UC发病率呈逐年上升趋势,已成为常见的慢性消化系统疾病之一。本研究通过探讨活动期UC患者凝血功能与疾病活动性和严重程度的关系,以期为UC的临床诊治提供新的思路。
对象与方法
一、研究对象
选取2006年1月~2012年11月上海中医药大学附属普陀医院收治的UC活动期和缓解期患者。UC的诊断参考“对我国炎症性肠病诊断治疗规范的共识意见”[1]。排除标准:①合并肝、肾、造血系统等严重疾病;②有肠穿孔、中毒性结肠扩张、结肠癌、直肠癌等严重并发症;③过去4周内服用过影响凝血功能的药物;④近3个月内有外科手术史;⑤有除肠道外的恶性肿瘤;⑥有精神病史。根据Truelove和Witts炎症程度分型标准[1]将活动期UC患者分为轻度、中度、重度;根据结肠镜下有无出血,分为出血组和无出血组。选取同期健康体检者为正常对照组。本研究方案经上海中医药大学附属普陀医院伦理委员会批准,所有入选者均签署知情同意书。
二、研究方法
入选者空腹12 h后于肘正中采集静脉血7 mL,检测血小板计数(platelet,PLT)、平均血小板体积(mean platelet volume,MPV)、凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、纤维蛋白原(fibrinogen,FIB)、凝血酶时间(thrombin time,TT)、D-二聚体(D-Dimer,D-D)、红细胞沉降率(erythrocyte sedimentation rate,ESR)、C 反应蛋白(C-reactive protein,CRP)。根据临床活动性指数(CAI)[2]和修正的Baron内镜下评分标准[3]评估患者CAI和Baron评分。比较PLT、MPV、PT、APTT、FIB、TT、D-D 在 UC 不同疾病活动性和不同严重程度间的差异。分析UC活动期患者PLT、MPV、PT、FIB、D-D 与 ESR、CRP、CAI、Baron 评分的相关性。
三、统计学分析
应用SPSS 16.0统计软件。计数资料以百分率表示,计量资料以表示。所得数据呈正态分布,多组间比较采用单因素方差分析;数据呈非正态分布,多组间比较则采用秩和检验。两组间比较采用t检验,相关性分析采用Spearman等级相关分析和多元线性回归分析。P<0.05为差异有统计学意义。
结 果
一、一般情况
UC活动期组患者97例,其中男36例,女61例,年龄23~82岁,平均(55.5±15.4)岁;UC缓解期组患者65例,其中男25例,女40例,年龄23~79岁,平均(56.3±14.7)岁。UC活动期患者炎症程度轻度41例(42.3%)、中度42例(43.3%)、重度14例(14.4%);结肠镜下可见出血23例(23.7%)、无出血74 例(76.3%)。正常对照组100 名,其中男44名,女 56名,年龄22~81岁,平均(59.0±12.8)岁。UC活动期组、缓解期组以及正常对照组性别、年龄相比差异均无统计学意义(P>0.05)。
二、不同疾病活动性UC患者凝血指标比较
UC活动期组PLT、FIB、D-D较UC缓解期组和正常对照组显著升高(P<0.05),MPV较UC缓解期组和正常对照组显著降低(P <0.05),PT较正常对照组显著降低(P <0.05)。APTT、TT在三组间比较差异无统计学意义(见表1)。
三、不同严重程度UC活动期患者凝血指标比较
轻度组PLT、MPV、PT、FIB、D-D 与中度组和(或)重度组相比差异有统计学意义(P<0.05),中度组PLT、D-D与重度组相比差异有统计学意义(P<0.05),三组间D-D相比差异有统计学意义(P<0.05),三组间APTT、TT相比差异均无统计学意义(见表2)。
四、出血组与非出血组凝血指标比较
UC活动期患者出血组与非出血组凝血指标比较差异均无统计学意义(P>0.05)(见表3)。
五、凝血指标与疾病活动性的相关性分析
Spearman等级相关分析显示,UC活动期患者PLT和D-D与 ESR、CAI、Baron 评分呈正相关(P <0.05),MPV 与ESR、Baron评分呈负相关(P<0.05),PT和 D-D与 CRP呈正相关(P <0.05),FIB 与 ESR、CRP、Baron评分呈正相关(P<0.05)(见表4)。
六、凝血指标与疾病活动性的多元回归分析
多元回归分析显示,UC活动期患者MPV与Baron评分呈负相关(P<0.05),FIB与 ESR和 CRP呈正相关(P<0.05),D-D 与 ESR和 CRP呈正相关(P <0.05)(见表5)。
表1 不同疾病活动性UC患者凝血指标比较()
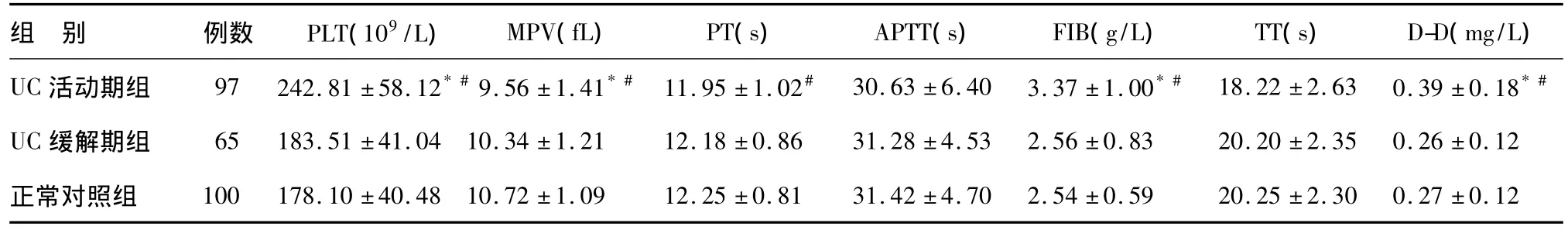
表1 不同疾病活动性UC患者凝血指标比较()
*与UC缓解期组比较,P<0.05;#与正常对照组比较,P<0.05
表2 不同严重程度UC活动期患者凝血指标比较()
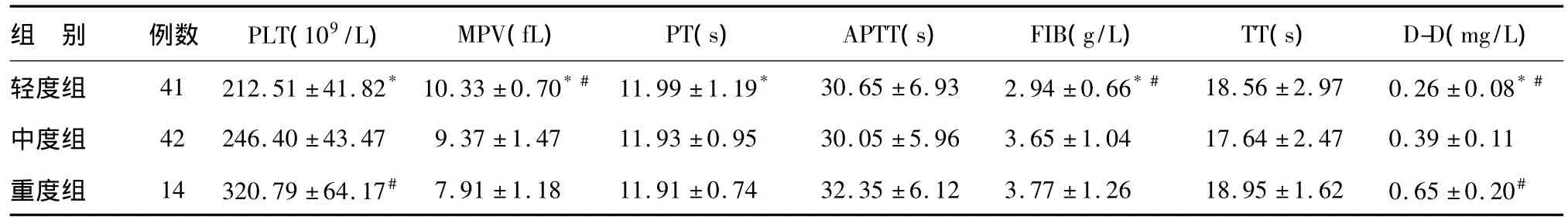
表2 不同严重程度UC活动期患者凝血指标比较()
*与重度组比较,P <0.05;#与中度组比较,P <0.05
表3 出血组与非出血组凝血指标比较()
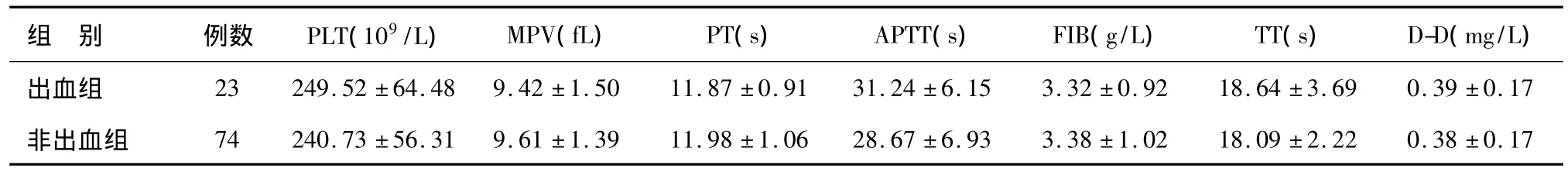
表3 出血组与非出血组凝血指标比较()
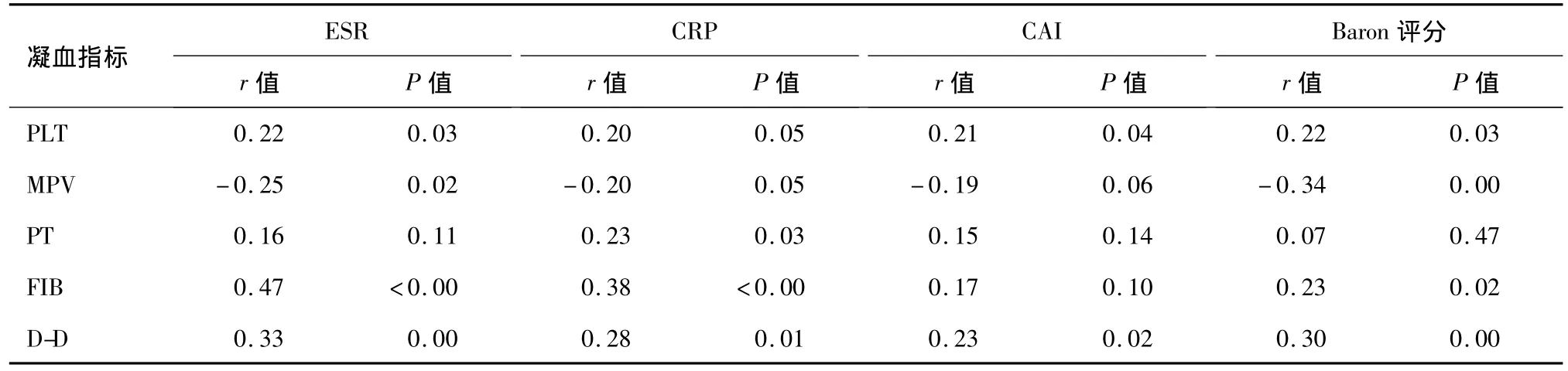
表4 UC活动期患者凝血指标与疾病活动性的关系
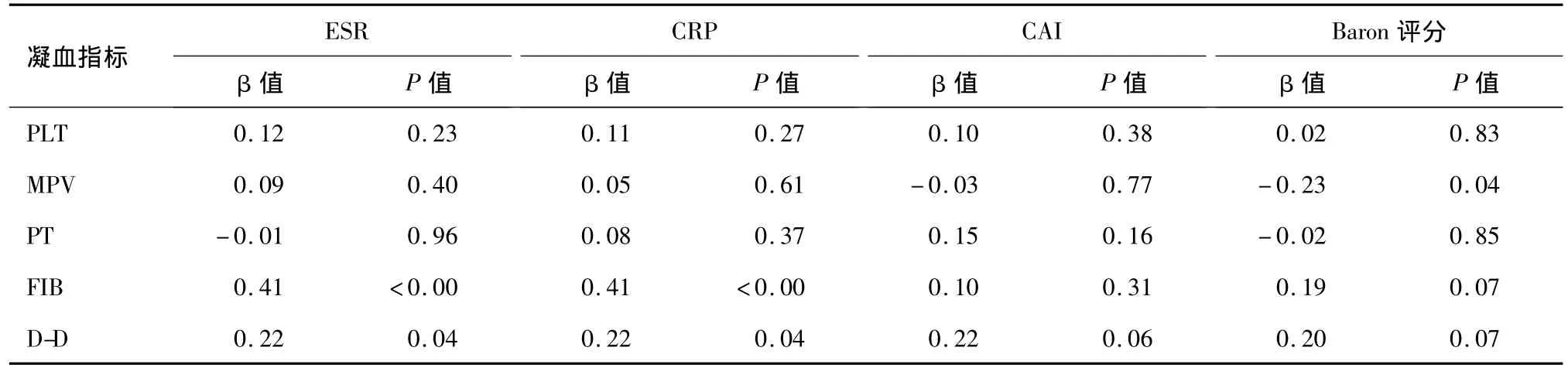
表5 凝血指标与疾病活动性的多元回归关系
讨 论
随着对UC研究的深入,不断发现凝血功能在疾病活动期发挥重要作用。UC活动期患者血液黏滞性增高,凝血功能紊乱,机体处于高凝状态,易发生微血栓形成和微循环障碍,进而引起肠道黏膜缺血坏死、溃疡形成,从而加重肠道病变程度[4]。血栓形成作为UC较严重的并发症,是造成UC病情恶化、导致患者死亡的重要原因之一。
Polińska等[5]和 Larsen 等[6]的研究证实,UC 活动期患者PLT显著升高。本研究结果显示,UC活动期组PLT较UC缓解期组和正常对照组显著上升,且与ESR、CAI、Baron评分呈正相关,提示凝血功能激活继发于肠道炎症。UC活动期PLT计数处于较高水平,可能是由于炎症引起血管内皮细胞损伤,利于PLT在受损内皮细胞局部黏附、聚集,机体释放多种细胞因子如白细胞介素(IL)-3、IL-6、血小板生成素等刺激PLT形成、活化。PLT活化后释放多种炎性介质,促进炎症细胞聚集、趋化,产生氧自由基,进一步导致细胞损伤,加重肠道炎症反应,最终导致肠黏膜微循环障碍,影响肠道溃疡愈合。因此,PLT在UC病变过程中不仅参与血液凝固的环节,促进血栓形成,还具有促进炎症发生、发展的作用,在UC病情迁延中发挥关键性作用。
MPV是PLT激活的标记物,近年来被认为是UC疾病活动性相关的指标之一。Kapsoritakis等[7]的研究发现,UC活动期患者MPV显著降低,且与白细胞计数、CRP、ESR呈负相关。本研究多元回归分析显示MPV与Baron评分呈负线性相关。目前,MPV在UC活动期变化的机制尚不明确,可能与PLT在生成期产生的巨核细胞容积和倍性受干扰、PLT活化后脱颗粒导致体积改变、PLT颗粒内容物增加、PLT增多、活化有关。
Kume等[8]对UC患者研究表明,活动期肠道炎症能激活凝血纤溶级联反应,患者的高凝状态和高纤溶状态继发于肠道炎症。本研究发现,UC活动期组PT显著低于正常对照组,FIB、D-D显著高于UC缓解期组和正常对照组。多元回归分析显示FIB与 ESR和CRP呈正相关,D-D与ESR和CRP呈正相关。活动期UC轻、中、重度间D-D相比差异有统计学意义,提示D-D可作为评价UC严重程度的指标。DD是交联纤维蛋白的降解产物之一,为继发性纤溶特有的代谢产物,是体内高凝状态和继发性纤溶亢进的分子标记物,可间接反映血栓形成、凝血系统激活。FIB水平升高可导致血液黏滞性增加,累及肠道微循环。此外,研究发现FIB、DD对PLT功能具有促进作用[9]。
综上所述,微血栓形成是UC发病的重要机制之一,凝血和纤溶系统异常与疾病活动性密切相关。已有研究[10]显示低分子肝素结肠缓释片对轻、中度活动期UC具有良好治疗效果。因此,UC活动期可适当进行抗凝治疗,有利于控制炎症以及防止血栓形成。
1 中华医学会消化病学分会炎症性肠病协作组.对我国炎症性肠病诊断治疗规范的共识意见[J].胃肠病学,2007,12(8):488-495.
2 Rutgeerts P.Medical therapy of inflammatory bowel disease[J].Digestion,1998,59(5):453-469.
3 Vucelic B.Inflammatory bowel diseases:controversies in the use of diagnostic procedures[J].Dig Dis,2009,27(3):269-277.
4 Srirajaskanthan R,Winter M,Muller AF.Venous thrombosis in inflammatory bowel disease[J].Eur J Gastroenterol Hepatol,2005,17(7):697-700.
5 Polińska B,Matowicka-Karna J,Kemona H.Assessment of the influence of the inflammatory process on the activation of blood platelets and morphological parameters in patients with ulcerative colitis(colitis ulcerosa)[J].Folia Histochem Cytobiol,2011,49(1):119-124.
6 Larsen TB,Nielsen JN,Fredholm L,et al.Platelets and anticoagulant capacity in patients with inflammatory bowel disease[J].Pathophysiol Haemost Thromb,2002,32(2):92-96.
7 Kapsoritakis AN,Koukourakis MI,Sfiridaki A,et al.Mean platelet volume:a useful marker of inflammatory bowel disease activity[J].Am J Gastroenterol,2001,96(3):776-781.
8 Kume K,Yamasaki M,Tashiro M,et al.Activations of coagulation and fibrinolysis secondary to bowel inflammation in patients with ulcerative colitis[J].Intern Med,2007,46(17):1323-1329.
9 Turgut U,Huseyin S,Nergis D,et al.Looking for our ten years results for coronary heart disease and ischemic stroke group for the standpoint of haemostasis[J].Turk J Haematol,2002,19(2):255-263.
10 Chande N,McDonald JW,Macdonald JK,et al.Unfractionated or low-molecular weight heparin for induction of remission in ulcerative colitis[J].Cochrane Database Syst Rev,2010(10):CD006774.

