p27蛋白与细胞周期蛋白D1在疣状胃炎和胃癌组织中的表达及其意义
顾 湘 朱海杭 陈 洁 王庆娜 陶佳丽 陈 健 向 旭
扬州大学临床医学院消化内科(225001)
疣状胃炎(verrucous gastritis)是一种以胃黏膜多发痘疹样隆起伴脐样凹陷为特征的慢性胃炎,其病因和发病机制尚未完全明确,内镜下可分为未成熟型和成熟型疣状胃炎两种类型,病理学上存在一定比例的肠化生和异型增生。研究发现疣状胃炎与胃癌的发生可能存在相关性,但其癌变的分子机制尚不清楚。目前关于疣状胃炎中胃癌相关基因的研究报道较少,本研究通过免疫组化法检测抑癌基因p27蛋白和细胞周期蛋白D1(cyclin D1)在慢性非萎缩性胃炎组织、疣状胃炎组织和胃癌组织中的表达,旨在探讨疣状胃炎与胃癌之间的关系及其可能存在的癌变分子机制。
对象与方法
一、标本来源
收集2012年1~12月扬州大学临床医学院胃镜室和手术室符合研究要求的标本,随机采取慢性非萎缩性胃炎、未成熟型疣状胃炎、成熟型疣状胃炎、胃癌组织标本各40例,常规固定后石蜡包埋。160例患者中,男107例,女53例,年龄26~87岁,平均56.21岁。所有入选者均由胃镜和病理检查确诊,近4周内未服用过抑酸药、铋剂、抗菌药物、非甾体消炎药;胃炎患者不伴有食管癌、胃癌、消化性溃疡;胃癌患者未行放化疗。疣状胃炎分型参照日本学者Kawai等[1]提出的标准,未成熟型:隆起的病灶主要由组织炎性水肿所致,病灶隆起较低,周边高起平缓,坡度小,顶部脐样凹陷较大较浅;成熟型:隆起的病灶由组织增生引起,增生病灶隆起较高,坡度较陡,顶部脐样凹陷较小且深,或无凹陷而呈息肉样隆起。
二、主要试剂
p27蛋白兔抗人单克隆抗体、cyclin D1兔抗人单克隆抗体、兔超敏二步法免疫组化检测试剂盒和DAB试剂盒均购自北京中杉金桥生物技术有限公司。幽门螺杆菌(Hp)快速尿素酶检测试剂盒购自上海惠泰医疗科技公司。
三、方法
采集新鲜标本以快速尿素酶法检测疣状胃炎患者Hp感染情况。蜡块4 μm连续切片后行常规HE染色镜检观察胃炎病理表现。免疫组化二步法检测四种组织中p27蛋白、cyclin D1的表达(抗体工作浓度分别为1∶100和1∶50),具体步骤按照试剂盒说明书进行操作。采用已知的阳性乳腺癌切片作阳性对照,PBS代替一抗作阴性对照。HE和免疫组化染色结果均由病理医师双盲镜检,病理诊断标准参照2012年“中国慢性胃炎共识意见”[2]。以细胞核呈棕黄色颗粒为p27蛋白和cyclin D1阳性反应。免疫组化结果按染色强度和阳性细胞所占比例进行半定量评分[3]。随机选取5个高倍视野(×400),计数1000个细胞,染色强度:无色0分、淡黄色1分、棕黄色2分、棕褐色3分,阳性细胞所占比例:无阳性细胞0分、≤25%1分、26% ~50%2分、51% ~75%3分、>75%4分。总分为两者评分之积,≤3分为阴性,>3分为阳性。
四、统计学分析
采用SPSS 16.0统计软件,组间率的比较采用χ2检验,相关性分析采用Spearman等级相关分析,P<0.05为差异有统计学意义。
结 果
一、p27蛋白和cyclin D1的表达
未成熟型疣状胃炎组p27蛋白阳性表达率显著高于胃癌组(χ2=8.901,P=0.005),与慢性非萎缩性胃炎组相比无明显差异(χ2=0.738,P=0.568);成熟型疣状胃炎组p27蛋白阳性表达率显著低于慢性非萎缩性胃炎组和未成熟型疣状胃炎组(χ2=9.833,P=0.003;χ2=5.495,P=0.034),与胃癌组相比无明显差异(χ2=0.450,P=0.655)。未成熟型疣状胃炎组、成熟型疣状胃炎组cyclin D1阳性表达率均显著高于慢性非萎缩性胃炎组(χ2=7.813,P=0.010;χ2=9.028,P=0.005),但均显著低于胃癌组 (χ2=5.580,P=0.024;χ2=5.051,P=0.042),而未成熟型与成熟型疣状胃炎之间无明显差异(χ2=0.052,P >0.999)(见表1、图1 ~2)。
二、相关性分析
52例p27蛋白阳性表达的疣状胃炎患者中,cyclin D1阳性19例,阴性33例,两者表达无明显相关性(r= -0.164,P=0.145);18 例 p27 阳性表达的胃癌中,cyclin D1阳性13例,阴性5例,两者表达无明显相关性(r=0.019,P=0.576)。
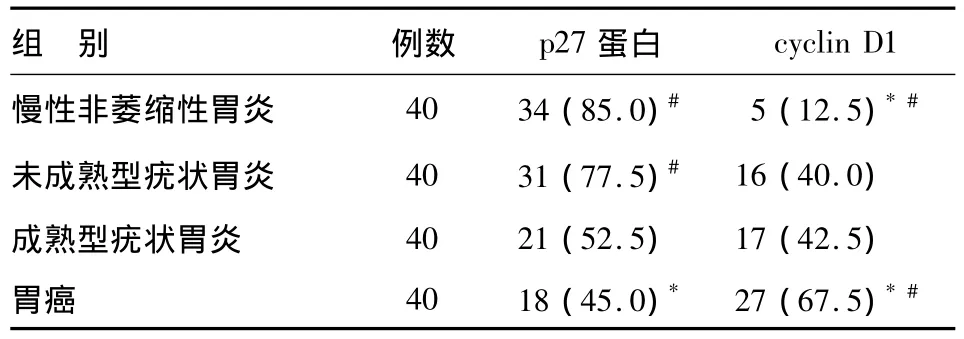
表1 四组p27蛋白、cyclin D1的阳性表达率比较n(%)
三、p27蛋白、cyclin D1的表达与临床病理特征的关系
本组80例疣状胃炎患者中伴Hp感染30例(37.5%),其中未成熟型14例,成熟型16例;伴肠化生23例(28.8%),其中未成熟型11例,成熟型12例;伴异型增生8例(10.0%),其中未成熟型3例,成熟型5例。未成熟型与成熟型疣状胃炎患者Hp感染、肠化生和异型增生发生率均无明显差异(P>0.05)。40例慢性非萎缩性胃炎患者中Hp感染5 例(12.5%),显著低于疣状胃炎(χ2=8.067,P=0.005);肠化生3 例(7.5%),显著低于疣状胃炎(χ2=7.095,P=0.009);无异型增生,与疣状胃炎相比无明显差异(χ2=4.268,P=0.051)。
疣状胃炎患者的性别、年龄和Hp感染与p27蛋白和cyclin D1的表达均明显无关(P>0.05);肠化生组p27蛋白阳性表达率显著低于无肠化生组(43.5%对73.7%,P <0.05),cyclin D1 阳性表达率显著高于无肠化生组(60.9%对33.3%,P <0.05);异型增生组p27蛋白阳性表达率显著低于无异型增生组(25.0%对 69.4%,P <0.05),而 cyclin D1 阳性表达率无明显差异(62.5%对38.9%,P>0.05)(见表2)。
讨 论
胃癌的发生是一个多因素、多步骤的逐步发展的复杂过程,癌基因的激活或突变、抑癌基因的失活或抑制均可打破胃上皮细胞的增殖与凋亡平衡,参与癌变的过程。疣状胃炎与胃癌关系密切,在第十届世界胃肠病大会上,疣状胃炎被列为具有高度癌变倾向的疾病[4]。日本学者Kawai将疣状胃炎分为成熟型和未成熟型两种类型[1],目前得到了广泛的认可。有研究发现成熟型疣状胃炎较未成熟型疣状胃炎具有更强的癌变倾向[5],但其发生、发展和癌变机制仍需进一步研究。
抑癌基因p27定位于人染色体12p13上,其表达产物p27蛋白是一种细胞周期蛋白依赖性激酶抑制剂(cyclin dependent kinase inhibitors,CDKI),为细胞周期的负调控因子。当p27基因突变或失活,丧失或减弱p27蛋白对细胞周期的调控作用,引起细胞过度分裂增殖,最终可导致肿瘤的形成[6]。研究发现包括胃癌在内的绝大部分人类肿瘤均存在p27蛋白表达下调或缺失[7~9],p27蛋白表达与胃癌的恶性程度以及转移风险呈明显负相关,与预后呈正相关,说明p27参与了胃癌的发生、发展[10]。本研究显示成熟型疣状胃炎组p27蛋白阳性表达率显著低于慢性非萎缩性胃炎组和未成熟型疣状胃炎组,说明p27蛋白表达下调可能参与了成熟型疣状胃炎的发生过程;p27蛋白在成熟型疣状胃炎组和胃癌组中的表达均较低,且差异无统计学意义,说明成熟型疣状胃炎存在p27蛋白的缺失,具有癌变的可能性。
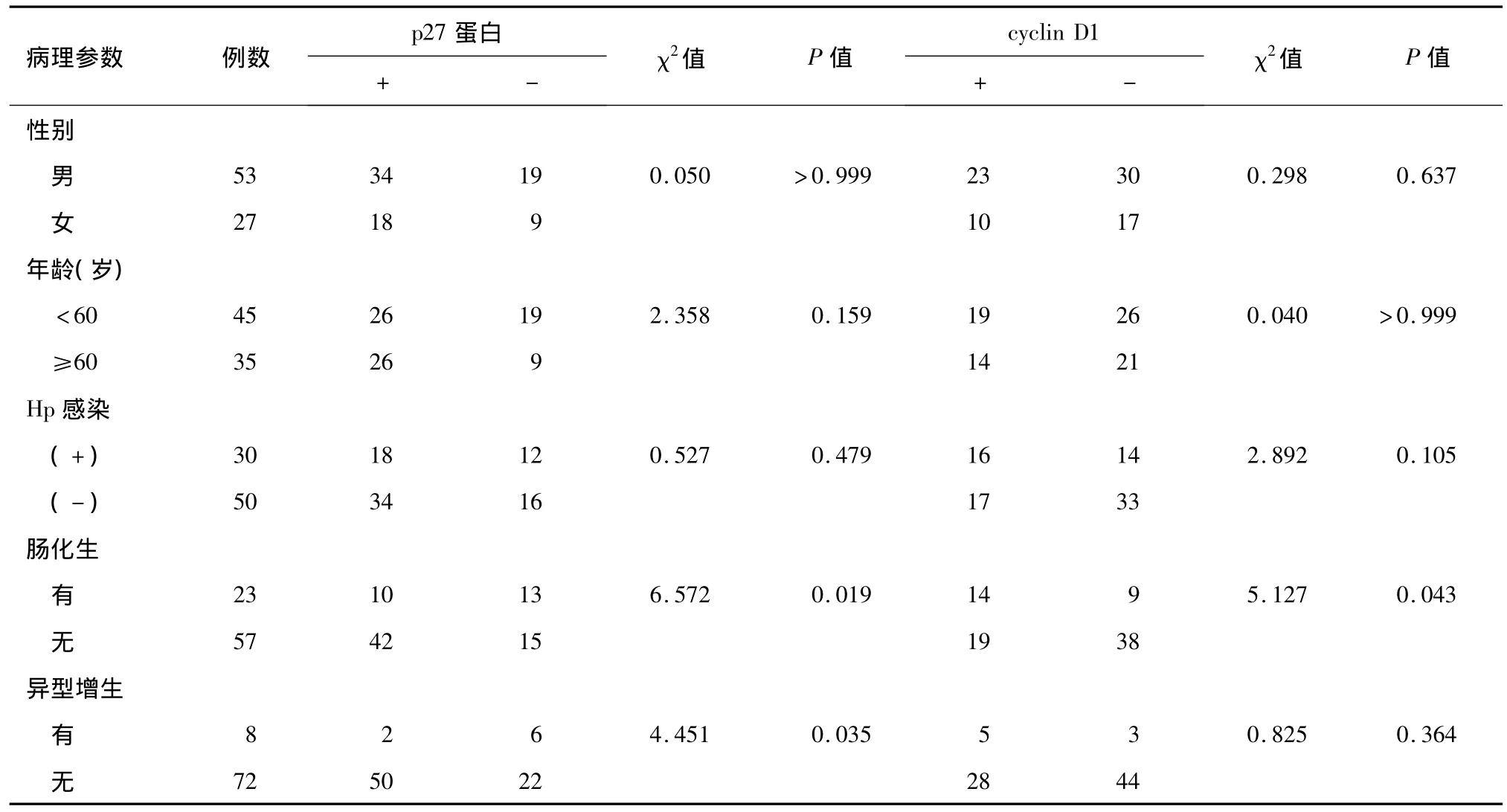
表2 p27蛋白、cyclin D1的表达与疣状胃炎患者临床病理特征的关系
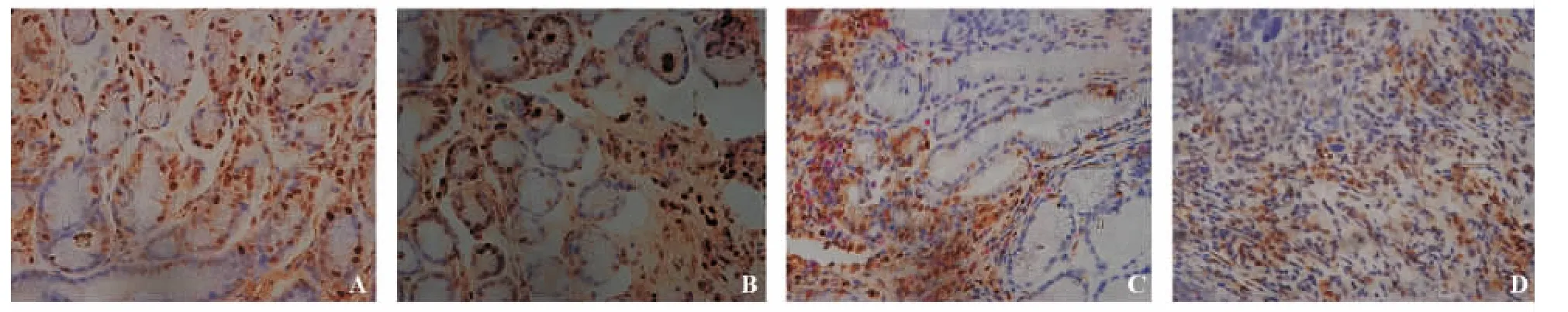
图1 各组中p27蛋白表达(免疫组化二步法,×400)
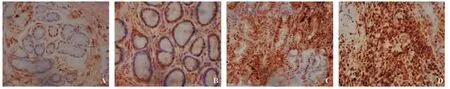
图2 各组中cyclin D1表达(免疫组化二步法,×400)
cyclin D为一种重要的细胞周期正调控因子,包括cyclin D1、cyclin D2和cyclin D3三个亚型,目前以cyclin D1的研究较多见,其与肿瘤的关系较明确[11]。cyclin D1基因扩增及其蛋白高表达常见于多种人类恶性肿瘤,cyclin D1表达上调可导致细胞周期调控失衡,使细胞增殖过程失控而发生恶性变化[12]。Gao等[13]的研究发现 cyclin D1 蛋白在胃正常黏膜、增生性息肉和腺瘤中不表达,仅在胃癌中可检测到,且阳性表达的胃癌患者预后较差。Arici等[14]在43例原发性胃腺癌患者组织中检出31例表达cyclin D1,但正常胃黏膜中不表达,两组之间检出率存在明显差异,且cyclin D1在萎缩、异型增生、肠化生和胃癌组织中的表达呈升高趋势,提示cyclin D1阳性表达是胃癌的早期事件,其往往始于癌前病变并参与整个癌变的发展过程。本组资料中未成熟型、成熟型疣状胃炎组cyclin D1阳性表达率均显著高于慢性非萎缩性胃炎组,但均显著低于胃癌组。疣状胃炎可能为胃黏膜组织发生癌变的中间阶段,存在慢性非萎缩性胃炎→疣状胃炎→胃癌的发展过程,cyclin D1可能参与了疣状胃炎的发生和癌变过程。
p27蛋白和cyclin D1均具有对细胞周期的调控作用,p27蛋白为负调控因子,cyclin D1为正调控因子。本研究中p27蛋白阳性表达率在慢性非萎缩性胃炎、疣状胃炎和胃癌中呈递减趋势,而cyclin D1的表达呈递增趋势,但统计学结果表明疣状胃炎和胃癌中p27蛋白表达与cyclin D1表达均无明显相关性,说明这两种蛋白无明显拮抗或协同作用。
本研究发现疣状胃炎p27蛋白、cyclin D1表达与Hp感染无关,但与慢性非萎缩性胃炎相比,成熟型和未成熟型疣状胃炎均具有较高的Hp感染率,而Hp感染与胃癌的发生有关,说明疣状胃炎与胃癌的发生可能有关。Cappell等[15]发现疣状胃炎患者可发生癌变;姚忆蓉等[16]报道了4例发生癌变的疣状胃炎患者,其中3例在未癌变时伴有异型增生,另1例伴有肠化生。而本研究发现未成熟型和成熟型疣状胃炎均存在一定比例的肠化生和异型增生,且肠化生发生率显著高于慢性非萎缩性胃炎组,这两种病理变化作为胃癌的癌前病变具有较高的癌变率。疣状胃炎中p27蛋白和cyclin D1的表达与肠化生有关,p27蛋白还与异型增生相关,提示p27蛋白表达下降和cyclin D1表达升高可能引起细胞增殖和分化的紊乱,从而导致肠化生的发生,且p27蛋白缺失还可使疣状胃炎胃上皮细胞过度增殖、细胞凋亡受到抑制,引起细胞发生异型增生甚至肿瘤性增生。总之,疣状胃炎较高的Hp感染率、p27蛋白和cyclin D1的异常表达,均提示疣状胃炎具有发展为胃癌的可能性,对此类患者应进行密切随访。
综上所述,本研究提示疣状胃炎具有发展为胃癌的潜能,p27蛋白和cyclin D1可能在疣状胃炎的发生、发展和癌变过程中发挥了一定的作用,但其具体作用机制仍需进一步深入探讨。疣状胃炎(尤其是成熟型)一经内镜检查发现应行病理活检,并给予积极治疗和密切随访。
1 Kawai K,Shimamoto K,Misaki F,et al.Erosion of gastric mucosa--pathogenesis,incidence and classification of the erosive gastritis[J].Endoscopy,1970,2(3):168-174.
2 中华医学会消化病学分会.中国慢性胃炎共识意见[J].胃肠病学,2013,18(1):24-36.
3 许良中,杨文涛.免疫组织化学反应结果的判断标准[J].中国癌症杂志,1996,6(4):229-231.
4 付唆林,吴云林.疣状胃炎的历史、现状与思考[J].国外医学·消化系疾病分册,2005,25(3):155-157.
5 丁世华,刘俊,王建平,等.疣状胃炎与胃癌的关系探讨[J].海南医学,2010,21(9):11-12.
6 Bustany S,Tchakarska G,Sola B.Cyclin D1 regulates p27(Kip1)stability in B cells[J].Cell Signal,2011,23(1):171-179.
7 Wei M,Wang Z,Yao H,et al.P27(Kip1),regulated by glycogen synthase kinase-3β,results in HMBA-induced differentiation of human gastric cancer cells[J].BMC Cancer,2011,11:109.
8 Wei Z,Jiang X,Qiao H,et al.STAT3 interacts with Skp2/p27/p21 pathway to regulate the motility and invasion of gastric cancer cells[J].Cell Signal,2013,25(4):931-938.
9 Lee SR,Shin JW,Kim HO,et al.Determining the effect of transforming growth factor-β1 on cdk4 and p27 in gastric cancer and cholangiocarcinoma[J].Oncol Lett,2013,5(2):694-698.
10 Mattioli E,Vogiatzi P,Sun A,et al.Immunohistochemical analysisofpRb2/p130, VEGF, EZH2, p53, p16(INK4A),p27(KIP1),p21(WAF1),Ki-67 expression patterns in gastric cancer[J].J Cell Physiol,2007,210(1):183-191.
11 Zhang Q,Sakamoto K,Wagner KU.D-type Cyclins are important downstream effectors of cytokine signaling that regulate the proliferation of normal and neoplastic mammary epithelial cells[J].Mol Cell Endocrinol,2013,3(16):1-10.
12 Wiech T,Nikolopoulos E,Lassman S,et al.Cyclin D1 expression is induced by viral BARF1 and is overexpressed in EBV-associated gastric cancer[J].Virchows Arch,2008,452(6):621-627.
13 Gao P,Zhou GY,Liu Y,et al.Alteration of cyclin D1 in gastric carcinoma and its clinicopathologic significance[J].World J Gastroenterol,2004,10(20):2936-2939.
14 Arici DS,Tuncer E,Ozer H,et al.Expression of retinoblastoma and cyclin D1 in gastric carcinoma[J].Neoplasma,2009,56(1):63-67.
15 Cappell MS,Green PH,Marboe C.Neoplasia in chronic erosive(varioliform)gastritis[J].Dig Dis Sci,1988,33(8):1035-1039.
16 姚忆蓉,周中源,徐诗光,等.疣状胃炎82例胃镜随访观察[J].河南医科大学学报,1995,30(4):425-427.

