RELMβ在慢性阻塞性肺疾病患者肺组织中的表达
张茜茜, 李 红, 陈 丽, 陈 庆, 刘升明
(1.河南省人民医院呼吸科,河南郑州450000;暨南大学附属第一医院;2.病理科,3.呼吸科,广东广州510630)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)的特征为持续存在的气流受限,且呈进行性发展,伴有有害颗粒或气体对气道和肺所致慢性炎症反应的增加[1]。COPD作为一种严重影响人类健康的常见病、多发病,具有较高的死亡率和致残率,然而其发病机制至今尚未完全阐明,临床治疗效果亦欠佳,缺乏有效的方法来逆转COPD的进展。抵抗素样分子(resistin like molecules,RELMs)是2000年发现的一个富含半胱氨酸的分泌蛋白家族[2],共有4 个成员:RELMα/FIZZ1/HIMF、RELMβ/FIZZ2、resistin/FIZZ3、RELMγ/FIZZ4;其中 RELMβ和resistin是在人体内表达的抵抗素家族成员[3]。RELMβ作为缺氧诱导有丝分裂因子的类似物,特异表达于肺组织,具有促进肺部炎症、诱导胶原沉积、对肺血管内皮细胞和平滑肌细胞具有促有丝分裂作用及刺激成纤维细胞迁移等功能[4-5]。目前对其研究主要集中在实验性哮喘模型、缺氧性肺血管重塑及肺动脉高压等肺部疾病。本组对COPD患者支气管肺组织中RELMβ的分布和表达进行了研究,从临床角度探讨RELMβ在COPD发生与发展中的作用。
1 研究对象与方法
1.1 研究对象
选择暨南大学附属第一医院2009年3月~2010年9月因肺癌入院行肺叶切除术的患者19例,均未经放疗和化疗,并且无COPD以外的其他肺部疾病及其他系统的慢性疾病。根据2007年中华医学会呼吸病学会 COPD诊断标准[1],将其分为COPD组和对照组,两组的一般临床资料见表1。实验所需的肺组织均取自远离原发灶5 cm以上,肉眼观察无肺癌浸润的外周肺组织,部分肺组织存放于-80℃冰箱中保存备用,另一部分肺组织标本常规福尔马林固定,石蜡包埋。
1.2 研究方法
(1)HE染色 取石蜡切片,60℃烤2 h,二甲苯脱蜡,梯度酒精脱水后,常规HE染色。
表1 两组研究对象一般临床资料比较Table 1 The comparison of general clinical data between two subjects

表1 两组研究对象一般临床资料比较Table 1 The comparison of general clinical data between two subjects
1)FEV1:一秒钟用力呼气容积;2)FEV1%预计值:3)FEV1占预计值的百分比;4)FVC%预计值:用力肺活量占预计值的百分比.
?
(2)免疫组织化学检测RELMβ的表达 参照福州迈新试剂盒推荐的链霉菌抗生物素蛋白-过氧化酶(SP)法免疫组化步骤进行操作。一抗为多克隆兔抗人RELMβ抗体(美国Abcam公司),稀释比例1∶1 000,二抗为生物素化兔抗羊IgG抗体。阴性对照采用磷酸盐缓冲液(PBS)代替一抗,阳性对照使用人结肠癌组织。阳性表达为细胞浆呈棕褐色或棕黄色颗粒样改变。用Image Pro-Plus显微图像分析系统分别测定每张切片阳性颗粒的平均吸光度值(A值),进行分析处理。实验结果以均数±标准差表示。
(3)Western blot法检测RELMβ蛋白的表达使用组织细胞裂解液,冰上操作,提取每个样本的总蛋白后加入1∶5稀释的十二烷基硫酸钠(SDS),经高温使蛋白完全变性、解聚,-20℃保存备用。每个样本的上样量为50 μg,质量分数为15%聚丙烯酰胺凝胶恒压电泳,浓缩胶80 V,分离胶100 V,聚偏二氟乙烯膜(PVDF)转膜,恒流250 mA转膜30 min,脱脂奶粉室温封闭1 h,分别与针对 RELMβ(1∶500 滴度)、β-actin(1∶1 000 滴度)的一抗 4 ℃孵育过夜;加入二抗室温孵育2 h,二抗为辣根过氧化酶标记的羊抗兔IgG。ECL化学发光试剂工作液进行蛋白信号检测。
1.3 统计学处理
采用SPSS 13.0统计软件进行统计学分析,所有计量资料以均数±标准差表示,采用Levene法行方差齐性检验。两样本均数比较采用t检验,相关性采用Pearson等级相关分析。P<0.05具有统计学意义。
2 结果
(1)免疫组化检测RELMβ蛋白表达 RELMβ蛋白表达于胞浆中。结肠癌阳性对照组RELMβ呈强阳性表达。COPD组呈中等程度表达,主要位于肺泡上皮细胞、细支气管上皮细胞、血管内皮细胞及散在的炎症细胞的胞浆中。而肺功能正常组RELMβ蛋白呈弱阳性表达。与肺功能正常组(0.386±0.072)相比,COPD组各种细胞阳性着色表达明显增强(2.657±0.387)(P<0.01),见表2、图1-5。
(2)Western blot检测RELMβ蛋白含量 可见RELMβ条带在阳性对照组、COPD组和肺功能正常组表达呈依次下降,其表达趋势与免疫组织化学检测结果一致,见图6。
(3)相关性分析 COPD组支气管肺组织中RELMβ的表达与吸烟指数呈正相关(r=0.993,P<0.01),与1秒钟用力呼吸容积%(FEV1%)预计值、FEVI/FVC均呈负相关(r值分别为-0.782和-0.632;P值均<0.05)。

图1 -5 肺组织中RELMβ蛋白的表达Fig.1 -5 The expression of RELMβprotein in the lung tissue
表2 肺组织内RELMβ蛋白的表达Table 2 The expression of RELMβ protein in the lung
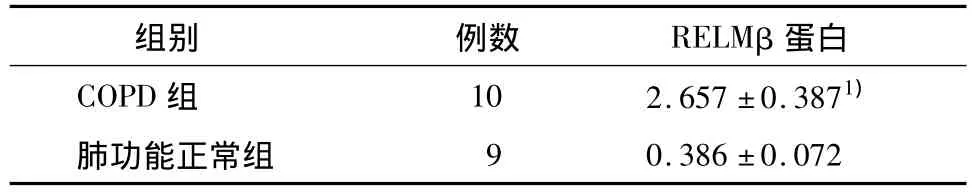
表2 肺组织内RELMβ蛋白的表达Table 2 The expression of RELMβ protein in the lung
1)与肺功能正常组比,P<0.01.
?
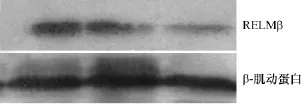
图6 Western blot检测组织内RELMβ的表达Fig.6 Western blot shows the expression of RELMβ in the lung
3 讨论
RELMs(Resistin like molecules)是2000年发现的一个新基因家族,由105-114个氨基酸组成,有3个结构区域:N端信号肽、中间可变区和相对保守的富含11个半胱氨酸的C端序列[6]。该家族的每个成员都有独特的组织分布及严格的生物学功能。RELMα也被称作缺氧诱导有丝分裂因子(HIMF),在啮齿类动物的肺组织内特异性表达;RELMβ起初是一种肠源性的分泌激素维持胃肠道屏障功能的蛋白[2],后研究发现其与缺氧诱导有丝分裂因子在氨基酸序列相似性达58.6%,序列同源性为49.6%。HIMF作为一种新的多效性细胞因子,兼具有炎症因子和生长因子的特性,如刺激肺动脉平滑肌细胞增殖、收缩血管、抗凋亡、生成血管及刺激肌纤维母细胞分化等功能,在多种肺部疾病模型中具有重要意 义[7-8]。Zimmermann 等[9]进 一 步 研 究 发 现,RELMβ作为哮喘标记基因组的一员,是参与粘膜固有炎症反应的重要细胞因子。并作为一种促增殖因子,可能在缺氧性肺血管重塑所致肺动脉高压及与缺氧相关的肺纤维化中起作用[4]。近期 Angelini等[10]发现RELMβ在系统性硬化症所致的肺动脉高压内持续表达,其在血管内皮细胞、平滑肌细胞及α平滑肌肌动蛋白内呈阳性表达,并在巨噬细胞及T细胞内均可见表达。因此,RELMβ作为HIMF的类似物,特异表达于肺组织,具有促进肺部炎症、诱导胶原沉积、对肺血管内皮细胞和平滑肌细胞具有促有丝分裂作用及刺激成纤维细胞迁移等功能[4,10]。
COPD是以气道、肺实质、肺血管的慢性炎症及炎症性损伤和修复造成气道重塑改变为基本病理特征,因而从理论上推测,RELMβ可能参与COPD的慢性炎症反应和早期气道重塑,但目前无相关研究报道。本实验结果证实,在正常支气管粘膜中可观察到有限的RELMβ蛋白表达,而在COPD肺部炎症损伤的支气管粘膜中RELMβ阳性颗粒在肺泡上皮细胞、细支气管上皮细胞、血管内皮细胞及散在的炎症细胞的胞浆中呈中等程度的表达,尤以肺泡上皮细胞为主,此结果提示RELMβ可能参与了COPD的慢性气道炎症,且其表达所在的肺组织结构细胞和炎症细胞部位与 Zimmermann[9]和 Angelini[10]研究哮喘和系统性硬化症的表达结果一致。
众所周知,吸烟是COPD最重要的危险因素,我国吸烟者COPD的患病率明显高于非吸烟者。本实验结果显示,COPD患者的吸烟指数显著高于肺功能正常组(P<0.05);COPD患者肺内RELMβ的表达与吸烟指数呈正相关,与气流受限程度(FEV1%预计值)呈负相关,提示吸烟产生的有毒颗粒和气体可能趋化RELMβ炎症介质的表达,加重COPD的气道炎症。
RELMβ作为一个肺组织内特异性表达的炎症介质,目前对该成员的功能及其调控机制还处于初步研究阶段。COPD患者RELMβ表达的增加,这种现象可能提示RELMβ可能作为一种炎症因子参与COPD的发生发展。进一步阐明RELMβ在COPD慢性气道炎症中的作用,有助于COPD的防治研究。由于本组标本收集所限,未能对COPD患者进行分层分析,尚不能确定其表达增加是否与病情相关,这些还有待于深入研究。
[1]柳 涛,蔡柏蔷.慢性阻塞性肺疾病诊断、处理和预防全球策略(2011年修订版)介绍[J].中国呼吸与危重症杂志.2012,11(1):1 -12.
[2]HOLCOMB I N,KABAKOFF R C,CHAN B,et al.FIZZ1,a novel cysteine-rich secreted protein associated with pulmonary inflammation,defines a new gene family[J].EMBO J,2000,19(15):4046 -4055.
[3]YANG R Z,HUANG Q,XU A,et al.Comparative studies of resistin expression and phylogenomics in human and mouse[J].Biochem Biophys Res Commun,2003,310(3):927-935.
[4]RENIGUNTA A,HILD C,ROSE F,et al.Human RELM beta is a mitogenic factor in lung cells and induced in hypoxia[J].FEBS Lett,2006,580(3):900 -903.
[5]MISHRA A,WANG M,SCHLOTMAN J,et al.Resistin-Like Molecule-Beta Is an Allergen-Induced Cytokine With Inflammatory and Remodeling Activity in the Murine Lung[J].Am J Physiol Lung Cell Mol Physiol,2007,293(2):305-313.
[6]TENG X,LI D,CHAMPION H C,et al.FIZZ1/RELM,a novel hypoxia-induced mitogenic factor in lung with vasoconstrictive and angiogenic properties[J].Circ Res,2003,92(10):1065-1067.
[7]ANGELINI D J,SU Q,KOLOSOVA I A,et al.Hypoxia-Induced Mitogenic Factor(HIMF/FIZZ1/RELMα)Recruits Bone Marrow-Derived Cells to the Murine Pulmonary Vasculature[J].PLoS One,2010,5(6):e11251.
[8]GRAINGE C,DULAY V,WARD J,et al.Resistin-like molecule-β is induced following bronchoconstriction of asthmatic airways[J].Respirology,2012,17(7):1094-100.
[9]ZIMMERMANN N,KING N E,LAPORTE J,et al.Dissection of experimental asthma with DNA microarray analysis identifies arginase in asthma pathogenesis[J].J Clin Invest,2003,111(12):1863 -1874.
[10]ANGELINI D J,SU Q,YAMAJI- KEGAN K,et al.Resistin-like molecule-beta in scleroderma-associated pulmonary hypertension[J].Am J Respir Cell Mol Biol,2009,41(5):553-561.

