22例肺癌射频消融术后的CT随访观察
张红丹, 崔燕海, 赵振军
(广东省医学科学院广东省人民医院1.放射治疗科;2.放射科,广东广州510080)
由于多种原因,相当比例的原发性肺癌以及肺转移癌患者无法通过手术切除治疗。射频消融术(radio-frequency ablation,RFA)作为一种新的局部治疗手段,是在影像导引下利用射频热效应引起瘤体凝固坏死而达到治疗肿瘤的目的,具有微创、安全及可重复进行等优点,近年来临床应用逐渐增多,本文就肺部恶性肿瘤射频消融后的影像学随访表现、临床治疗效果等方面进行总结。
1 材料与方法
1.1 临床资料
收集我院2008年1月至~2012年5月期间行RFA治疗的肺癌患者22例22个病灶,消融灶为原发灶的16例,转移灶6例,病理均为肺腺癌。年龄32~89岁,中位年龄51岁;消融病灶大小7~37 mm,中位大小23 mm。CT随访时间14天~4年,中位时间10个月。其中14例单独RFA治疗,6例联合化疗,1例联合放疗,1例病灶进展后手术切除。所有病例患者本人和家属均签署了知情同意书。
1.2 RFA 操作
设备:射频治疗仪为 R ITA Medical Systems,BLADE RFA-Ⅰ型,工作频率为400 kHz。电极针为Star Burst® XL,Semi-flex,RFA-1315 型电极针。影像引导采用大孔径定位CT(GE 4-MSCT)。RFA操作:先行CT平扫,根据病灶部位决定患者扫描体位(仰卧或俯卧),扫描层厚为5 mm。选择合适的入路(避开肋骨、大血管、肺大疱且距离最短),局部麻醉后(用质量分数为2%利多卡因),在胸壁开0.5 cm的小切口,CT扫描引导下置入射频针达病灶边缘,观察并调整针尖位置到最佳,然后释放锚状电极,复查CT观察电极位置是否满意,如位置不理想,收回后重新释放锚状电极,保证消融灶边缘超过肿瘤边缘0.5~1 cm。消融温度设定在90℃,根据病灶大小,消融时间为10~15 min,消融时可以从电极针注水孔间歇注入生理盐水防止组织碳化。完成肿瘤消融后,对穿刺针道进行消融以防止针道种植。治疗结束后再行CT扫描,明确有无气胸、大出血等并发症。术后常规给予抗感染、止血及激素治疗3 d。
1.3 RFA术后CT随访与评价
采用多层螺旋 CT(GE 8-MSCT或 GE 64-MSCT)于术后1个月(其中1例为术后14 d)及以后每隔3个月对消融灶进行增强CT复查,观察消融灶大小变化及消融灶血供情况。消融灶增大或消融灶区域出现异常强化结节认为是复发;消融灶逐渐缩小或无增大且无异常强化认为是无复发。所有CT图像层厚为1.25 mm,病灶大小的测量在肺窗进行,消融灶血供情况在纵隔窗观察。
2 结果
2.1 并发症
术中多数患者有胸部灼热、胀痛感,但均可耐受。术后出现少量咯血3例,气胸5例,其中1例行胸腔闭式引流术,1例出现大量胸腔积液,2例出现病灶远端炎症。所有患者均没有出现支气管胸膜瘘、大出血及死亡等严重并发症。
2.2 肿瘤疗效评估
CT随访时间14 d~4年,中位时间10个月。随访3个月以上的病例共18例,16例消融灶无复发,2例消融灶复发(其中1例行外科手术切除),复发病灶消融治疗前大小分别为37 mm、20 mm。其中6例联合化疗的病例中有1例消融灶复发,联合放疗的病例无复发(1例)。本组病例消融灶复发率为9.1%(2/22)。
2.3 CT 表现
消融术后即刻CT平扫表现:所有消融灶阴影增大(图1),多数病灶(16/22,72.7%)边缘模糊,病灶密度减低10~20 Hu,5例病灶内出现气泡。术后1个月CT表现:消融灶大小仍较原肿瘤大,增强扫描中心无强化,外周见强化,外缘仍不清晰,2例出现空洞(图2)。术后3个月CT表现:18个病灶中16个体积有不同程度缩小,增强扫描整个消融灶区域无强化,3个月以上CT表现:无复发的病灶消融区明显缩小,有或无周边环绕清晰锐利的强化环;2例复发病灶均出现周边结节样强化,其中1例形成空洞,体积增大。
3 讨论
本文对22例肺癌RFA治疗效果进行评价,参考文献并总结治疗过程中的成功经验与不足;同时对不同时间消融病灶CT随访的变化情况进行总结,以期提高对消融病灶动态变化的认识,更有效的区分消融灶是否有活性癌灶。
RFA原理是使癌肿及周边组织发生凝固性坏死,是目前最为成熟的热损伤治疗技术,在肝脏肿瘤的应用最为广泛、成熟。美国胸科医师协会(American College of Chest Physicians,ACCP)[1]临床指引提出:对于I/II期非小细胞肺癌,不适合手术者应该选择射频消融或立体定向放射治疗,是对RFA在肺部肿瘤治疗效果的肯定。目前国内肺部肿瘤RFA其安全性和疗效值得关注。

图1 51岁男性原发肺腺癌患者Fig.1 A 51-year-old male patient with primary pulmonary adenocarcinoma
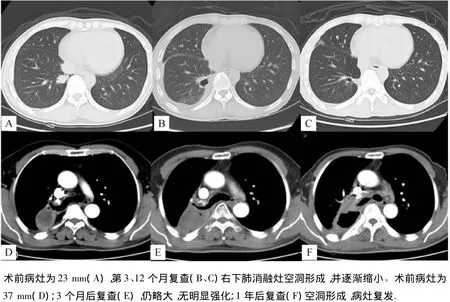
图236 岁女性原发肺腺癌患者(上排);51岁男性原发肺腺癌患者(下排)Fig.2 A 36-year-old female patient with primary pulmonary adenocarcinoma(upper row);A 51-year-old male patient with primary pulmonary adenocarcinoma(lower row)
正常肺部组织含有大量气体,加之丰富的血液循环和呼吸散热,与肿瘤组织有着天然的热绝缘效果,而肿瘤组织为实性且血流量低,散热困难,能量充分集中在病变部位,因此肺肿瘤非常适合射频消融治疗。Zemlyak[2]等比较了不适合肺叶切除的亚肺叶切除和射频消融的治疗结果,显示总生存率和肿瘤特异性生存均无统计学差异。刘东宝报道[3]I/II期肺癌的中位生存时间为28个月,1年生存率82.5%,2年生存率57.7%,死因主要为中晚期肺癌远处转移或者严重合并症(慢性阻塞性肺疾病)。这些研究表明RFA对早期肺癌有良好疗效。
文献报道射频消融后肺癌的局部进展率为3%~38.1%[2]。本组病例消融灶复发率为9.1%(2/22),1例复发病例的肿瘤大小为37 mm(图2下排),可能是肿瘤射频治疗不完整引起的。Wolf[4]等研究表明:当肿瘤直径≤3 cm,完全消融后患者预后最好;肿瘤直径>3 cm,消融术后有复发的倾向。而卢强[5]对436例射频消融的肿块研究表明,当术前肿瘤直径>4 cm,较<4 cm的患者局部进展的比例相对较高,但肿瘤<3 cm的患者与直径介于3~4 cm的患者没有统计学差异,其认为肿块大小为3~4 cm的可以考虑作为射频治疗的标准之一。另外1例复发病例大小为23 mm,可能与治疗过程中电极周围组织因高温产生汽化和碳化,增加了组织阻抗,降低了射频传导聚集和组织凝固坏死程度有关,解决方法是治疗过程中适度注入少量无水乙醇,可防止碳化发生,也有在治疗前注入的报道[6]。
文献报道[7-8]RFA联合化疗或放疗可提高非小细胞肺癌疗效,采用健择联合顺铂为主的化疗方案,发现联合化疗的患者比没有联合化疗者生存率高。本组病例中联合放疗的病例无复发与转移。一般认为放疗对肿瘤边缘的富氧细胞非常有效,但对肿瘤中心区的乏氧细胞效果较差,而这部分肿瘤细胞容易被射频消融杀死,因此两者具有互补作用。本组联合化疗者复发1例,为37 mm肿瘤大小的病例,分析原因为病灶过大消融不完全所致。这可能提示病灶是否彻底消融是决定疗效的主要因素,而化疗为相对次要因素。
CT是评价肺癌RFA疗效的最常用检查。射频消融结束后5 min CT扫描病灶阴影增大,可能与瘤组织凝固性坏死、水肿、出血和周围急性炎性反应有关。1~3个月内病灶仍增大,该时期病灶及周围反应性充血、纤维组织增生一般还未消失,一般认为近期(1个月)内CT评价存在缺陷,CT依据病灶大小及密度变化难以与肿瘤残留或复发相鉴别,此时宜采用氟-氟脱氧葡萄糖-正电子发射断层显像(18F-FDG-PET)评价。3个月后消融灶逐渐缩小,增强CT可见肿瘤坏死区明显缩小,其周边环绕清晰锐利且光滑的强化环,表明无活性肿瘤残留;当出现异常结节样强化或病灶再次增大时提示肿瘤复发[6,8-9]。本组病例同样以出现结节样强化或病灶增大为复发标准,有2例复发,其中1例形成伴有结节的厚壁空洞。
RFA并发症出现几率较少、较轻,最常见的是气胸,文献报道[6,8-9]发生率约为 19% ~50%;在本研究中,气胸发生率约为22.7%,少量气胸无需处理,中等量者经胸腔闭式引流处理可很快痊愈;其它较常见的并发症还包括:胸腔积液、病灶远端炎症,少量肺出血、咯血等。文献报道[8]严重的并发症少见,包括支气管胸膜瘘、大出血及死亡等和心包填塞等。有研究表明[5]:射频治疗时间超过3 h,患者出现并发症的几率大大增加。因此,射频消融治疗时间应尽可能缩短。本文结果显示RFA在肺肿瘤的治疗中具有良好的安全性。尽管RFA方法相对安全,文献报道30 d内的死亡率为0.4% ~2.6%[5],提示原病灶有空洞时,射频消融将扩大原空洞范围,容易导致不可抗拒的大出血而引起患者死亡;肿瘤位置靠近肺门时,进针时也容易导致大出血。因此,射频消融治疗应该选择合适标准的患者,并且需要在有正规培训及有相当经验的临床医师的指导下行操作。
总之,CT引导下射频消融治疗肺癌具有安全、有效、微创的优点,是不能耐受手术的肺癌患者的选择之一。
[1]SCOTT W J,HOWINGTON J,FEIGENBERG S,et al.Treatment of non-small cell lung cancer stage I and stage II:ACCP evidence-based clinical practice guidelines(2nd Edition)[J].Chest,2007,132(Suppl3):234 -242.
[2]ZEMLYAK,MOORE W H,BILFINGER T V.Comparison of survival after sublobar resections and ablative therapies for stage I non-small cell lung cancer[J].J Am Coll Surg,2010,211(1):68-72.
[3]刘宝东,刘 磊,李 岩,等.射频消融治疗100例肺部肿瘤的远期疗效[J].中国肺癌杂志,2011,14(4):335-339.
[4]WOLF F J,GRAND D J,MACHAN J T,et al.Microwave ablation of lung malignancies:effectiveness,CT findings,and safety in 50 patients[J].Radiology,2008,247(3):871-879.
[5]卢 强,李小飞,韩 勇,等.射频消融治疗329例肺部恶性肿瘤临床安全及疗效的研究[J].中国肺癌杂志,2011,14(11):865-869.
[6]张开贤,李 苓,邢 超,等.CT引导射频消融术治疗非小细胞肺癌35例[J].中华肿瘤防治杂志,2010,17(18):1484-1486.
[7]陈理明,王少彬,陈俊辉,等.射频消融治疗肺癌的预后及其影响因素分析[J].中国肿瘤临床与康复,2007,14(4):320-323.
[8]王忠敏,陈克敏,贡 桔,等.CT引导下射频消融治疗肺部恶性肿瘤的临床应用[J].介入放射学杂志,2009,18(5):335-339.
[9]杨津毅,许相丰,张增利.CT引导经皮射频消融术对肺部肿瘤的治疗效果[J].实用医学影像杂志,2010,11(5):335-340.

