高效的红细胞特异性表达系统的建立和优化
潘 欣,田 爱,王熙才,狄升蒙,张胜男,张艳磊,易红飞,赵晓杰,黄 进,张鸿声
血友病B是一种人凝血因子Ⅸ(human factorⅨ,hFⅨ)基因缺陷引起的X染色体连锁隐性遗传的出血性疾病。目前使用的蛋白替代疗法(protein replacement therapy)虽能提高患者生存质量、延长寿命,但需终生用药,且存在经济和血液安全等多方面问题。部分患者会产生抗体,中和外源hFⅨ;一些重症患者因为基因突变,免疫系统不能耐受治疗性蛋白,而将其作为新的抗原递呈给免疫系统,导致无效治疗,出血难以控制[1]:这些因素迫使研究人员采用新的治疗策略。人体hFⅨ的质量浓度正常生理水平为5 000 ng/ml,血浆hFⅨ质量浓度达到正常值的1%就可减轻症状,达到5%可基本正常生活,达到25%可完全正常学习工作,即相对温和地增加较少的基因产物,患者就可以获得显著的治疗收益,因而血友病成为基因治疗研究的首选疾病模型[2]。
能够与宿主基因组整合的病毒系统目前仍是主导血友病基因治疗研究领域的重要工具。以人类免疫缺陷病毒-1(human immunodeficiency virus-1,HIV-1)为代表的自灭活(self-inactivation,SIN)慢病毒载体(lentiviral vector,LV)既可感染分裂细胞,也可感染非分裂细胞,具有携带基因片段容量较大、目的基因长时间稳定表达、不易诱发宿主免疫反应等优势,已成为基因治疗中较理想的基因转移载体。使用红细胞特异性慢病毒载体可使导入的hFⅨ在造血干细胞(hematopoietic stem cell,HSC)向红细胞分化过程中长期分泌[3]。
本研究使用的LV是第3代三质粒表达载体[4],其中转移质粒(transfer plasmid)中 3'LTR(长末端重复序列)删除U3区增强子和启动子序列,使载体不再有HIV-1启动/增强活性,成为可携带外源基因的SIN慢病毒载体。
小鼠红白血病(murine erythroleukemia,MEL)细胞是弗氏病毒感染敏感小鼠脾脏后细胞转化获得的原红细胞株(proerythroblast)。MEL细胞在培养过程中,当加入环六亚甲基双乙酰胺(N,N'-hexamethylene bisacetamide,HMBA)或二甲基亚砜(dimethyl sulfoxide,DMSO)等化学诱导剂时,可向红系终端分化为成熟的红细胞[5-6]。MEL细胞的这种特性为在终末分化期间研究基因表达变化特征提供了一个适合的模型。由于红细胞的发生有可诱导性,且分化终端不含细胞核、不携带基因组,可以进一步提高慢病毒转染红系祖细胞后诱导分化终产物的安全性,因此成为本研究中的细胞模型。
为了控制外源基因过表达,本研究构建了一系列红细胞特异性基因调控元件控制hFⅨ表达的慢病毒载体,旨在通过适当减少调控元件,优化慢病毒载体,从而提高携带外源基因片段的长度,增加载体制备的有效性,并充分满足外源基因表达在治疗水平的需求量。本研究还探讨了药物筛选在富集重组慢病毒感染阳性细胞中的重要作用,为今后利用红细胞特异性重组慢病毒载体在动物实验中开展靶向基因治疗的应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒 大肠埃希菌DH5α、包装质粒psPAX2、包膜蛋白质粒 pMD2.G、转移质粒 RT9-hFⅨ-SI-MGMT[以下简称RT9;MGMT为甲基鸟嘌呤甲基转移酶(methylguanine methyltransferase)]、转移质粒 RS9-hFⅨ-SI-MGMT(以下简称 RS9)、转移质粒RT10-hFⅨ-SI-MGMT(以下简称RT10),上海市肺科医院临床转化中心实验室保存。
1.1.2 细胞系 人肾胚胎(human embryonic kidney,HEK)293T细胞、MEL细胞、小鼠成纤维细胞NIH/3T3、稳定表达对照病毒 RRL-sEF1α-GFPLuc的NIH/3T3细胞,上海市肺科医院临床转化中心实验室保存。
1.1.3 试剂 各种限制性内切酶为美国New England Biolabs公司产品,达尔伯克改良伊格尔培养基(Dulbecco's modified Eagle's medium,DMEM)、AIMV培养基、胎牛血清(fetal bovine serum,FBS)为美国Invitrogen Gibco公司产品,O6-苄基鸟嘌呤(O6-benzylguanine,BG)、卡莫司汀[1,3-bis(2-chloroethyl)-1-nitrosourea,BCNU]、HMBA、聚乙烯亚胺(polyethylenimine,PEI)、聚凝胺(polybrene)、L-谷氨酰胺和小鼠抗人hFⅨ单抗为瑞士Sigma公司产品,青霉素和链霉素溶液(以下简称双抗)为美国Hyclone公司产品,InstaGene Matrix为美国Bio-Rad公司产品,荧光定量(TaqMan)快速聚合酶链反应(polymerase chain reaction,PCR)混合试剂盒(2×)为美国ABI公司产品,哺乳动物细胞总蛋白抽提试剂(mammalian protein rxtraction reagent,M-PER)、2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid,BCA)蛋白定量分析试剂盒为美国Pierce公司产品,辣根过氧化物酶标记的山羊抗小鼠IgG为加拿大Affinity Biologicals公司产品,辣根过氧化物酶的2,2-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二铵盐[2,2-Azinobis-(3-ehtylbenzothiazolin-6-sulfnic-acid)diammonium salt,ABTS]底物为美国Zymed公司产品。
1.2 方法
1.2.1 慢病毒转移载体的设计和制备 RT10的结构(图1 RT10)中,编码hFⅨ的cDNA和一段短内含子受 β-珠蛋白启动子(promoter,P;707 bp)、β-珠蛋白 3'端增强子(enhancer,E;约 879 bp)、β-珠蛋白内含子IVS2(约476 bp)和β-珠蛋白位点控制区(locus control regions,LCR)调控。载体中的LCR结构包括:1 072 bp的 HS4,1 296 bp的 HS3,839 bp的HS2,1 089 bp的HS1。由人类磷酸甘油酸激酶启动子(phosphoglycerate kinase promoter,PGK-P)控制的MGMT-P140K突变基因cDNA位于载体的3'-末端。应用不同的限制性内切酶及DNA重组技术构建各种以hFⅨ为目的基因、由不同调控元件控制、由RT10衍生的慢病毒转移载体。
1.2.2 重组慢病毒包装 用三质粒系统瞬时转染HEK 293T细胞制备疱疹性口炎病毒的包膜糖蛋白(vesicular stomatitis virus envelope glycoprotein,VSV-G)假型慢病毒颗粒[7]。当HEK 293T细胞在10 cm细胞培养皿中生长达80%~90%汇合时,弃含双抗(青霉素终质量浓度为50 U/ml,链霉素终质量浓度为50 mg/ml)的完全DMEM培养基(含10%FBS),用PEI转染三质粒混悬液(在1 ml无血清无抗生素DMEM 中混合 1 μg psPAX2、2 μg pMD2.G、4 μg 转移质粒和24 μl pH 7.0 的1 μg/μl PEI)于用9 ml含
10%FBS和2 mmol/L L-谷氨酰胺的完全培养基覆盖的HEK 293T细胞。24 h后弃上清,换预热的新鲜完全培养基,分别于48 h和96 h收获细胞培养上清中的病毒液,500×g 10 min除去脱落的细胞和大的细胞碎片,用0.45 μm滤器过滤上清,滤液经8 500×g 12 h离心浓缩病毒颗粒。用无血清AIMV培养基重悬病毒颗粒,分装至冻存管,-80℃保存备用。重组慢病毒以载体名称命名。
1.2.3 重组慢病毒滴度测定 用终质量浓度为8 μg/ml Polybrene介导重组病毒颗粒转染小鼠成纤维细胞NIH/3T3,培养7 d后,用InstaGene Matrix抽提基因组 DNA。稳定表达对照病毒 RRL-sEF1α-GFPLuc的NIH/3T3细胞基因组为对照。两套引物、探针联合使用,采用多重TaqMan PCR检测病毒滴度[8]。慢病毒序列检测所用的引物探针为:正向引物 GAG-F,5'-GGAGCTAGAACGATTCGCAGTTA-3';反向引物GAG-R,5'-GGTTGTAGCTGTCCCAGTATTTGTC-3';探针 GAG-P,5'-[FAM]ACAGCCTTCTGATGTTTCTAACAGGCCAGG[TAMRA]-3'。小鼠 β-actin(简称 BAC)为内源性对照,正向引物 BAC-F,5'-GGCACCACACCTTCTACAATG-3';反向引物BAC-R,5'-GGGGTGTTGAAGGTCTAAAC-3';探针 BAC-P,5'-[HEX]TGTGGCCCCTGAGGAGCACCC[BHQ1]-3'。使用美国Applied Biosystems公司的7500 PCR仪,每个定量PCR反应中基因组DNA总共使用100 ng(1×TaqMan快速PCR混合试剂,500 nmol/L基因特异性正、反向引物和探针),每组反应设3个重复。在SDS 2.1软件中设置定量PCR反应程序为95℃ 10 min热启动;PCR反应 94℃ 15 s,60℃ 1 min,共 40 个循环[9]。
已知稳定表达对照病毒RRL-sEF1α-GFPLuc的NIH/3T3每个细胞有1个慢病毒载体拷贝数(vector copy number,VCN),其基因组DNA用未感染慢病毒的NIH/3T3细胞基因组DNA进行5倍系列稀释后,通过定量PCR,获得慢病毒转染的VCN。病毒滴度(titer,T)计算公式:T(U/ml)=VCN×稀释倍数×起始细胞数[10]。
1.2.4 BG-BCNU筛选 为有效富集阳性转染细胞的比例,MEL细胞经重组慢病毒转染后,先与指定浓度的BG孵育1 h,再加指定浓度的BCNU于37℃共孵育1 h。其中BG终浓度在各实验组中均保持恒定,为50 μmol/L,对照组BG 终浓度为0 μmol/L;BCNU 终浓度分别为 0、25、50、100 μmol/L;1 h 后换预热的不含药物的新鲜培养基,以后每3 d换1次培养液,移除悬浮细胞。筛选14 d后进行后续实验。
MEL细胞在用5 mmol/L HMBA诱导的第0天,收获1×106cells,抽提基因组DNA,用多重Taq-Man PCR检测病毒滴度,以评估BCNU有效筛选的终浓度。
1.2.5 免疫检测hFⅨ的浓度 取BG-BCNU筛选后的细胞,用5 mmol/L HMBA诱导8 d,诱导过程中每日收获1×106cells,抽提细胞总蛋白,hFⅨ在细胞样品中的浓度用酶联免疫吸附测定(enzymelinked immunosorbent assay,ELISA)检测。简单地说,96孔板用小鼠抗人hFⅨ单抗1∶800包被。各孔用含5%FBS的磷酸缓冲液封闭。细胞总蛋白样品用含2%FBS的磷酸缓冲液稀释到标准曲线线性范围内的浓度。辣根过氧化物酶标记的山羊抗小鼠IgG为二抗,1∶800稀释。加入ABTS底物后,96孔板在单波长415 nm处检测。
1.3 统计学处理 数据使用GraphPad Prism 5软件进行配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 红细胞特异性慢病毒表达载体的构建和鉴定限制性酶谱鉴定和测序分析结果显示,红细胞特异性慢病毒表达载体 RT10、RT9、RS9、RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-),包装质粒 psPAX2和包膜蛋白质粒pMD2.G结构均正确。重组慢病毒载体中RT10包含完整的调控元件,即编码人hFⅨ的cDNA和一段短内含子由β-珠蛋白启动子、β-珠蛋白3'端增强子和β-珠蛋白基因位点控制区调控,MGMT-P140K突变基因由人PGK-P控制;RT9删除了LCR的HS1元件;RS9在RT9基础上将β-珠蛋白启动子从707 bp删减到315 bp;RT9-HS4(-)是在RT9基础上又删除了LCR中的HS4元件;RT9-IVS2是在RT9基础上删除了β-珠蛋白内含子IVS2部分序列;RT9-E(-)是在RT9基础上删除了β-珠蛋白3'端增强子(图1)。

图1 慢病毒转移质粒结构图
2.2 重组慢病毒滴度检测 重组慢病毒载体分别与包装质粒psPAX2和包膜蛋白质粒pMD2.G经PEI介导瞬时共转染293T细胞获得重组慢病毒,经8 500×g 12 h离心浓缩后,用多重TaqMan PCR测得重组慢病毒滴度如图2所示。
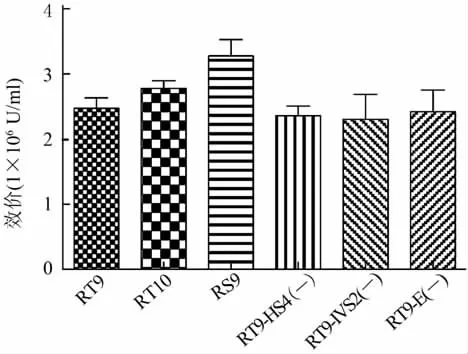
图2 重组慢病毒滴度
RT9的滴度是(2.47±0.28)×106U/ml;RT10的滴度是(2.78±0.20)×106U/ml,是RT9的1.12倍(P=0.294 6);RS9的滴度是(3.28±0.44)×106U/ml,是RT9的1.33倍(P=0.190 7);RT9-HS4(-)的滴度是(2.36±0.25)×106U/ml,是 RT9的 0.96倍(P=0.575 6);RT9-IVS2(-)的滴度是(2.30±0.67)×106U/ml,是 RT9 的 0.93 倍(P=0.584 9);RT9-E(-)的滴度是(2.42±0.58)×106U/ml,是 RT9的0.98倍(P=0.883 8)。6组重组慢病毒滴度两两之间差别均无统计学意义(P=0.132 7),提示适当删除部分调控元件不影响病毒包装效率。
2.3 BCNU对病毒滴度的影响 为了检测BCNU筛选所需的有效浓度,各组以复合感染(multiplicity of infection,MOI)=10的重组慢病毒转染MEL细胞,经0 μmol/L 或50 μmol/L 的 BG 处理1 h后,再分别加0 μmol/L 的 BCNU 或 25、50、100 μmol/L 的BCNU共孵育1 h,换不含药物的完全培养基筛选14 d,用多重TaqMan PCR检测病毒滴度,结果如图3。随着BCNU浓度的升高,被药物选择出来的细胞中病毒滴度与未选择细胞0 μmol/L BG-0 μmol/L BCNU相比明显增加。当使用BCNU的浓度达到25 μmol/L 时(图 3),RT9、RT10、RS9、RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-)的重组病毒滴度分别是未选择细胞的 23.9、8.59、12.59、3.72、1.23、12.48倍(P=0.002 7);50 μmol/L时,是未选择细胞的29.6、13.36、11.07、3.61、1.60、12.95 倍 (P=0.000 2);100 μmol/L 时,是未选择细胞的 32.90、12.63、12.26、3.70、2.56、13.67 倍(P < 0.000 1)。而BCNU 50 μmol/L的筛选浓度与25 μmol/L的相比较并无统计学意义(P=0.208 4),与100 μmol/L的筛选浓度相比较也无统计学意义(P=0.205 1);BCNU 100 μmol/L的筛选浓度与25 μmol/L的相比较也无统计学意义(P=0.122 1)。提示BCNU 50 μmol/L可能是比较合适的筛选浓度。
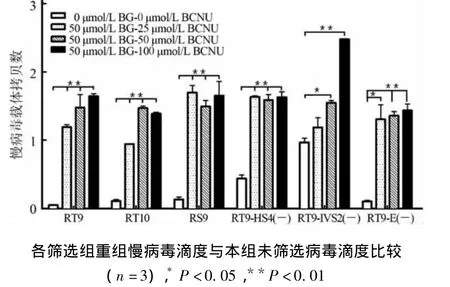
图3 不同浓度BG-BCNU选择对MEL细胞中重组慢病毒拷贝数影响
2.4 重组慢病毒转染MEL细胞后hFⅨ表达水平的测定 MEL细胞以MOI=10分别感染各包装浓缩的重组慢病毒,经不同浓度BG-BCNU筛选14 d后,用5 mmol/L的HMBA诱导向红细胞分化,每24 h用ELISA方法检测hFⅨ在红细胞分化期间的表达水平,共检测8 d,结果如图4。未经BG-BCNU选择的(以下简称未选择)分别感染RT9、RT10、RS9、RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-)的 MEL细胞经HMBA诱导8 d,hFⅨ的表达水平分别为4.31、7.20、6.46、35.58、3.80、0 ng/(ml·106cells);用 50 μmol/L BG-25 μmol/L BCNU 选择后,经 HMBA诱导,各重组慢病毒在第8天hFⅨ的表达水平分别为83.48、99.17、124.78、99.28、38.36、36.54 ng/(ml·106cells),是未选择的 MEL细胞经 HMBA诱导8 d 的 19.37、13.77、19.32、2.79、10.09、36.54倍(P=0.003 2)。用 50 μmol/L BG-50 μmol/L BCNU选择后,经HMBA诱导,各重组慢病毒在第8天hFⅨ的表达水平分别是为175.27、270.16、228.12、140.32、149.46、123.24 ng/(ml·106cells),是未选择诱导第 8 天的 40.67、37.52、35.32、3.94、39.33、123.24 倍(P=0.001 0);分别是 50 μmol/L BG-25 μmol/L BCNU选择、HMBA诱导第8天hFⅨ表达水平的2.10、2.72、1.83、1.41、3.90、3.37 倍(P=0.002 1)。用50 μmol/L BG-100 μmol/L BCNU 选择后,经 HMBA诱导,各重组慢病毒在第8天hFⅨ的表达水平分别为 199.93、286.63、205.75、162.71、142.58、150.14 ng/(ml·106cells),均值达到生理水平的3.8%(191 ng/ml),是未选择诱导第 8天的 46.39、39.81、31.85、4.57、37.52、150.14 倍(P=0.029 3);分别是 50 μmol/L BG-50 μmol/L BCNU 选择、HMBA 诱导第8天 hFⅨ表达水平的 1.14、1.06、0.90、1.16、0.95、1.22 倍(P=0.054 0)。提示 50 μmol/L BG-50 μmol/L BCNU选择已能够筛选富集足够的阳性细胞用于后续的HMBA诱导和hFⅨ表达检测。

图4 不同浓度BG-BCNU选择对诱导MEL细胞中hFIX表达水平的影响
2.5 各重组慢病毒载体结构对hFⅨ表达浓度的影响 在HMBA诱导的第0天,将50 μmol/L BG-50 μmol/L BCNU选择的各重组慢病毒感染的MEL细胞用多重TaqMan PCR检测重组VCN,将滴度HMBA诱导第8天的各重组慢病毒表达的hFⅨ换算成单病毒拷贝的表达量,结果如图5所示。

图5 50 μmol/L BG-50 μmol/L BCNU选择后诱导MEL细胞,各重组慢病毒单拷贝表达的hFⅨ水平
慢病毒转移载体RT10调控结构完整,单拷贝病毒在诱导第8天MEL细胞中表达的hFⅨ水平是LCR中缺失HS1和HS4的RT9-HS4(-)的2.08倍(P=0.003 7);RS9为缩短的启动子,但表达的hFⅨ水平明显提高,是RT9-HS4(-)的1.73倍(P=0.022 1);RT9表达的hFⅨ水平是RT9-HS4(-)的1.36倍(P=0.185 5);RT9-IVS2(-)表达的hFⅨ水平为RT9-HS4(-)的1.09倍(P=0.263 9);RT9-E(-)表达的hFⅨ水平为 RT9-HS4(-)的 1.03倍(P=0.204 8)。RT9、RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-)4组重组慢病毒在诱导的MEL细胞中hFⅨ的表达水平两两之间差异均无统计学意义(P=0.152 7)。提示在删除LCR中的HS1的基础上再删除HS4或IVS2或E,不再降低目的基因的表达。
3 讨论
红细胞(red blood cell,RBC)是一种重要的输血产品(transfusion product,TP),其来源主要有成人血液、干细胞(包括胚胎干细胞和诱导性多能干细胞)和重编程体细胞。RBC除了行使输氧的生理功能外,近年来以之作为生物活性物质的生物相容性载体广泛应用于抗体识别、药物发现和药物输送等方面[11]。其主要是因为[12]:①RBC 可被完全生物降解而不产生毒性产物,尤其是使用自体RBC时表现出更高的生物相容性;②RBC很容易通过药物诱导的细胞内吞作用、电穿孔、低渗方法、蛋白质转导结构域(protein transduction domain,PTD)[13]或慢病毒转染HSC等几种技术处理来封装不同的分子,而RBC的形态学、免疫学和生化性质不受影响;③可利用RBC较大的体积来封装药物;④RBC可保护封装的物质不至于过早失活、降解,保护机体不受药物的毒性影响;⑤与其他合成的载体相比,RBC在循环系统中的寿命较长;⑥由于存在几种酶活性,RBC可以作为活性运载蛋白(生物反应器),将选定的前体药物转换成可扩散的活性药物。本研究在生物安全实验室按生物安全操作规程完成全部实验[14],用红细胞特异性重组慢病毒感染小鼠MEL细胞,经筛选、诱导后,在分化的终端红细胞中检测到了hFⅨ的表达。
MGMT的基因产物O6-烷基鸟嘌呤-DNA-烷基转移酶(O6-alkylguanine-DNA-alkyltransferase,AGT)可修复甲基亚硝脲等烷化剂造成的DNA烷化损伤。化疗药物1,3-二(2-氯乙基)-1-亚硝基脲,别名为双氯乙亚硝脲,通用名为卡莫司汀,具有强烈的干细胞毒性。BG可使内源性AGT失活,提高对烷化剂的敏感性。体外实验表明用慢病毒将MGMT突变体(G156A或P140K)导入造血祖细胞能够产生更强的抗BG-BCNU联合处理的效应[15]。本研究结果提示,用 50 μmol/L BG-50 μmol/L BCNU 可有效筛选富集携带MGMT基因的重组慢病毒感染的MEL阳性细胞。
血红蛋白是由珠蛋白和血红素组成的结合蛋白,人类珠蛋白基因包括类α-珠蛋白基因(α-like globin gene)和类β-珠蛋白基因(β-like globin gene)两类。人类β-珠蛋白基因座由多个基因成簇排列,具有红系组织和不同发育时相的特异性。β-珠蛋白基因的表达调控,不仅需要近侧顺式元件(β-启动子、β-内含子及3'端增强子等)的参与,还需要LCR的作用。β-珠蛋白启动子全长约2.1 kb,各种缩短的 β-珠蛋白启动子如 110 bp、130 bp、266 bp、280 bp、333 bp、373 bp、615 bp、1.6 kb 等均有不同程度的转录调节活性[16]。β-珠蛋白有2个内含子,其中第2个内含子(intervening sequence 2,IVS2),约476 bp,含有AT富含区(AT-rich region,ATR)和内含子增强子活性[17]。LCR由5个红系特异和发育稳定的DNaseⅠ高敏位点组成,约21.5 kb,其主要的功能是激活β-珠蛋白基因簇,限制珠蛋白基因仅在红系细胞中表达,可远距离调控基因转录,确保受调控基因在发育或分化过程中以一定的时序和模式正确表达,是珠蛋白基因表达的重要调控元件[18]。LCR中HS2的增强子活性最强,HS3的染色质开放活性最强[19],HS4也具有增强子活性;HS5具有绝缘子作用,可以有效阻止红细胞中β-珠蛋白基因座周围的异染色质区域的延伸;HS1的功能尚待确定。
本研究用β-珠蛋白的基因调控元件控制hFⅨ在药物筛选后诱导的MEL细胞向红系分化过程中表达,结果提示 RT9、RT10、RS9、RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-)各重组慢病毒感染组在用 50 μmol/L BG-100 μmol/L BCNU 化疗药物选择后,经HMBA诱导第8天在106个MEL细胞中hFIX的表达量分别达到其生理水平(5 000 ng/ml)的 4%(199.93 ng/ml)、5.7%(286.63 ng/ml)、4.1%(205.75 ng/ml)、3.2%(162.71 ng/ml)、2.8%(142.58 ng/ml)和 3%(150.14 ng/ml),其均值达到3.8%(191 ng/ml)。提示RT9中删除HS1,或在删除HS1的同时缩短β-珠蛋白启动子得到的RS9,以及在删除HS1的同时删除HS4或IVS2或E分别得到的RT9-HS4(-)、RT9-IVS2(-)和RT9-E(-)均可以在细胞水平实现hFⅨ的温和提高。这些效应在动物体内是否一致还有待后续进一步实验。本研究得到的红细胞特异性重组慢病毒为后续动物实验靶向基因治疗奠定了基础。
[1]Franchini M,Frattini F,Crestani S,et al.Haemophilia B:current pharmacotherapy and future directions[J].Expert Opin Pharmacother,2012,13(14):2053-2063.
[2]Petrus I,Chuah M,VandenDriessche T.Gene therapy strategies for hemophilia:benefits versus risks[J].J Gene Med,2010,12(10):797-809.
[3]Chang AH,Stephan MT,Sadelain M.Stem cell-derived erythroid cells mediate long-term systemic protein delivery[J].Nat Biotechnol,2006,24(8):1017-1021.
[4]Hu B,Tai A,Wang P.Immunization delivered by lentiviral vectors for cancer and infectious diseases[J].Immunol Rev,2011,239(1):45-61.
[5]Estefanía MM,Ganier O,Hernández P,et al.DNA replication fading as proliferating cells advance in their commitment to terminal differentiation[J].Sci Rep,2012,2:279.
[6]Melloni E,Pontremoli S,Michetti M,et al.Protein kinase C activity and hexamethylenebisacetamide-induced erythroleukemia cell differentiation[J].Proc Natl Acad Sci U S A,1987,84(15):5282-5286.
[7]Demaison C,Parsley K,Brouns G,et al.High-level transduction and gene expression in hematopoietic repopulating cells using a human immunodeficiency[correction of imunodeficiency]virus type 1-based lentiviral vector containing an internal spleen focus forming virus promoter[J].Hum Gene Ther,2002,13(7):803-813.
[8]Chang AH,Stephan MT,Lisowski L,et al.Erythroid-specific human factorⅨdelivery from in vivo selected hematopoietic stem cells following nonmyeloablative conditioning in hemophilia B mice[J].Mol Ther,2008,16(10):1745-1752.
[9]Pan X,Tamilselvam B,Hansen EJ,et al.Modulation of iron homeostasis in macrophages by bacterial intracellular pathogens[J].BMC Microbiol,2010,10:64.
[10]Chang AH,Sadelain M.The genetic engineering of hematopoietic stem cells:the rise of lentiviral vectors,the conundrum of the ltr,and the promise of lineage-restricted vectors[J].Mol Ther,2007,15(3):445-456.
[11]Migliaccio AR,Whitsett C,Papayannopoulou T,et al.The potential of stem cells as an in vitro source of red blood cells for transfusion[J].Cell Stem Cell,2012,10(2):115-119.
[12]Biagiotti S,Paoletti MF,Fraternale A,et al.Drug delivery by red blood cells[J].IUBMB Life,2011,63(8):621-631.
[13]Kwon YM,Chung HS,Moon C,et al.L-Asparaginase encapsulated intact erythrocytes for treatment of acute lymphoblastic leukemia(ALL)[J].J Control Release,2009,139(3):182-189.
[14]Pan X.Isolator system for laboratory infectious animals[M]//Priti Kumar Roy.Insight and control of infectious disease in global scenario.Croatia:In Tech Press,2012:61-78.
[15]Zielske SP,Reese JS,Lingas KT,et al.In vivo selection of MGMT(P140K)lentivirus-transduced human NOD/SCID repopulating cells without pretransplant irradiation conditioning[J].J Clin Invest,2003,112(10):1561-1570.
[16]Hanawa H,Hargrove PW,Kepes S,et al.Extended betaglobin locus control region elements promote consistent therapeutic expression of a gamma-globin lentiviral vector in murine beta-thalassemia[J].Blood,2004,104(8):2281-2290.
[17]Buzina A,Lo MY,Moffett A,et al.Beta-globin LCR and intron elements cooperate and direct spatial reorganization for gene therapy[J].PLoS Genet,2008,4(4):e1000051.
[18]Peterson KR,Fedosyuk H,Harju-Baker S.LCR 5'hypersensitive site specificity for globin gene activation within the active chromatin hub[J].Nucleic Acids Res,2012,40(22):11256-11269.
[19]Patrinos GP,de Krom M,de Boer E,et al.Multiple interactions between regulatory regions are required to stabilize an active chromatin hub[J].Genes Dev,2004,18(12):1495-1509.
——一道江苏高考题的奥秘解读和拓展

