生物燃料电池酶电极的研究进展
侯秀璋,马晓燕,惠昱晨,常 海
(1西北工业大学空间应用物理与化学教育部重点实验室,陕西省高分子科学与技术重点实验室,陕西 西安710129;2西安近代化学研究所,陕西 西安 710065)
酶生物燃料电池是直接利用酶进行催化燃料氧化,将生物质化学能转化为电能的一种装置,是一种真正意义上的能量转化率高、生物相容性好、工作环境温和、原料可再生的绿色能源,并有望应用在疾病诊疗、环境保护以及航空航天等领域。但酶生物燃料电池由于使用寿命短、功率密度低或输出电流小等缺点,目前还处于理论研究阶段,尚未实现大规模的商业化应用。酶生物燃料电池的效率与酶电极的结构直接相关,其中起决定作用的包括氧化还原酶的特性、电池中电子传递方式以及酶在电极上的固定等因素。本文主要对目前文献报道的生物燃料电池酶电极中氧化还原酶的种类、影响电子传递的因素以及酶的固定化等方面的研究进展进行了分析归纳,并提出了今后的发展趋势。
1 氧化还原酶
在酶生物燃料电池中,酶可以溶解在底物燃料中或是固定在电极上,由于酶在电极上固定可以减少酶的流失提高催化效率,并且受外环境影响小,因此具有更广泛的应用。图1是一个单极室葡萄糖-O2生物燃料电池。中介体吡咯并喹啉(PPQ)修饰的葡萄糖氧化酶(GOx)电极作为电池的阳极,固定马来酰亚胺(COx)修饰的细胞色素氧化酶(Cytc)作为阴极。电池工作时,GOx的辅酶因子FAD(黄素腺嘌呤二核苷酸)穿过酶外壳扩散出来,与固定在电极上的中介体以共价键合的方式结合,使葡萄糖最终转化为葡萄糖酸,产生的电子通过中介体传递到电极上,H+扩散到阴极;在阴极区,O2从电极上得到电子,在COx修饰的Cytc的作用下与H+反应,生成H2O。
在早期研究中,大多数生物燃料电池只是在阳极使用生物氧化酶,而阴极与一般的燃料电池一样是以氧气作为氧化剂,这种生物燃料电池至今仍在研究中。近年来的研究发现,在阴极使用还原酶构筑生物燃料电池可以提高电池的功率密度,因此这也成为该领域的研究热点。
1.1 阳极氧化酶
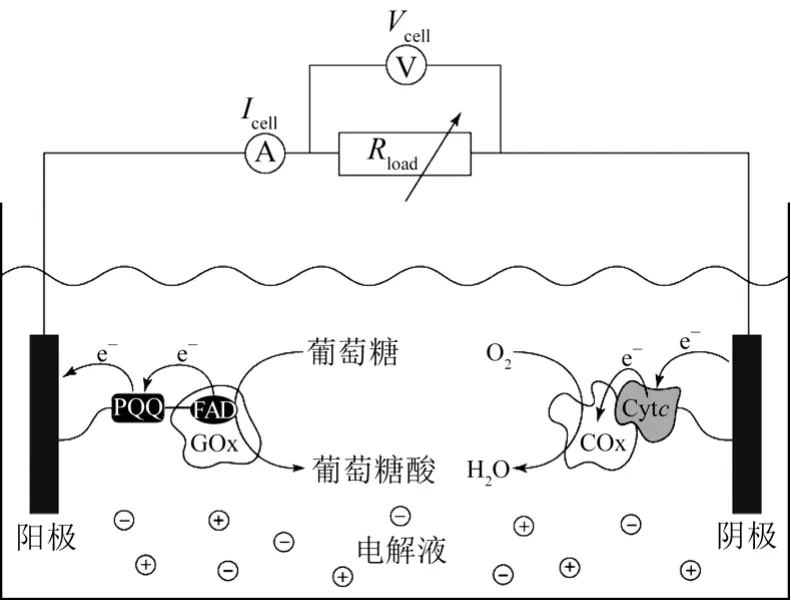
图1 酶生物燃料电池基本原理图[1]
阳极氧化酶的作用是催化氧化生物质,并能将释放的电子有效的传递给电极,保证电池具有较高的输出功率。酶的组成与结构不同,其催化转化效率不同,可催化的底物燃料也不同。常见的阳极氧化酶有葡萄糖氧化酶(GOx)、纤维二糖脱氢酶(CDH)、果糖脱氢酶(FDH)等。
葡萄糖氧化酶是一种包含黄素腺嘌呤二核苷酸辅酶因子且具有生物催化活性和生物化学稳定性的氧化还原酶[2-3]。由于葡萄糖氧化酶的辅酶因子深埋在酶蛋白质中,阻碍了其与电极之间的直接电子传递,因此许多研究者采用不同的纳米材料、导电聚合物等实现直接电子传递的目的[4-5]。
纤维二糖脱氢酶也可以将葡萄糖作为底物,能够在生物燃料电池中实现直接电子传递而引起了广泛关注[6-9]。纤维二糖脱氢酶包含FAD和亚铁血红素,其中FAD催化底物氧化,同时亚铁血红素与电极材料之间形成电耦合作用[10]。Feifel等[11]以二氧化硅纳米颗粒为基体,将纤维二糖脱氢酶固定在超分子结构体系中制备生物电极,产生的电流密度高于纤维二糖脱氢酶自组装形成的纳米生物分子层电极,两种结构的酶电极均可完成电子的直接和间接传递。
纤维二糖脱氢酶对葡萄糖的催化效率比葡萄糖氧化酶低,理论上纤维二糖脱氢酶的底物应该是纤维二糖,但其对乳糖也具有很高的催化氧化效率。
果糖脱氢酶可以催化氧化果糖构筑生物燃料电池。果糖脱氢酶的固定化与纤维二糖脱氢酶类似,果糖脱氢酶携带一个FAD和一个亚铁血红素c,可为电极提供直接电子传递的电池模式[12]。
除了上述几种包含辅酶因子的阳极氧化酶外,还有以乙醇脱氢酶(ADH)催化氧化发酵乙醇实现直接电子传递的生物燃料电池[13-14]。
1.2 阴极还原酶
在阴极添加还原酶,可以更高效地催化阴极的还原反应,提高电池输出功率。基于此,科学家们探索并发展了多种阴极还原酶,成为酶生物燃料电池领域一个新的发展方向。
蓝多铜氧化酶类(BMCOs)家族中包含多种氧化还原酶,主要有漆酶(Lc)、胆红素氧化酶(BOx)、抗坏血酸盐氧化酶(AOx)、血浆铜蓝蛋白(Cp)。其中漆酶和胆红素酶是研究较多的阴极还原酶,氧化还原电势高,可实现生物燃料电池中的直接电子传递。
漆酶在稀酸介质中(pH值为 4~5)通常会显示很高的活性,但是在有氯离子存在下其活性会受到抑制。Javier等[15]将漆酶分子与4-[2-氨乙基]苯甲酸盐(AEBA)功能化的石墨阴极表面以定向共价耦合的方式连接实现了直接电子传递,Zn作为电池阳极,制备了 Zn-AEBA漆酶电极,其电流密度达2977 μA/cm2,开路电压为0.41 V时,功率密度达1190 μW/cm2。Thorum 等[16]以蒽-2-甲硫醇(AMT)改性金电极的表面,研究漆酶在该电极上的催化活性,发现蒽-2-甲硫醇可有利于漆酶的吸附,漆酶催化O2还原的最高开路电压可达1.13 V。
胆红素氧化酶由于能够进行直接电子传递,并长期保持电极催化的稳定性而备受关注。Murata等[17]研究了胆红素氧化酶与纳米金粒子电极之间的直接电子传递,结果表明,胆红素氧化酶修饰纳米金粒子电极的电流密度高达5.2 mA/cm2,同时在保持48 h的连续测量后,电流密度仍然是初始值的90%。此外该作者还构筑了果糖/O2的直接电子传递生物燃料电池,以炭布作电池电极的基板,在 360 mV的静态工作条件下,最大的电流密度和最大的功率密度分别为2.6 mA和0.66 mW/cm2;而在300 mV的搅拌条件下,最大电流密度和最大功率密度提高到4.9 mA和0.87 mW/cm2。这表明胆红素氧化酶在提高生物燃料电池性能方面具有明显的优势。
蓝多铜氧化酶类的结构如图2所示,大多数蓝多铜氧化酶的催化部位包括4个铜原子:在T1部位(Cu-T1)可从底物中获得电子,可将电子直接转移到电极上;T2/T3为铜电子簇(Cu-T23),此处使O2还原成水。一些蓝多铜氧化酶还具有更复杂的结构,如人工合成的血浆铜蓝蛋白包含 6个 Cu离子、3个Cu-T1和3个Cu-T23[如图2(c)]。蓝多铜氧化酶类修饰的阴极催化效率高,电流密度可达毫安级(mA/cm2),但是催化效率受到O2在电极表面的扩散的限制[17-18]。H2O2可代替 O2作阴极的氧化剂被催化还原。

图2 蓝多铜氧化酶的晶体结构[19]
辣根过氧化物酶(HRP)和微过氧化物酶-11(MP-11)在不同的改性电极表面固定,酶在改性后的电极上能够保持其生物活性以及原始结构,并且电极显示出较高的电子传递效率,可以作为直接电子传递的生物阴极[20-23]。
2 电子介体电极
由于酶的活性中心常常被深埋在蛋白质的多肽链中不利于电子的传递,使得氧化还原中心到电极表面的电子传递不易被检测。因此,需要氧化还原中介体的存在以驱动生物电催化过程,提高酶电极之间的电子传递效率,如图3(b)所示,中介体在酶与电极之间起传递电子的作用。中介体可以分散在溶液中,也可以采用复合膜包覆,或与酶一起在基体材料中固定等形式存在。
常用的小分子中介体包括:二茂铁及其衍生物、亚甲基蓝、醌类、亚铁氰化物以及带有包括邻二氮杂菲衍生物(PDs)一类的无机配体金属复合物[24-28]等。而黄素、奎宁这样的生物小分子可以将电子直接转移到电极上。Li等[29]以合成的聚-2-甲基丙烯酰氧基乙基磷酰胆碱-co-p-乙烯基苯硼酸-co-乙烯基二茂铁(PMVF)为电子传递介质,GOx作为酶催化剂,在温和条件下,使聚乙烯醇(PVA)链与GOx相连。在苯硼酸和羟基之间通过选择性反应,使PMVF与PVA两种聚合物立即形成凝胶。采用旋转涂布技术,在金电极表面上构筑PMVF/GOx-PVA重复的多层结构。GOx对葡萄糖氧化产生的电流可达0.38 V(vs. Ag/AgCl),且电流随着PMVF/GOx-PVA层数的增加而增加,在凝胶中实现了分子在每一层和自由分散的基质的表面间的电子转移,可作为研究生物电子设备的有效方法。
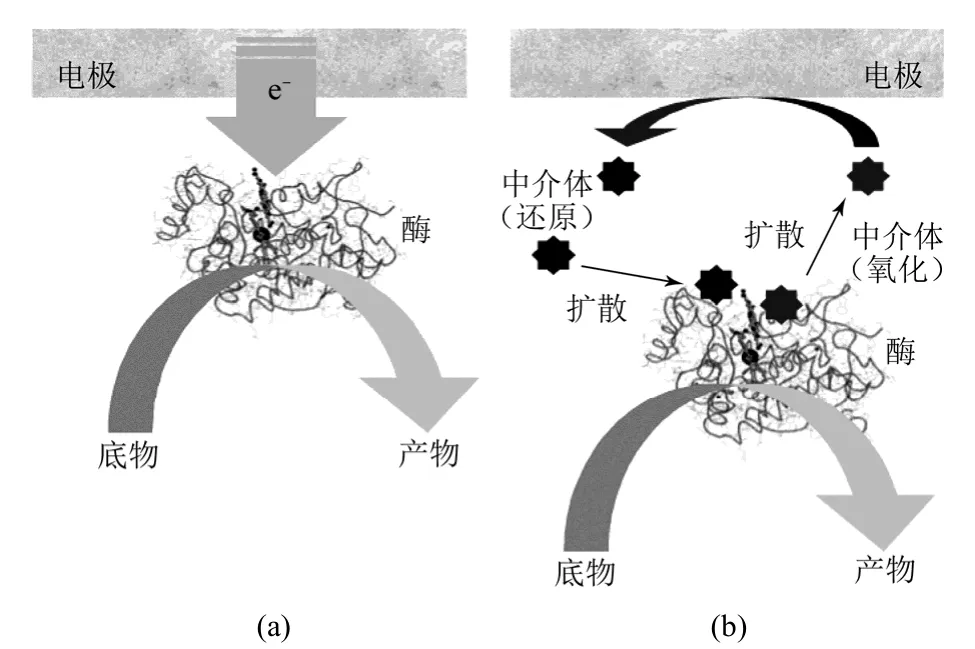
图3 两种电子传递方式[1]
一些氧化还原聚合物也可以作为电子中介体,改变电极电位,提高电流密度。Zafar等[30]发现葡萄糖脱氢酶/锇氧化还原聚合物(FADGDHs/Ospolymer-basd),如图4,电极对于葡萄糖基体具有高电流密度、高灵敏度和较宽的线性范围。同时酶经过去糖基化后体积缩小,有效地提高了酶和电极之间的电接触点范围,进而提高了电子传递效率和电流密度。
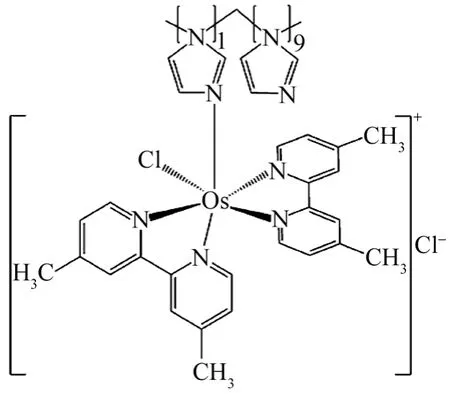
图4 锇-聚[锇(4,4′-二甲基-2,2′-联吡啶) 2(聚乙烯异丁醚)10氯] +的结构[30]
3 直接电子传递电极
虽然中介体提供了电子传递的有效途径,但是由于部分中介体具有毒性,会使酶失活,而采用直接电子传递方式可以缓解这一问题。直接电子传递是指酶的活性中心催化底物燃料氧化,电子从底物分子直接传递到电极上[图3(a)],因此成为构筑新型生物燃料电池、传感器的理想方式。
目前,导电聚合物(如聚吡咯、聚噻吩、聚苯胺等)、碳纳米管(CNTs)、纳米纤维、纳米粒子(NPs)、有序的介孔硅材料和有机客体分子等常被用来构筑直接电子传递电极。导电聚合物以其特殊的导电性、机械强度、耐腐蚀等性能,在酶固定化方面得以研究,以提高直接电子传递效率。Homma等[31]将酸性磷酸酶(ACP)以共价键合的方法固定在聚苯胺/聚丙烯酸复合膜(PANI/PAA)上,复合膜电沉积到金电极上,作为生物燃料电池的阳极。该电极的最大输出功率为 6.0 μW/cm2,是无PANI/PAA复合膜时的70倍。
碳纳米管、纳米粒子(NPs)、纳米纤维、介孔材料因其具有独特的表面效应可提高载酶量及电极稳定性,且质轻、多孔等特性,可促进直接电子传递效率,用以制备具有纳米结构特征的酶电极,构筑生物燃料电池。Yabuki等[32]将含有纳米纤维素的离子液体涂布在电极表面,再使电极沉浸在蒸馏水中以除去离子液体,此时膜上的酶依然可以保持活性,稳定性测试结果表明,该酶电极可在6个月内对葡萄糖进行检测。
也有研究者认为直接电子传递与掺杂在碳纳米管中的金属粒子有关,由于杂质金属与酶的协同作用使底物燃料氧化得更彻底,从而进一步提高了酶电极的直接电子传递效率[33]。
酶与电极之间的直接电子传递的优化对于提高生物燃料电池催化效率是至关重要的,而转基因技术为这一目标的实现提供了新的发展思路。Holland等[34]利用基因修饰技术对葡萄糖氧化酶进行了修饰,使其在活性点附近带有一个自由的硫醇基,有利于马来酰亚胺修饰的纳米金粒子在酶上特定位置的负载。将纳米金粒子修饰的酶固定到电极上,实现了酶-电极之间的直接电子传递,显示出转基因技术在基于直接电子传递的第三代生物燃料电池中的潜在应用。
与此同时,去糖基化的葡萄糖氧化酶[35-36]可以缩短酶的氧化还原中心与电极表面的距离,提高直接电子传递效率。其它氧化还原酶也可以尝试去糖基化的方法,缩减酶的尺寸从而改善酶与电极表面的电子传递途径,提高电流密度。
4 酶的固定化
早期燃料电池是将酶溶于溶液中,由于酶在溶液中只能保持数天,所以电池的寿命很短,而将酶固定在电极上可以保持酶的活性,延长电池的使用周期。酶的固定化方法主要包括吸附、交联、共价键合、脱辅酶的重构以及聚合物等材料的包覆。
物理吸附是最简单的酶固定化方法,酶蛋白的活性中心不易被破坏,但相互作用较弱,需进一步提高载酶量及酶的稳定性。研究不同CDHs的直接电子传递能力,将CDHs吸附于石墨电极或单壁碳纳米管(SWCNTs)上,发现SWCNTs能够增加电催化电流[37]。
包覆是将酶限制在聚合物基体、溶胶-凝胶以及氧化还原水凝胶中,或者是将酶包裹在半渗透膜中,不仅可以使酶自由移动,同时还可以阻止酶和小分子介体的流失。Latonen等[38]采用掺杂磺化聚苯乙烯(PSS−)且具有二层有序结构的聚(3,4-亚乙二氧基噻吩)(PEDOT)包覆毛栓菌漆酶(ThL)制备在阴极催化 O2还原的酶电极,致密的 PEDOT-PSS−复合膜可防止ThL流失提高载酶量,并可实现ThL与电极间的直接电子传递,当选择 pH=4.5时,该电极的稳定性最佳。
由于酶及固定化材料具有不同的功能化基团,通过共价键合的方法可使酶直接固定在金属及纳米材料的表面。交联的方法使酶形成三维网状的聚合物,但同时降低了酶的稳定性及活性。目前研究较多的是采用共价键合与交联相结合的方法制备自组装复合膜。Aquino等[39]利用层层组装技术(LBL)制备了乙醇/O2生物燃料电池。乙醇脱氢酶(ADH)和树枝状的聚酰亚胺利用LBL在碳纸上固定化,可更好地控制酶在电极上的沉积减少酶的消耗,产生的功率密度为0.12 mW/cm2。但是由于存在气体分散层(GDL)以致其稳定性不佳。Salimi等[40]在玻碳电极上以多层组装的方法构筑高稳定性的葡萄糖氧化酶电极,硫脲(TU)作共价键合的交联剂,二茂铁甲醇作电子传递介体,经测试葡萄糖固定化酶显示优异的电催化活性,并且拥有4个双分子层的TU/GOx稳定性良好,重现性高,酶可以在多层结构中保持活性,灵敏度达5.73 μA/(mmol·cm2)。
通过电化学还原将金电极、石墨电极、玻碳电极(GC)表面共价改性吸附芳基重氮盐,然后将酶膜接枝到功能化的电极上,形成的电极膜稳定性好,输出电压高。Pellissier等[41]将葡萄糖氧化酶自组装单层膜负载在功能化的玻碳电极的表面,该电极可在6个星期内保持酶的大部分活性。
另外,壳聚糖是一种天然高分子,因其具有良好的生物相容性以及血液相容性,且易进行一些化学修饰和改性(如酯化、烷基化、氧化、酰化、螯合等),可作为固载酶的基体材料。Yarman等[42]将微过氧化物酶-11固定在壳聚糖金纳米粒子基体中,催化过氧化氢在阴极还原,发现微过氧化物酶-11在壳聚糖金纳米粒子基体中分散性良好,可检测苯醌在阴极的还原信号,相同的传感器原理也可以用在芳香族药物中。
5 总结与展望
近几年,酶生物燃料电池的功率密度达到了 1 mW/cm2,使微型电子设备的成功应用成为可能。但是酶生物燃料电池需进一步提高功率密度和能量效率,选择生物相容性好的天然酶、人工酶以及目前研究较多的酶基因修饰技术和去糖基化酶也可实现酶与电极间的直接电子传递,提高电流密度;同时小分子中介体、氧化还原聚合物中介体的研究也促进了酶电极的发展;此外采用导电聚合物、碳纳米管等材料修饰电极需要保持材料性能的同时使酶具有更高的催化活性。而决定酶生物燃料电池性能的关键是酶电极的稳定性,在对催化活性位点保持连续的燃料供给的同时要确保酶与电极之间有效的电子传递,因此选择合适的酶固定化方法至关重要。研究新方法和新材料来完善酶电极,最大程度上提高载酶量,如通过自组装方法使酶固定在三维有序的复合膜结构中或在改性电极上负载酶膜等。
通过选择高效的催化氧化还原酶以及合适的酶固定化方法,制备具有更高效率的酶电极,使酶生物燃料电池在医用、环境保护等方面具有更广阔的应用前景。综上所述,随着国内外对酶电极研究的不断深入,电子传递方式及其影响因素、酶活性与耐久性的提高等会成为今后一段时间的研究重点。
[1] Barton S C,Gallaway J,Atanassov P. Enzymatic biofuel cells for implantable and microscale devices[J].Chemical Reviews,2004,104:4867-4886.
[2] Endo H,Yonemori Y,Hibi K,et al. Wireless enzyme sensor system for real-time monitoring of blood glucose levels in fish[J].Biosensors and Bioelectronics,2009,24(5):1417-1423.
[3] Kausaite A,Ramanaviciene A,Ramanavicius A. Polyaniline synthesis catalysed by glucose oxidase[J].Polymer,2009,50(8):1846-1851.
[4] Ivnitski D,Artyushkova K,Rincon R A,et al. Entrapment of enzymes and carbon nanotubes in biologically synthesized silica:Glucose oxidase-catalyzed direct electron transfer[J].Small,2008,4(3):357-364.
[5] Park H J,Won K,Lee S Y,et al. Fabrication of CNT/ferrocene/glucose oxidase/chitosan-layered bioanode for glucose/oxygen biofuel cells[J].Molecular Crystals and Liquid Crystals,2011,539(1):238-246.
[6] Coman V,Ludwig R,Harreither W,et al. A direct electron transfer-based glucose/oxygen biofuel cell operating in human serum[J].Fuel Cells,2010,10(1):9-16.
[7] Coman V,Vaz-Domínguez C,Ludwig R,et al. A membrane-,mediator-,cofactor-less glucose/oxygen biofuel cell[J].Physical Chemistry Chemical Physics,2008,10(40):6093-6096.
[8] Matsumura H,Ortiz R,Ludwig R,et al. Direct electrochemistry of Phanerochaete chrysosporium cellobiose dehydrogenase covalently attached onto gold nanoparticle modified solid gold electrodes[J].Langmuir,2012,28(29):10925-10933.
[9] Ludwig R,Harreither W,Tasca F,et al. Cellobiose dehydrogenase:A versatile catalyst for electrochemical applications[J].Chem. Phys.Chem.,2010,11(13):2674-2697.
[10] Zamocky M,Ludwig R,Peterbauer C,et al. Cellobiose dehydrogenase—A flavocytochrome from wood-degrading,phytopathogenic and saprotropic fungi[J].Current Protein and Peptide Science,2006,7(3):255-280.
[11] Feifel S C,Ludwig R,Gorton L,et al. Catalytically active silica nanoparticle-based supramolecular architectures of two proteinscellobiose dehydrogenase and cytochromecon electrodes[J].Langmuir,2012,28(25):9189-9194.
[12] Biscay J,Costa Rama E,González García M B,et al. Amperometric fructose sensor based on ferrocyanide modified screen-printed carbon electrode[J].Talanta,2012,88:432-438.
[13] Lee C A,Tsai Y C. Preparation of multiwalled carbon nanotube-chitosan-alcohol dehydrogenase nanobiocomposite for amperometric detection of ethanol[J].Sensors and Actuators B:Chemical,2009,138(2):518-523.
[14] Periasamy A P,Umasankar Y,Chen S M. Toluidine blue adsorbed on alcohol dehydrogenase modified glassy carbon electrode for voltammetric determination of ethanol[J].Talanta,2011,83(3):930-936.
[15] Martinez-Ortiz J,Flores R,Vazquez-Duhalt R. Molecular design of laccase cathode for direct electron transfer in a biofuel cell[J].Biosensors and Bioelectronics,2011,26(5):2626-2631.
[16] Thorum M S,Anderson C A,Hatch J J,et al. Direct,electrocatalytic oxygen reduction by laccase on anthracene-2-methanethiol- modified gold[J].The Journal of Physical Chemistry Letters,2010,1(15):2251-2254.
[17] Murata K,Kajiya K,Nakamura N,et al. Direct electrochemistry of bilirubin oxidase on three-dimensional gold nanoparticle electrodes and its application in a biofuel cell[J].Energy & Environmental Science,2009,2(12):1280-1285.
[18] Kontani R,Tsujimura S,Kano K. Air diffusion biocathode with CueO as electrocatalyst adsorbed on carbon particle-modified electrodes[J].Bioelectrochemistry,2009,76(1-2):10-13.
[19] Falk M,Blum Z,Shleev S. Direct electron transfer based enzymatic fuel cells[J].Electrochimica Acta,2012,82:191-202.
[20] Jia W,Schwamborn S,Jin C,et al. Towards a high potential biocathode based on direct bioelectrochemistry between horseradish peroxidase and hierarchically structured carbon nanotubes[J].Physical Chemistry Chemical Physic,2010,12(34):10088-10092.
[21] Chen H,Zhang Z,Cai D,et al. Direct electrochemistry and electrocatalytic behavior of horseradish peroxidase on attapulgite clay modified electrode[J].Analytical Sciences,2011,27(6):613-616.
[22] Jiang H,Mercier P,Wang S C,et al. Direct electrochemistry and electrocatalytic activity of microperoxidase-11 immobilized on chitosan wrapped single-walled carbon nanotubes[J].Journal of Functional Materials and Devices,2009,15(2):132-142.
[23] Choi Y,Wang G,Nayfeh M H,et al. A hybrid biofuel cell based on electrooxidation of glucose using ultra-small silicon nanoparticles[J].Biosensors and Bioelectronics,2009,24(10):3103-3107.
[24] Oztekin Y,Yazicigil Z. Preparation and characterization of a 1,10-phenanthroline-modified glassy carbon electrode[J].Electrochimica Acta,2009,54(28):7294-7298.
[25] Dai D,Chan D,Wu H. Modified carbon nanoball on electrode surface using plasma in enzyme-based biofuel cells[J].Energy Procedia,2012,14:1804-1810.
[26] Merchant S A,Tran T O,Meredith M T,et al. High-sensitivity amperometric biosensors based on ferrocene-modified linear poly(ethylenimine)[J].Langmuir,2009,25(13):7736-7742.
[27] Lawal A T,Adeloju S B. Mediated xanthine oxidase potentiometric biosensors for hypoxanthine based on ferrocene carboxylic acid modified electrode[J].Food Chemistry,2012,135(4):2982-2987.
[28] Yao H,Liu H,Sun M,et al. Amperometric biosensor for hydrogen peroxide based on theco-electrodeposition of horseradish peroxidase and methylene blue on an ITO electrode modified with an anodic aluminum oxide template[J].Microchimica Acta,2011,177(1-2):31-37.
[29] Li Z,Konno T,Takai M,et al. Fabrication of polymeric electron-transfer mediator/enzyme hydrogel multilayer on an Au electrode in a layer-by-layer process[J].Biosensors and Bioelectronics,2012,34(1):191-196.
[30] Zafar M N,Beden N,Leech D,et al. Characterization of different FAD-dependent glucose dehydrogenases for possible use in glucose-based biosensors and biofuel cells[J].Analytical and Bioanalytical Chemistry,2012,402(6):2069-2077.
[31] Homma T,Kondo M,Kuwahara T,et al. Immobilization of acid phosphatase on a polyaniline/poly (acrylic acid) composite film for use as the anode of a fuel cell driven with L-ascorbic acid 2-phosphate[J].Polymer Journal,2012.
[32] Yabuki S,Hirata Y,Sato Y,et al. Preparation of a cellulose-based enzyme membrane using ionic liquid to lengthen the duration of enzyme stability[J].Analytical Sciences:The International Journal of the Japan Society for Analytical Chemistry,2012,28(4):373-377.
[33] Wang J Y,Yen M J,Ho K C,et al. Fabrication of nanocatalystenhanced enzyme electrode and application in glucose biofuel cells[C]//IEEE,2011.
[34] Holland J T,Lau C,Brozik S M,et al. Engineering of glucose oxidase for direct electron transferviasite-specific gold nanoparticle conjugation[J].Journal of the American Chemical Society,2011,133(48):19262–19265.
[35] Prévoteau A,Courjean O,Mano N. Deglycosylation of glucose oxidase to improve biosensors and biofuel cells[J].Electrochemistry Communications,2010,12(2):213-215.
[36] Courjean O,Gao F,Mano N. Deglycosylation of glucose oxidase for direct and efficient glucose electrooxidation on a glassy carbon electrode[J].Angewandte Chemie,2009,121(32):6011-6013.
[37] Dong S,Chen X,Gu L,et al. A biocompatible titanium nitride nanorods derived nanostructured electrode for biosensing and bioelectrochemical energy conversion[J].Biosensorsand Bioelectronics,2011,26(10):4088-4094.
[38] Latonen R ,Wang X,Sjöberg-Eerola P,et al. Poly(3,4-ethylenedioxythiophene) based enzyme-electrode configuration for enhanced direct electron transfer type biocatalysis of oxygen reduction[J].Electrochimica Acta,2012,68:25-31.
[39] Aquino Neto S,Forti J C,Zucolotto V,et al. Development of nanostructured bioanodes containing dendrimers and dehydrogenases enzymes for application in ethanol biofuel cells[J].Biosensors and Bioelectronics,2011,26(6):2922-2926.
[40] Salimi A,Noorbakhsh A. Layer by layer assembly of glucose oxidase and thiourea onto glassy carbon electrode:Fabrication of glucose biosensor[J].Electrochimica Acta,2011,56(17):6097-6105.
[41] Picot M,Nicolas I,Poriel C,et al. On the nature of the electrode surface modification by cathodic reduction of tetraarylporphyrin diazonium salts in aqueous media[J].Electrochemistry Communications,2012,20:167-170.
[42] Yarman A,Badalyan A,Gajovic-Eichelmann N,et al. Enzyme electrode for aromatic compounds exploiting the catalytic activities of microperoxidase-11[J].Biosensors and Bioelectronics,2011,30(1):320-323.

