仲丁醇脱氢制甲乙酮的Cu-ZnO催化剂
姜广申 ,胡云峰 ,2,蔡 俊 ,许 鹏 ,丛 亮,方 菲
(1东北石油大学化学化工学院,黑龙江 大庆 163318;2大庆应用技术研究院,黑龙江 大庆 163318;3大庆炼化公司,黑龙江 大庆 163316)
甲乙酮(MEK)是一种重要的性能优良的有机溶剂,由于MEK具有低毒、低沸点、溶解性强等优点,广泛应用于涂料、炼油、染料、医药、清洗剂等工业,目前又延伸到电子工业和印刷线路制造等领域[1-3]。同时,MEK也是一种重要的精细化工原料,不仅可以用来生产MEK过氧化物等化工产品,而且是制备甲基烯丙基酮、甲基紫罗兰酮等香料、抗氧化剂以及某些催化剂的中间体[4-5]。
目前国内外工业上MEK的生产大多数是通过SBA催化脱氢实现的,比较成熟的MEK生产工艺是首先将正丁烯水合生成SBA,然后由SBA脱氢制取MEK[6]。该工艺采用的催化剂主要是铜基催化剂,包括 Cu/ZnO、Cu/Al2O3、Cu-ZnO/Al2O3、Cu/SiO2和 Cu/Cr2O3等[7-12]。但是采用含有酸性位的 Al2O3和SiO2作为载体时,SBA容易发生分子内脱水生成丁烯,降低了MEK的选择性;虽然Cr2O3的酸性稍低于Al2O3,但是Cr2O3中的Cr是一种有毒的重金属,对人体和环境会造成严重危害[13-18]。因此,选择一种酸碱强度适宜的环保材料作为铜基催化剂的载体尤为重要。
ZnO是一种优良的半导体,具有良好的表面电子性质,同时拥有中等强度的Lewis碱性中心,是良好的催化剂载体[14,19-20]。以 ZnO 为载体制备的铜锌催化剂用于CO2和CO加氢合成甲醇反应的研究颇多,然而对Cu和ZnO在该反应过程中的作用机理备受争议,至今没有达成一致的观点。在合成甲醇反应中,杨上闰等[21]认为ZnO进入CuO的晶格形成了具有精细分散 CuO微粒的(CuZn)O固溶体;Fujitani等[22]和Spencer[23]观察到在反应过程中铜锌催化剂表面形成了具有高活性的CuZn合金;Spencer[24]发现 ZnO与 Cu之间存在氢溢流现象;Nakamura等[25]认为Cu+-Zn-O是CO加氢合成甲醇的活性中心;Marta Santiago等[26]研究发现,不仅Cu对CO2加氢合成甲醇有活性,而且ZnO对反应中间体甲酸甲酯分解转化成甲醇也具有催化活性。尽管铜锌催化剂能够催化加氢和脱氢两个反应过程,但是它在两反应中的作用可能不同,且国内外对其催化醇类脱氢反应有了较多研究,却对脱氢反应的催化作用尚不清楚[27-28]。本文作者以SBA脱氢反应为例,采用共沉淀法和机械混合法制备了铜锌催化剂,研究了该催化剂各组分的作用和ZnO量对前体的影响,通过SBA催化脱氢反应测试筛选了最佳的Cu/Zn,并比较了Cu0比表面积与SBA催化脱氢活性的关系。
1 实验部分
1.1 催化剂制备
分别配制250 mL浓度为1 mol/L的Cu(NO3)2和250 mL浓度为1 mol/L的Zn(NO3)2溶液,然后将该两种溶液均匀混合,以500 mL浓度为2 mol/L的 Na2CO3溶液作为沉淀剂采用并流法在 70 ℃中性条件下沉淀。沉淀完成后,母液于70 ℃陈化4 h,随后经过滤并用蒸馏水洗涤沉淀物数次至沉淀上层清液电导率为20 μS/cm。将已洗涤过的沉淀转入烘箱内于120 ℃干燥4 h,再转移到马弗炉中400 ℃下焙烧4 h,焙烧后的催化剂粉末需经过压片、粉碎、过筛得到20~40目的催化剂颗粒备用。通过共沉淀法制备并经洗涤、焙烧分别制得CuO和ZnO粉末,按60%CuO和40%ZnO的比例机械混合,再经压片、筛分等过程制备20~40目的铜锌催化剂颗粒备用。催化剂命名方式以制备方式和金属氧化物质量分数标注,如共沉淀法制备的CuO和60%CuO-40% ZnO简记为CP Cu和CP 60Cu-40Zn,机械混合法制备的60%CuO-40%ZnO简记为PM 60Cu-40Zn。
1.2 催化剂表征
XRD图谱在D/max-3C型(日本理学)X射线衍射仪上对样品进行测定,铜靶 Kα1射线,管电压为40 kV,管电流为30 mA,扫描范围为5°~60°,扫描类型为连续扫描,扫描速度为2°。
TPR测试在常规的程序升温还原装置上完成,试样量均为0.01 g。测试前,在300 ℃下用N2吹扫60 min以除去催化剂表面气相杂质,然后降至室温,样品改通5% H2-N2混合气从室温以10 ℃/min升至300 ℃,以Shimadz GC-8A记录TPR曲线。
Cu0比表面积通过N2O吸附分解测定。样品前期处理同TPR测试,经还原后于80 ℃下定量脉冲(每次0.08 mL)注入N2O气体,直至吸附峰达到饱和为止。Cu0与N2O发生如式(1)化学计量反应。
2Cu(s)+N2O(g) = Cu2O(s)+N2(g)(1)通过吸附的 N2O气体量并按上述化学计量反应计算Cu0有关物理性质,见式(2)[29]。



1.3 反应测试
催化剂活性测试在连续固定床反应器中进行。称取催化剂样品1 g放置于不锈钢管式反应器中央,上下两段均用惰性石英砂填充,反应温度通过置于催化床层中央的热电偶测定。反应前催化剂须在270 ℃、0.2 MPa的5% H2-N2混合气氛围下还原4 h,然后在常压240 ℃下反应10 h。原料SBA通过P230恒流泵(大连依利特分析仪器有限公司)注入反应器中。反应产物经冷却后收集产物,并测定尾气量。液相产物、气体产物通过Shimadz GCMS2010完成产物定性分析,并采用装有 PEG-20M 毛细管柱的Shimadz GC-14C气相色谱完成定量分析。
2 结果与讨论
2.1 Cu与ZnO作用
图1为CP Cu、PM 60Cu-40Zn和CP 60Cu-40Zn催化剂的TPR结果。由于ZnO只有在高温(600 ℃)下发生还原,且这3种催化剂的还原曲线均为单峰,因此发生还原的只有CuO物种。由图1可见,CP Cu、PM 60Cu-40Zn和CP 60Cu-40Zn还原峰对应的温度依次为253 ℃、228 ℃和212 ℃。通常认为低温还原峰为微小CuO簇或高分散在载体表面CuO微粒的还原,高温还原峰为较大CuO晶粒的还原[30-32]。CP Cu的还原峰温度明显高于PM 60Cu-40Zn和CP 60Cu-40Zn,意味着其中的CuO晶粒大于后两者。PM 60Cu-40Zn的还原峰温度介于 CP Cu和 CP 60Cu-40Zn之间,表明 ZnO在机械混合作用下起到一定的分散 CuO物种的作用。CP 60Cu-40Zn还原峰温度在这3种催化剂中最低,说明该催化剂中CuO物种的粒径最小,CP 60Cu-40Zn分散度最大,共沉淀法比机械混合法能够制备更高分散度的铜锌催化剂。

图1 焙烧后CP Cu、PM 60Cu-40Zn和CP 60Cu-40Zn的TPR
图2为CP Cu、PM 60Cu-40Zn和CP 60Cu-40Zn还原前后的XRD结果。由图2可见,与CP Cu相比,还原前PM 60Cu-40Zn 样品中所有CuO的特征衍射峰强度有所减弱,且出现了较强的ZnO特征衍射峰;CP 60Cu-40Zn中的CuO特征衍射峰强度大幅度减弱,ZnO的特征衍射峰强度也明显减弱,表明ZnO与铜物种相互分散,共沉淀法制备的铜锌催化剂中的CuO物种有更大分散度,可能是共沉淀法制备的催化剂经焙烧后形成了CuO微粒与ZnO微粒高度分散的固溶体,而不是简单地机械混合。同时可以看出,反应后 CP Cu全部还原为 Cu0;PM 60Cu-40Zn反应后仅有ZnO和Cu0的特征衍射峰,表明反应后只有CuO被还原,Zn仍以氧化物存在,这与TPR结果是一致的,而且其中的Cu0的衍射强度信号比CP Cu样品的更强,也表明机械混合法制备的铜锌催化剂中的 ZnO虽然有一定的分散作用但不稳定,其中的Cu0更容易烧结。相对前两者,还原后的CP 60Cu-40Zn催化剂,Cu0的衍射峰强度显著减弱,在2θ=50.36°处的衍射峰几乎消失,且ZnO的衍射峰强度也减弱,说明还原后在ZnO载体上形成了高分散、小粒径的Cu0微粒,而且其中的Cu0不易烧结,有较好的热稳定性。

图2 CP Cu、PM 60Cu-40Zn和CP 60Cu-40Zn还原前后的XRD
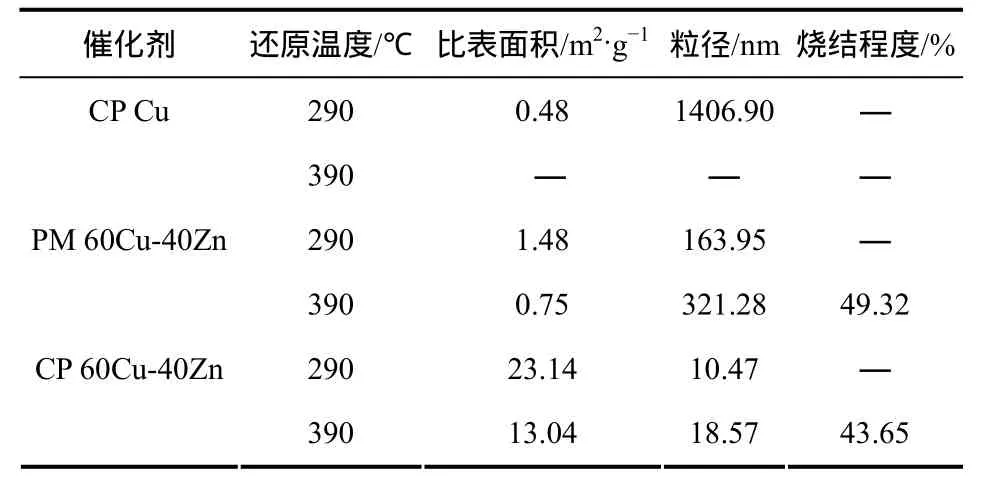
表1 不同还原温度下3种铜锌催化剂有关物理性质
采用N2O分解测定的3种催化剂的物理性质见表1(由于CP Cu在390 ℃下还原颗粒烧结变大,超出了N2O吸附分解测定范围,无法测出其有关物理性质)。由表1可见,290 ℃还原条件下 CP 60Cu-40Zn催化剂有最大 Cu0比表面积(23.14m2/g)、最小粒径(10.47 nm),表明共沉淀法宜于制备高分散的铜锌催化剂。这与TPR、XRD表征结果一致。PM 60Cu-40Zn和CP 60Cu-40Zn经过390 ℃高温还原处理4 h,两种催化剂的烧结程度分别为49.32%、43.65%,表明CP 60Cu-40Zn中的ZnO有一定的阻止Cu0粒烧结的能力。
在CP Cu、PM 60Cu-40Zn、CP 60Cu-40Zn和CP Zn催化作用下,SBA转化率随反应时间变化情况见图3(a)。容易看出,3种铜锌催化剂对SBA转化率的大小顺序依次为 CP 60Cu-40Zn>PM 60Cu-40Zn>CP Cu。4种催化剂对MEK收率的影响见图3(b)。3种铜锌催化剂对MEK收率的大小顺序也依次为 CP 60Cu-40Zn>PM 60Cu-40Zn>CP Cu。普遍认为铜锌催化剂的催化活性与 Cu0比表面积有关[33-35]。Cu0比表面积取决于Cu0分散度,在相同铜含量情况下,分散度越大,比表面积越大,意味着催化活性越高。可见,大比表面积即高分散的CP 60Cu-40Zn催化剂拥有较高活性,共沉淀法适合制备高分散的铜锌催化剂。由图3(a)和图3(b)看出,CP Zn对SBA转化率和MEK收率均较低(均在4%左右),表明ZnO基本无反应活性,因此对铜锌催化剂来说,只有Cu0是SBA催化脱氢的活性中心。这与Wang等[12]和吉定豪等[36]的研究结果是一致的。
2.2 不同Cu/Zn的Cu-ZnO前体晶相

图3 3种铜锌催化剂与CP Zn上的SBA转化率和MEK收率

图4 不同Cu/Zn的铜锌催化剂前体的XRD
不同铜含量的铜锌催化剂前体的XRD见图4。可以看出,C P C u前体中的物种全部为Cu2(OH)2CO3(a:2θ=14.75°、17.51°、24.05°、31.15°、32.11°、35.60°);随Zn量的增加,不同Cu/Zn催化剂前体中的Cu2(OH)2CO3特征衍射峰强度逐渐减弱,并先后出现了CuZn(OH)2CO3(b:2θ=29.51°、31.77°、35.49°、38.47°)、(CuZn)5(OH)6CO3(c: 2θ=12.89°、23.99°、32.50°)晶相,而且(CuZn)5(OH)6CO3晶相逐渐增多,说明Cu2+和Zn2+发生了同晶取代;CP 50Cu-50Zn前体中全部为(CuZn)5(OH)6CO3晶相(d:2θ=12.89°、23.99°、27.60°、31.71°、32.61°、33.97°、 36.61°、57.07°),表明Cu2+与Zn2+同晶取代程度最强;继续增加Zn的量,CP 40Cu-60Zn和CP 25Cu-75Zn前体中的(CuZn)5(OH)2CO3的特征衍射峰逐渐减弱,出现了Zn5(OH)6CO3晶相(e:2θ=36.33°、38.47°),并且其衍射强度逐渐增强,表明Zn5(OH)6CO3逐渐成为主相。以前的研究表明,在制备合成甲醇的铜锌催化剂过程中也出现了 CuZn(OH)2CO3、(CuZn)5(OH)6CO3晶相[22-23,37]。由于 Cu2+和 Zn2+在结构上相近,在陈化作用下这两种离子能够相互交叉渗透到以沉淀形式存在的 Cu2(OH)2CO3和Zn5(OH)6CO3晶格中,发生同晶取代。其中(CuZn)5(OH)6CO3晶相中的氧原子以双层紧密堆积方式排列,Cu2+位于八面体中心,而Zn2+处在四面体位置上,焙烧后易生成 CuO-ZnO固溶体。该固溶体中以CuO为中心四周排布着较多的ZnO,可保证CuO充分细化,使催化剂有更多的活性中心,同时又能有效阻止 CuO在还原过程和反应中因局部过热而导致Cu0的迁移、聚并、烧结长大,从而使催化剂保持较高的稳定性。
2.3 不同Cu/Zn对Cu-ZnO催化性能影响
SBA在不同Cu/Zn的铜锌催化剂上的转化率随反应时间变化情况见图5(a)。可见,CP 50Cu-50Zn在反应稳定后对SBA转化率达到80.54%,均高于其它比例的铜锌催化剂。在不同Cu/Zn的催化剂上MEK收率随反应时间变化情况见图5(b)。可以看出,CP 50Cu-50Zn在整个反应过程中对MEK的收率也均高于其它比例的铜锌催化剂,MEK收率达到76.04%。这说明CP 50Cu-50Zn是较好的催化剂,铜锌催化剂适宜的Cu/Zn为1∶1。在铜锌催化剂中,铜含量越低,意味着铜物种被 ZnO分散的程度越大,但是反应活性未必随铜物种分散度增大而相应增加(如CP 40Cu-60Zn、CP 25Cu-75Zn),这是因为当铜含量降低到一定程度(50%以下)之后,尽管分散程度不断增加,但是单位催化剂表面积上的Cu0活性中心的密度下降了。因此只有保持在适当的分散度,铜锌催化剂才能达到较佳的活性。

图5 不同Cu/Zn的铜锌催化剂上的SBA转化率和MEK收率
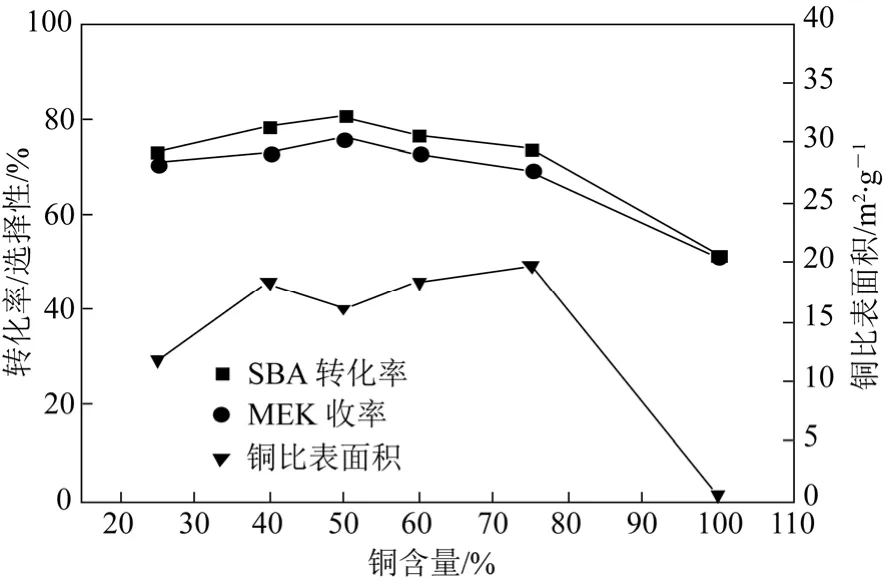
图6 不同Cu/Zn的铜锌催化剂的反应活性与Cu0比表面积的关系
不同Cu/Zn的铜锌催化剂的反应活性与Cu0比表面积的关系见图6。可见,在较小的 Cu0比表面积的催化剂(如 25%和 100%铜含量)作用下,反应活性均不太高;当铜含量为40%~75%时 ,随着铜含量的增加,Cu0比表面积先减小、后增大,而催化剂的反应活性变化规律与之相反;且铜含量为50%时,反应活性最高,但 Cu0比表面积不是最大值,这说明铜锌催化剂的反应活性与Cu0比表面积不是呈正相关的。有文献认为,铜基催化剂的反应活性与Cu0比表面积呈线性关系[38-39]。与上述观点相反,该实验结果证实了催化剂拥有越大的Cu0比表面积并不能保证对SBA脱氢反应有越高的活性,当其保持合适的Cu0比表面积时,发挥了其最佳催化性能,即表明SBA脱氢反应是一个结构敏感型反应。这与 Lambert等[40]的研究是一致的。Fujitani等[41]和Nakamura等[42]也发现,在甲醇合成反应中,Cu(111)比 Cu(100)和 Cu(110)晶面有更高的催化活性,即晶体形态能够影响催化性能。当铜含量为50%时,SBA脱氢活性最高,可能是比其它含量的铜锌催化剂拥有更多的活性晶面。具有结构敏感性的SBA脱氢反应可能是由于ZnO量变化引起Cu0晶体形态改变所致。
3 结 论
与机械混合法相比,共沉淀法能够制备高度分散的铜锌催化剂。经还原后该催化剂中的 Cu0是SBA脱氢的活性中心,ZnO具有分散铜物种和抗烧结能力。共沉淀法中的ZnO具有分散能力是因为制备催化剂过程中Cu2+、Zn2+发生了同晶取代,形成了(CuZn)x(OH)y(CO3)z(x=1,5;y=2,6;z=1,2)前体,意味着焙烧后 CuO与 ZnO形成了高度分散的CuO-ZnO固溶体。当Cu/Zn为1∶1时,该催化剂前体相主要为(CuZn)5(OH)6CO3,在焙烧还原过程中ZnO能有效地阻隔Cu0在高温下聚集烧结,以达到高分散、抗烧结能力,同时表现了良好的反应活性。铜锌催化剂的脱氢活性与Cu0比表面积不呈线性关系,说明SBA脱氢反应是一结构敏感型反应。

[1] 钱伯章,朱建芳. 甲乙酮的技术进展与市场分析[J]. 精细化工原料及中间体,2010,10:28-32.
[2] 吕志辉. 正丁烯水合、脱氢制甲乙酮技术[J]. 石油化工,2003,32(2):153-155.
[3] Liu Zh H,Huo W Zh,Ma H,et al. Development and commercial application of methyl-ethyl-ketone production technology[J].Chin. J.Chem. Eng.,2006,14(5):676-684.
[4] 李雅丽. 甲乙酮生产技术及市场分析[J]. 精细与专用化学品,2004,12(18):22-25.
[5] 李玉芳,伍小明. 我国甲乙酮的开发和利用前景分析[J]. 中国石油和化工,2005(9):43-48.
[6] 杨晓红,余启炎,郝雪松,等. 仲丁醇脱氢制甲乙酮催化剂的工业应用[J]. 石油化工,2008,37(6):613-616.
[7] Wang Z L,Wang G J,Zhu W Ch,et al. Effect of residual Na on Cu-ZnO catalyst in dehydrogenation of 2-Butanol[J].Pol. J. Chem.,2004,78(6):861-868.
[8] Chang H F,Yang C F. Electroless-plated Cu/Al2O3catalysts prepared with different chelating agents and their activity on the dehydrogenation of 2-butanol[J].Ind. Eng. Chem. Res.,1997,36(6):2080-2086.
[9] Fang D R,Ren W Z,Liu Z M,et al. Synthesis and application of mesoporous Cu-Zn-Al2O3for dehydrgenation of 2-butanol[J].J. Nat.Gas. Chem.,2009,18(2):179-182.
[10] Zhu W C,Wang L X,Liu S Y,et al. Characterization and catalytic behavior of silica-supported copper catalysts prepared by impregnation and ion-exchange methods[J].React. Kinet. Catal.Lett.,2008,93(1):93-99.
[11] Keuler J N,Lorenzen L,Miachon S. The dehydrogenation of 2-butanol over copper-based catalysts:Optimising catalyst composition and determining kinetic parameters[J].Appl. Catal. A,2001,218(1):171-180.
[12] Wang Z L,Ma H C,Zhu W C,et al. Characterization of Cu-ZnO-Cr2O3/SiO2catalysts and application to dehydrogenation of 2-butanol to 2-butone [J].React. Kinet. Catal. Lett.,2002,76(2):271-279.
[13] 刘振华,马友山. 新型仲醇脱氢制酮催化剂的研究[J]. 工业催化,2000,8(4):39-42.
[14] Van de Scheur F T,Staal L H. Effects of zinc addition to silica supported copper catalysts for the hydrogenolysis of esters[J].Appl.Catal. A,1994,108:63-83.
[15] Reddy G K,Rama Rao K S,Kanta R P. Effect of support modification by carbon coverage in the dehydrogenation activity of Cu/Al2O3catalyst[J].Catal. Lett.,1999,59(2-4):157–160.
[16] Romero A,Santosa A,Escrigb D,et al. Comparative dehydrogenation of cyclohexanol to cyclohexanone with commercial copper catalysts:Catalytic activity and impurities formed [J].Appl. Catal. A,2011,392(1-2):19–27.
[17] Perez-Lopez O W,Farias A C,Marcilio N R,et al. The catalytic behavior of zinc oxide prepared from various precursors and by different methods[J].Mater. Res. Bulletin,2005,40:2089–2099.
[18] 白国义,王海龙,宁慧森,等. 负载型铜基催化剂的制备及其在仲丁醇脱氢和糠醛加氢耦合反应中的应用[J]. 河北大学学报:自然科学版,2009,29(4):381-385.
[19] Miller K J,Wu J L. Catalytic dehydrogenation of Z-Butanol with ZnO and CuO[J].J. Catal.,1972,27:60-63.
[20] Landau M V,Kogan S B,Herskowitz M. Dehydrogenation of methoxyisopropanol to methoxyacetone on supported bimetallic Cu-Zn catalysts[J].Heterogeneous Catal. Fine Chem.Ⅳ,1997:413-414.
[21] 杨上闰,胡兵,傅献彩. 铜锌催化剂组分间相互作用的研究[J].化学研究与应用,1990,2(4):40-46.
[22] Fujitani T,Nakamura J.The effect of ZnO in methanol synthesis catalysts on Cu dispersion and the specific activity[J].Catal. Lett.,1998,56(2-3):119–124.
[23] Spencer M S. The role of zinc oxide in Cu/ZnO catalysts for methanol synthesis and the water–gas shift reaction[J].Topics Catal.,1999,8(3-4):259–266.
[24] Spencer M S. Role of ZnO in methanol synthesis on copper catalysts[J].Catal. Lett.,1998,50(1-2):37-40.
[25] Nakamura J,Nakamura I,Uchijima T,et al. Methanol synthesis over a Zn-deposited copper model catalyst[J].Catal. Lett.,1995,31(4):325-331.
[26] Santiago M,Barbera K,Ferreira C,et al. By-product co-feeding reveals insights into the role of zinc on methanol synthesis catalysts[J].Chem. Commun.,2012,21:63–67.
[27] Nagaraja B M,Padmasri A H,Seetharamulu P,et al. A highly active Cu-MgO-Cr2O3catalyst for simultaneous synthesis of furfuryl alcohol and cyclohexanone by a novel coupling route—Combination of furfural hydrogenation and cyclohexanol dehydrogenation[J].J. Mol.Catal. A,2007,278:29–37.
[28] Jansen S,Palmieri M,Gomez M,et al. Acid catalysts based on Cu/Ru alumina:Conversion of butyraldehyde to dibutyl ether[J].J. Catal.,1996,163:262–270.
[29] Chary K V R,Sagar G V,Naresh D,et al. Characterization and reactivity of copper oxide catalysts supported on TiO2-ZrO2[J].J.Phys. Chem. B,2005,109(19):9437-9444.
[30] Zhang R,Sun Y H,Peng S Y. Dehydrogenation of methanol to methyl formate over CuO-SiO2gel catalyst[J].React. Kinct. Catal.Lett.,1999,67(1):95-102.
[31] Chary K V R,Sagar G V,Srikanth C S,et al. Characterization and catalytic functionalities of copper oxide catalysts supported on zirconia[J].J. Phys. Chem. B,2007,111(3):543-550.
[32] Sagar G V,Rao P V R,Srikanth C S,et al. Characterization and catalytic functionalities of copper oxide catalysts supported on zirconia[J].J. Phys. Chem. B,2006,110(28):13881-13888.
[33] Tu Y J,Li Ch P,Chen Y W. Effect of chromium promoter on copper catalysts in ethanol dehydrogenation[J].J. Chem. Tech. Biotechnol.,1994,59(2):141-147.
[34] Lindström B,Pettersson L J,Menon P. Activity and characterization of Cu/Zn,Cu/Cr and Cu/Zr on γ-alumina for methanol reforming for fuel cell vehicles[J].Appl. Catal. A,2002,234(1-2):111–125.
[35] Saito M,Murata K. Development of high performance Cu/ZnO-based catalysts for methanol synthesis and the water-gas shift reaction[J].Catal. Surveys Asia,2004,8(4):285-293.
[36] 吉定豪,刘钢,贾明君,等. 溶胶-凝胶和浸渍法制备的铜催化剂在仲丁醇脱氢反应中的研究[J]. 高等学校化学学报,2007,28(8):1543-1546.
[37] Fujitani T,Nakamura J. The effect of ZnO in methanol synthesis catalysts on Cu dispersion and the specific activity[J].Catal. Lett.,1998,56(2-3):119-124.
[38] Sodesawa T. Dynamic change in surface area of Cu in dehydrogenation of methanol over Cu/SiO2catalyst prepared by ion exchange method[J].React. Kinet. Catal. Lett.,1984,24(3-4):259-264.
[39] Pepe F,Angeletti C,Rossi S,et al.Catalytic behavior and surface chemistry of copper/alumina catalysts for lsopropanol decomposition[J].J. Catal.,1985,91:69-77.
[40] Lambert S,Cellier C,Ferauche F,et al. On the structure-sensitivity of 2-butanol dehydrogenation over Cu/SiO2cogelled xerogel catalysts[J].Chem. Commun.,2007,8(12):2032–2036.
[41] Fujitani T,Nakamura I,Ueno S,et al. Methanol synthesis by hydrogenation of CO2over a Zn-deposited Cu(Ⅲ ): Formate intermediate[J].Appl. Surf. Sci.,1997,121-122:583-586.
[42] Nakamura I,Fujitani T,Uchijima T,et al. A model catalyst for methanol synthesis:Zn-deposited and Zn-free Cu surfaces[J].J. Vac.Sci. Technol. A ,1996,14(3):1464-1468.

