微通道反应器中苄亚甲基二氯水解制苯甲醛连续流工艺
严生虎,陈代祥,沈 卫,沈介发,马 兵,刘建武,张 跃
(1常州大学化工设计研究院,江苏 常州213164;2康宁中国(上海)管理有限公司,上海 200040)
苯甲醛是一种重要的精细化工产品和化工原料,主要用作生产月桂醛、苯乙醛、苯甲酸苄酯的原料[1],也是香料、染料及药品的重要中间体[2]。
苯甲醛的合成方法有苯甲醇氧化法[3-5]、甲苯气/液相氧化法[6-8]、氯苄水解法、间接电氧化法等[9-12],工业上生产苯甲醛主要采用甲苯氧化法和氯苄水解法[13]。甲苯气/液相氧化法副产物较多,苯甲醛选择性不高;氯苄水解法采用间歇方式生产,反应时间长,工艺控制不稳定,生产效率低,成本较高。
目前,全球氯化苄生产量约40万吨/年。在氯化苄生产中产生了大量富含苄亚甲基二氯的精馏残液,数量达氯化苄产量的7%~10%。该残液难以处理,成为影响氯化苄正常生产的重要因素。以该残液为原料,开发苯甲醛规模化生产工艺技术,可实现废弃物的资源化利用,具有显著的成本优势。
为了突破苯甲醛间歇生产方式的限制,美国一专利提出了在盐酸催化下三釜串联连续合成苯甲醛的方法,苯甲醛的收率最高达 97.5%[9]。另一专利提出了在金属盐催化下多釜串联合成芳香醛的工艺方法,收率最高可达96%[14]。多釜串联工艺为苯甲醛的连续化生产提供了可能,但实际应用时设备复杂,投资大,过程连续控制难以稳定,物料返混严重。该工艺方案未见实际应用报道。
微通道反应器与常规反应器相比,具有传热传质性能好、效率高、连续化操作方便、物料返混少等特点[15-17],尤其适用于常规反应器中存在传热传质瓶颈问题的强放/吸热、非均相的液-液反应。对微通道的结构进行脉冲式混合设计,可进一步强化相间混合效果,使之逼近平推流反应器(PFR)的性能。
本文利用具有特定脉冲混合结构的微通道反应器为实验装备,在前期研究工作基础上[18-19],以苄亚甲基二氯为原料水解合成苯甲醛,研究其连续化新工艺,合成路线如图1所示。反应器卓越的量产化设计特点使开发的连续工艺极易规模化生产应用。本研究考察了反应温度、催化剂起始浓度、物料的摩尔配比、停留时间对苄亚甲基二氯水解反应的影响,优化了工艺参数,获得了最佳的合成条件,为苯甲醛连续合成工艺的生产应用奠定了研究基础。
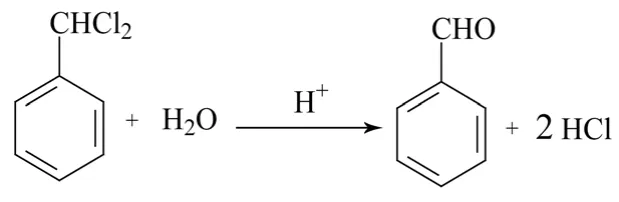
图1 苄亚甲基二氯水解反应方程式
1 实验部分
1.1 实验试剂
苄亚甲基二氯(以工业氯化苄残液精馏自制,经 GC分析≥98%);工业盐酸;碳酸钠(AR,国药集团化学试剂有限公司)。
1.2 实验仪器
G1型脉冲混合式微通道反应器,美国Corning Inc.;HYM-PO-B2-NS-08型计量泵,日本Fuji-Techno Industries Corporation;TBP5002T型计量泵,上海同田生物技术公司;HR-50型恒温换热循环器,无锡晟泽理化器械公司;GC-9890A型气相色谱仪,上海灵华仪器公司。
脉冲混合结构微通道反应器由 Corning Inc.提供,由玻璃模块和相关连接件组成。玻璃模块由 4层玻璃经特殊加工而成,形成3层空腔,外侧两层空腔构成换热通道,中间层空腔构成物料反应通道(图2)。反应通道由若干具有全混流特征的微型脉冲混合结构单元串联组成,微通道特征尺寸a=1 mm,b=10 mm(图3)。通过组合反应模块、连接件、物料输送装置形成反应器系统,可同时实现物料的强制混合、停留时间的精确控制及物料与热媒间的高比表面积换热。

图2 康宁微通道反应模块结构示意图

图3 微通道脉冲混合结构单元示意图
1.3 分析条件
RESTEK-5f0.25 mm×30 m玻璃毛细管柱;FID检测器;柱温180 ℃;检测室温度250 ℃;汽化室温度250 ℃;载气(氮气)压力0.4 MPa;氢气0.4 MPa;进样量0.2 μL。
苄亚甲基二氯水解的产物除苯甲醛外,还有少量苯甲醇、苯甲酸副产物。实验中所有样品的气相色谱分析结果显示,纯化后苄亚甲基二氯的水解产物中苯甲醇、苯甲酸副产物的总含量均不超过0.1%。
1.4 实验步骤

图4 微通道反应工艺流程示意图
将苄亚甲基二氯、盐酸分别经计量泵 1、计量泵2输入到反应器的直型通道模块进行预热,然后进入脉冲混合通道发生反应。通过对恒温换热循环器的温度设置控制反应温度,通过调整通道的长度及物料流速来调节反应的停留时间。降温至室温终止反应,从出口管取样,静置分层,取出有机相用10%碳酸钠和去离子水依次洗涤至中性后,气相色谱分析。反应流程示意图见图4。
2 结果与讨论
在传统的苄亚甲基二氯水解制备苯甲醛间歇釜式生产工艺中,通过控制水的滴加速度来维持反应的进行。水滴加速度过快,易导致反应温度上下波动,使反应过快而冲料,或使反应速度减慢而停止。滴加过慢则造成反应时间冗长,生产效率低。微通道反应器的微型化尺寸强化传热、传质效果,使得对反应温度、进度的控制更为精准。连续化操作工艺使工艺过程更加稳定。本文在微通道反应器中研究了反应温度、盐酸催化剂起始浓度、反应物料摩尔比、停留时间等主要因素对连续合成反应的影响。
2.1 温度对反应的影响
盐酸与苄亚甲基二氯的摩尔比 15∶1,盐酸催化剂起始浓度为 20%(质量分数,下同),停留时间370 s,考察了反应温度对反应的影响,结果如图5所示。
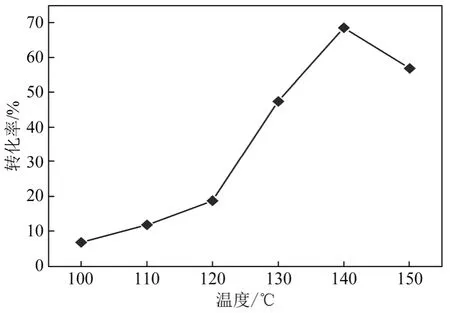
图5 温度对反应的影响
从图5可见,随着反应温度的升高,苄亚甲基二氯的转化率不断上升,在 120~140 ℃的增速明显高于100~120 ℃的增速;在140 ℃达到最大值后开始下降。适宜的反应温度范围为120~140 ℃,这与专利[9]中反应温度的优选范围 100~200 ℃有所不同。其原因在于,温度较低时,反应体系的能量较低,C—Cl键断裂较为困难,苄亚甲基二氯水解活化分子数较少,反应转化率低;温度升高后,活化分子数增加,反应速率上升,苄亚甲基二氯的转化率增加。三釜串联工艺在反应的同时可释放出一部分HCl产物,微通道反应工艺只在反应物料排出后才释放出HCl产物。温度高于140 ℃时,HCl在液相中的溶解度急剧降低,物料气化加剧,反应效率下降,转化率降低,因而选择较低的反应温度。
2.2 盐酸催化剂起始浓度对反应的影响
盐酸与苄亚甲基二氯的摩尔比 15∶1,反应温度140 ℃,停留时间370 s,考察了盐酸催化剂起始浓度分别 5%、10%、15%、20%、25%、30%时对反应的影响,结果如图6所示。
从图6可见,盐酸催化剂最佳起始浓度为20%,与专利[9]中优选的盐酸浓度 10%~33%也有所不同。在苄亚甲基二氯水解过程中,盐酸即是反应的催化剂,也是反应的产物。随着反应的进行,生成的HCl溶于水不断形成盐酸,增加了酸浓度。随着催化剂浓度的增加,活化分子数量显著增加,使反应速度迅速提升。但当反应体系中作为产物之一的盐酸浓度过高时,会抑制反应的进行,导致转化率下降。三釜串联工艺在反应的同时可分离出HCl产物,产物对反应的抑制作用较弱,因而可采用更宽的盐酸催化剂浓度。
2.3 物料摩尔配比对反应的影响
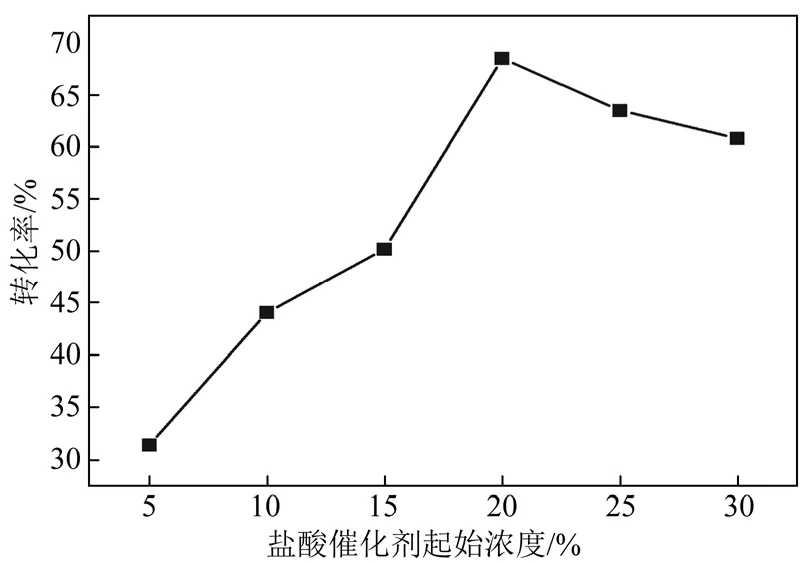
图6 盐酸催化剂起始浓度对反应的影响

图7 物料摩尔比对反应的影响
盐酸催化剂起始浓度为20%,反应温度为140℃,停留时间 370 s,考察了工业盐酸溶液与苄亚甲基二氯的摩尔比分别为2.5∶1、5∶1、10∶1、15∶1、20∶1、25∶1、30∶1时对反应的影响,结果如图7所示。
从图7中可见,在摩尔比小于15∶1之时,随着摩尔比的增加,原料的转化率迅速增加,且摩尔比(10~15)∶1间增加的速率高于10∶1以下;摩尔比大于15∶1后,原料转化率反而出现了缓慢的下降,较佳的物料配比为(10~15)∶1,这于专利[9]中优选的摩尔配比(10~25)∶1差别不大。其原因在于,随着盐酸/苄亚甲基二氯摩尔比的增加,反应原料水的投入量增加,可增加水解反应中活性底物与水分子的碰撞概率,增加反应速率,使转化率提升。当水量过大时,水对苄亚甲基二氯水解底物的稀释作用渐渐成为主要影响因素,导致碰撞反应概率反而有所降低。
2.4 停留时间对反应的影响
盐酸与苄亚甲基二氯的摩尔比 15∶1,盐酸催化剂起始浓度为20%,反应温度140 ℃条件下,考察停留时间分别为250 s、290 s、330 s、370 s、410 s时对反应的影响,结果如图8所示。
从图8可见,反应的最佳反应停留时间为370 s。
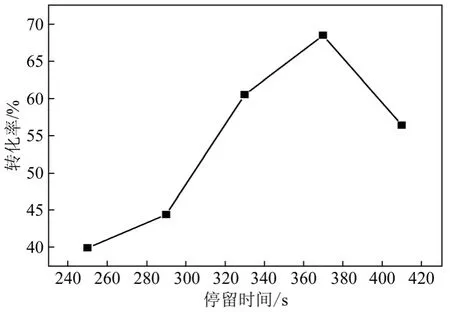
图8 停留时间对反应的影响
在本研究中,采用了反应通道体积固定的微通道反应器,不同的停留时间对应着不同的流速,停留时间越短,流速越高,反之亦反。物料在脉冲混合结构微通道中流动时,流速越高,混合效果越好,越慢则越差。因而,在该反应装备中,较短的停留时间对应着较强的混合效果,较长的停留时间对应着较弱的混合效果。在停留时间低于370 s时,停留时间对反应的影响是主导因素,反应转化率随着时间的延长而上升;当停留时间超过370 s后,混合效果成为影响反应的主导因素,反应转化率随着时间的延长而下降。在三釜串联专利[9]报道中,当停留时间约为60 min时,可达到97.5%以上的原料转化率。本研究中停留时间约为其1/10(370 s),原料转化率最高达 69.2%。连续水解工艺可通过改进反应装置,在维持物料混合强度的同时延长反应的停留时间,以实现更高的转化率。
3 结 论
(1)以苄亚甲基二氯为原料,盐酸为催化剂,在脉冲式混合结构微通道反应器中研究了苯甲醛的连续化合成工艺,为该技术的生产应用奠定了基础。
(2)研究了苄亚甲基二氯连续水解反应的最佳工艺条件为:盐酸与苄亚甲基二氯物料摩尔比为15∶1,盐酸催化剂起始浓度为20%(质量分数),反应温度为140 ℃,停留时间为370 s。此时苄亚甲基二氯的转化率达到69.2%,选择性超过99.9%。
[1] 张跃. 精细化工中间体生产流程图解[M]. 北京:化学工业出版社,1995.
[2] Justinus A B Satrio,Doraiswamy L K. Production of benzaldehyde:Acase study in a possible industrial application of phase-transfer catalysis[J]. Chemical Engineering Journal,2001,82:43-56.
[3] Hanyu A,Takezawa E,Sakaguchi S,et al. Selective aerobic oxidation of primary alcohols catalyzed by a Ru(PPh3)3Cl2/hydroquinone system[J].Tetrahedron Letters,1998,39(31):5557-5560.
[4] Tamami B,Yeganeh Hamid. Pyrazine-based polymeric complex of oxodiperoxochromium(Ⅵ)compound as a new stable,mild,efficient,and versatile oxidant in organic synthesis[J].Tetrahedron,1997,53(23):7889-7896.
[5] 王利,刘丹,朱香芹,等. 酸性离子液体中苯甲醇催化氧化合成苯甲醛[J]. 工业催化,2007,15(10):27-30.
[6] Van der Wiele K,Van der Berg P J. Oxidation of toluene over bismuth molybdate catalysts[J].Journal of Catalysis,1975,39:437-440.
[7] Germain J,Elaugier R. Catalyst of toluene oxidation to benzaldehyde[J].Bull Soc. Chem. Fr.,1972,2:541-548.
[8] 罗晓鸣,陈宁,陈懿,等. V2O5-SnO2二元氧化物组分间的相互作用及其催化甲苯氧化性能的研究[J]. 催化学报,1988,9(4):351-357.
[9] Friedrich Brühne,Karl-August Lipper. Process for the preparation of benzaldehyde:US,4229379[P]. 1980-10-21.
[10] 张卫香,邵学广,张汉昌,等. 苯甲醛系列化合物的电合成[J]. 化工进展,2000,19(4):24-27.
[11] 王文英,刘伟,丁克强,等. 间接电氧化法合成苯甲醛[J]. 现代化工,1996(6):33-35.
[12] 缪伶,朱宪. 苯甲醛绿色化生产进展[J]. 上海大学学报:自然科学版,2002,8(4):334-347.
[13] 胡乐晓,郜胜. 苯甲醛合成工艺研究进展[J]. 精细石油化工进展,2011,12(9):42-47.
[14] Gilbert Billeb,Kelkheim Taunus,Georg Folz. Process for the continuous production of aromatic aldehydes:US,5382694[P].1995-1-17.
[15] 陈光文,袁权. 微化工技术[J]. 化工学报,2003,54(4):428-439.
[16] 韩非,余武斌,李郁锦. 微通道反应器中催化裂解合成N,N-二甲基丙烯酰胺新工艺研究[J]. 高校化学工程学报,2009,23(1):166-170.
[17] 赵玉潮,应盈,陈光文,等. T形微混合器内的混合特性[J]. 化工学报,2006,57(8):1885-1890.
[18] 严生虎,沈卫,张跃,等. 微通道反应器内乙苯连续氧化反应工艺研究[J]. 现代化工,2012,32(4):94-97.
[19] 严生虎,张沫,张跃,等. 毫米通道内氯苯-水非均相体系混合效果研究[J]. 化学工程,2012,40(6):47-50.

