十二烷醇对酵母细胞影响的研究
杨 攀,袁永俊,*,王 健,胡丽丽,代亚民,代 斌
(1.西华大学生物工程学院,四川成都610039;2.四川省产品质量监督检验检测院,四川成都610031)
固定化酵母又叫固定化活细胞或固定化增殖细胞,是指用适当的载体材料和科学的方法将活酵母固定在载体上,使该细胞能在适宜的条件下不断生长繁殖,从而能促使有机物质连续地进行反应[1]。固定化酵母细胞的应用,使乙醇萃取发酵得到迅速的发展。Minier和 Coma较早提出了乙醇发酵的方案[2],他们将酵母细胞固定化,并在培养基中加入十二烷醇进行内部随程萃取发酵,结果葡萄糖转化比较彻底,乙醇产率也比较高。本研究在游离酵母细胞和固定化酵母细胞中加入十二烷醇萃取剂,并通过测定内部随程发酵和外部随程发酵后残糖含量以及细胞生的OD值作为指标分析,探讨十二烷醇对酵母游离细胞和固定化细胞的影响。
1 材料与方法
1.1 材料与仪器
十二烷醇、葡萄糖、海藻酸钠 成都科隆试剂有限公司;安琪牌活性干酵母 湖北安琪酵母股份有限公司。
电子天平 北京塞多利斯天平有限公司;SHB-A型水浴恒温振荡器 荣华有限公司;UV-2600型紫外可见分光光度计 龙泥科上海有限公司;PHS-25型酸度计 成都方舟科技开发公司。
1.2 实验方法
1.2.1 酵母细胞的固定化 按每100mL蔗糖加入3~4g活性酵母的比例,在2%蔗糖水中32℃条件下活化2h。加入糖度为10Be的麦芽汁培养基[3],放入摇床中在28℃,120r/min条件下增殖24h。将增殖后的培养液无菌条件下用离心管分装,在3000r/min、4℃下离心10min弃去上清液,加入适量无菌生理盐水,将其振荡打散以清洗菌体,重复三次,最后一次用无菌水混合菌体制备菌悬液(每1mL菌悬液中含有0.2g 湿菌体)[4]。与 3% 的海藻酸钠溶液[5]混合均匀,利用注射器吸取混合液,无菌条件下滴入2%CaCl2溶液,形成球状颗粒。冷冻或常温下静置2h以上,使其充分固化后,再用无菌水洗涤三遍[6]。
1.2.2 固定化酵母的增殖 每50g固定化酵母颗粒中加100mL增殖培养基,摇床30℃,120r/min,震荡培养 24h[7]。
1.2.3 细胞生长OD值的测定 细胞生长状况的测定采用分光光度计法,在600nm处测吸光度[8]。
游离细胞生长测定:吸取1mL样品菌液于微量离心管中,1200r/min离心1min,弃上清夜,再充分震荡将菌体完全分散,定容至10mL,摇匀,以蒸馏水为对照,在600nm处测定OD值。
固定化细胞生长测定;将一粒固定化小球溶于含有7mL磷酸溶液的试管中(8%KH2PO4+7%K2HPO4,pH6.5),震荡 2h 溶解,4000r/min 离心10min,生理盐水定容至10mL,以蒸馏水为对照,在600nm处测定OD值。
1.2.4 残糖测定方法 剩余残糖的测定采用斐林试剂法[9]。
2 结果与分析
内部随程萃取是指萃取剂在反应器中与培养基直接接触,以便将产物萃取到溶剂中去。外部随程萃取是指将培养液引出反应器,萃取剂和培养液在另外的萃取装置中接触,从而萃取产物的过程[10]。
2.1 萃取剂对游离细胞发酵的影响(内部随程萃取发酵系统)
从图1可以看出,随着萃取剂浓度的增加,细胞生长OD值下降,萃取剂对游离细胞毒害增加,4条细胞生长曲线分散,差别比较大,酵母细胞的生长受到较大抑制。造成这种现象的原因可能是有机溶剂对细胞存在“相”毒性和“分子”毒性,“相”毒性由两相界面引起,“分子”毒性由溶解于水中的有机溶剂作用而引起[11]。由于游离的酵母细胞在培养基中直接和萃取剂接触,萃取剂的浓度越大,根据扩散现象,进入细胞里面的浓度也越大,产生的毒害作用越强,细胞生长就会下降。
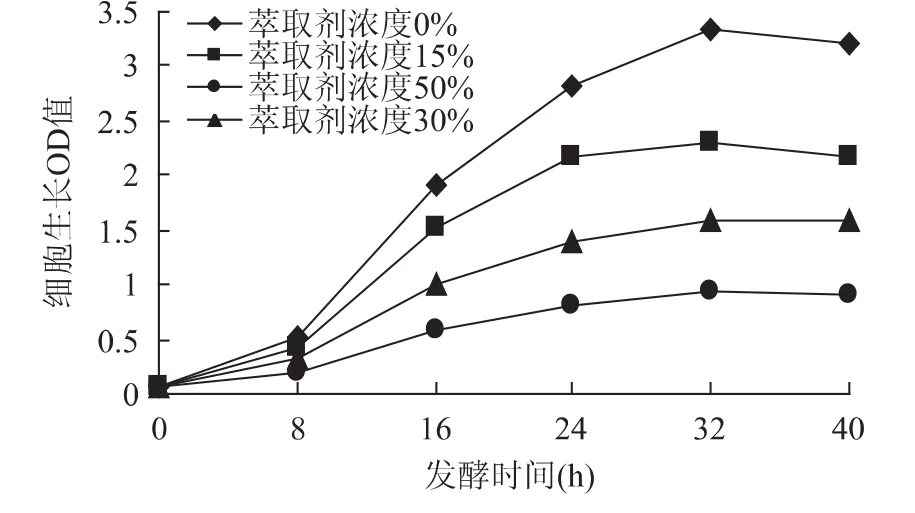
图1 萃取剂浓度对细胞生长OD值的影响Fig.1 Effect of extraction solvent’s concentration on cell’s growth
从图2可以看出,随着萃取剂浓度增加,糖的降解率降低,这正与图1中细胞生长下降的现象相符合,萃取剂浓度高时酵母菌的生长受到抑制,葡萄糖没有被酵母菌充分利用,从而导致残糖的含量很高,在发酵40h左右时,残糖含量最高达8%左右,没添加萃取剂的残糖含量仅为1.5%,两者差别大。
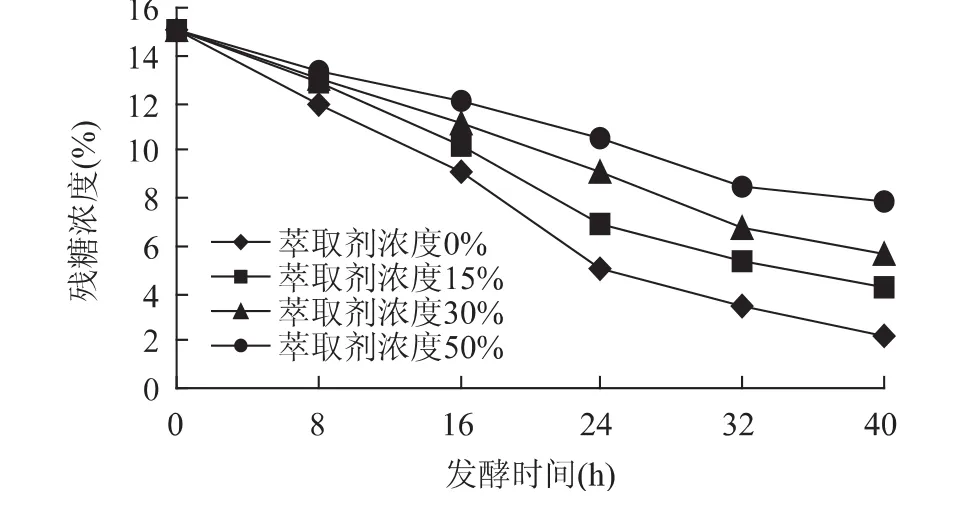
图2 萃取剂浓度对残糖浓度的影响Fig.2 Effect of extraction solvent’s concentration on residual sugar
2.2 萃取剂对固定化细胞的影响(内部随程萃取发酵系统)
从图3变化可以看出,随着萃取剂浓度的增加,萃取剂对固定化细胞的毒害仍然存在,但是相比较游离细胞来说明显有所改善,内部随程萃取发酵时高浓度的十二烷醇与培养液存在“相”现象,有机溶剂会部分扩散到培养液中,由于两者在同一装置中,培养液中萃取剂的浓度会维持在一个稳定的状态,培养液中的有机溶剂分子就会渗透到细胞内,对细胞产生毒害作用,对发酵产生了一定影响。相比游离细胞,细胞固定化,可以较大程度地减少有机溶剂和生物细胞的接触,减小了“分子”毒性的影响,因而有效地缓解有机溶剂的毒害作用。4条细胞生长曲线已经稍微接近,证明固定化细胞对萃取剂的毒性有良好的抵抗能力。
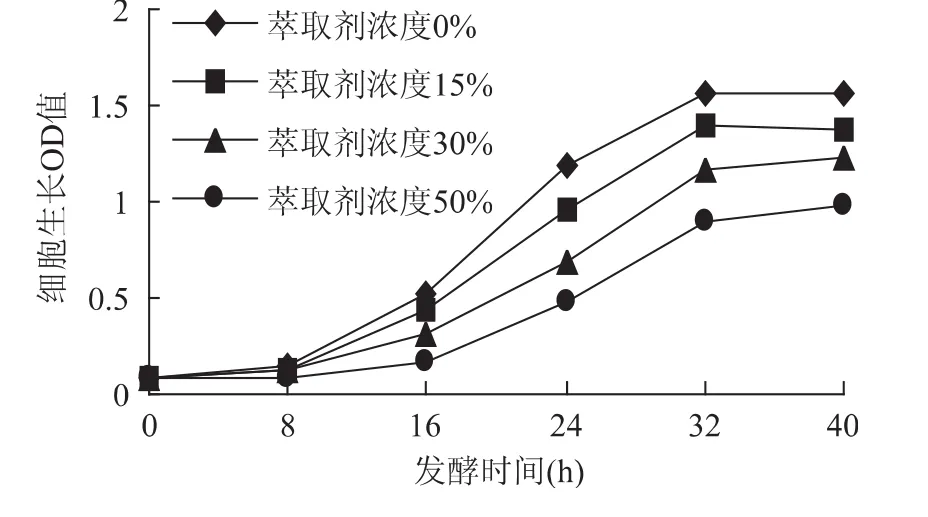
图3 萃取剂浓度对细胞生长OD值的影响Fig.3 Effect of extraction solvent’s concentration on cell’s growth
从图4可以进一步看出,固定化细胞所带来的实际效果,由于细胞的生长不再像之前那样受萃取剂的严重毒害,降糖效果比较良好,各条降糖曲线相对比较接近,固定化细胞内部随程萃取发酵系统已经有了较好的结果,残糖含量剩下了3%左右,但是,仍然可以看到萃取剂对细胞的毒害以及其他方面的抑制作用存在。
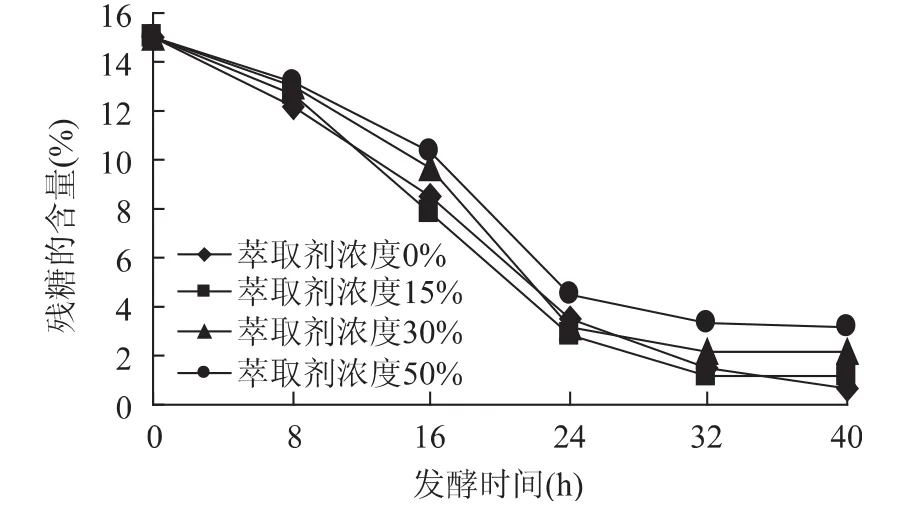
图4 萃取剂浓度对残糖浓度的影响Fig.4 Effect of extraction solvent’s concentration on residual sugar
2.3 萃取剂对固定化细胞的影响(外部随程萃取发酵系统)
从图5和图6可以看出,随着萃取剂浓度的增加,萃取剂对固定化细胞毒害再次降低,各条曲线进一步接近。而残糖的变化趋势曲线几乎有合拢的趋势,残糖在发酵40h后基本上是在1%左右。从细胞生长OD值和残糖的变化趋势两个指标,足以证明萃取剂对固定化细胞外部随程萃取发酵系统的影响已经达到令人满意的效果。因为固定化细胞外部随程萃取时,由于萃取剂和培养液在两个装置中,消除了“相”毒性的存在,同时由于培养液中的萃取剂仅为萃取结束后培养液返回时携带的少量溶剂,“分子“毒性降低到了最小,因此对细胞的毒害作用很小。从残糖的含量对比就可以得出来。不同浓度的萃取剂其残糖含量差别很小。
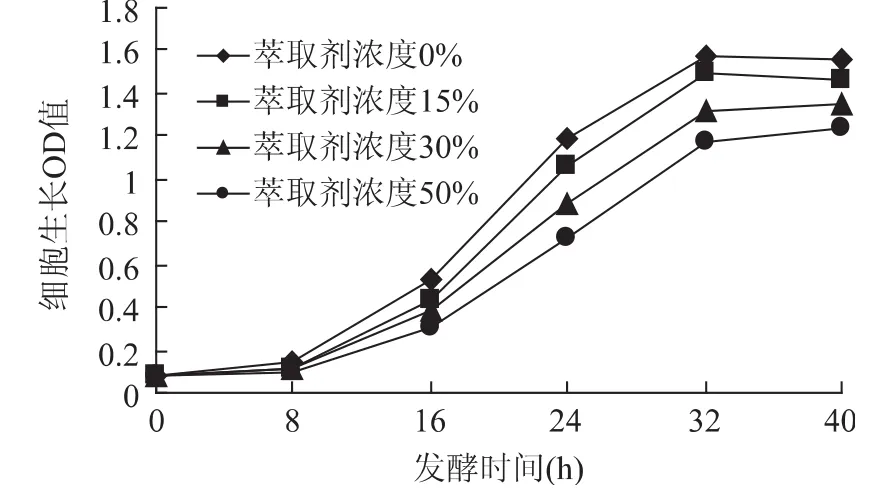
图5 萃取剂浓度对细胞生长OD值的影响Fig.5 Effect of extraction solvent’s concentration on cell’s growth
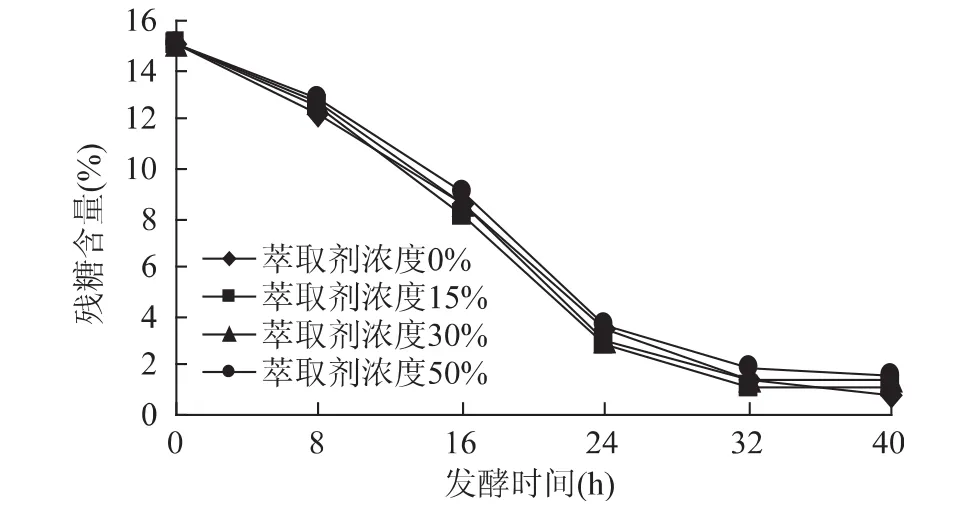
图6 萃取剂浓度对残糖浓度的影响Fig.6 Effect of extraction solvent’s concentration on residual sugar
3 结论
3.1 采用不同浓度的萃取剂对游离酵母细胞和固定化酵母细胞的毒害性进行分析,从生长曲线和残糖含量两个指标考察,随着萃取剂浓度的增加,对游离的细胞的毒害也在增加,生长曲线很散,酵母生长受到抑制,使得残糖含量也比较大。
3.2 萃取剂对固定化细胞毒害性相对较小,外部随程发酵效果比内部随程发酵效果更明显,从生长曲线和残糖含量知道萃取剂的影响很小。因此对固定化细胞采取外部随程发酵是最佳的方法。
[1]宋向阳,余世袁.生物细胞固定化技术及研究进展[J].化工时刊,2000(11)37-38.
[2]王轶雄,方序,陈敏.非常规介质中细胞生化反应研究进展[J].中国生物工程杂志,2002,22(4):80-83.
[3]熊有枝.麦芽汁糖化温度对糖化时间的影响[J].武汉工业学院学报,2003(2):58-62.
[4]王岩.固定化增殖酵母载体与活性干酵母在酒精生产中对照试验[J].酿酒,2003(3):56-57.
[5]王宇光,许文友,王克明.混合载体固定化酵母酒精萃取发酵的研究[J].烟台大学学报,2001(4):249-254.
[6]赵玲,孙清,刘荣厚,等.固定化酵母流化床生物反应器木薯淀粉酒精发酵的研究[J].可再生能源,2005(1):16-19.
[7]吕跃刚,马家津.固定化细胞颗粒珠制备条件的研究[J].北京工商大学学报,2004(4):12-14.
[8]陈敏,王轶雄,方序.非常规介质中乳酸萃取发酵条件的研究[J].中国食品学报,2004(3):45-46.
[9]张正奇.分析化学[M].北京:科学出版社,2006.
[10]李寅,陈坚,郁明.生物反应与产物分离组合技术的研究进展[J].化学进展,1997,9(3):283-290.
[11]Bar R.Effect of interphase mixing on a water-organic solvent two-liquid phase microbial systems:ethanal fermentation[J].J Chem Techno1 Biotechnol,1988(43):49-62.

