胰腺实性假乳头状瘤肝转移一例
朱永高,吕梁
病例资料 患者,女,14岁,右上腹不适半年,外院B超示肝右叶多发囊实性混合回声病灶,提示肝脏占位病变;血常规、肝、肾功能、电解质、肿瘤标记物AFP、CEA、CA19-9均未见异常。CT检查:CT平扫示肝右叶多发囊实性占位病灶,边界光滑,实性成分沿囊壁呈壁结节状散在分布,囊内可见纤细分隔(图1);增强扫描动脉期、门脉期、延迟期示囊壁、实性壁结节及纤细分隔呈持续不均匀强化(图2~4)。CT检查后补充询问病史,患者2008年曾行胰腺体尾部实性假乳头状瘤切除术,考虑为转移性病灶。患者于云南省第一人民医院行右半肝切除术,术中所见:肝脏表面光滑,肝右叶可见2个巨大囊性占位,大小约10cm×10cm,内囊液为暗红色,囊壁上有水泡样突起,左肝未见异常。病理肉眼及光镜所见:右半肝切面呈囊实性,可见坏死,瘤组织呈巢团状排列,浸润性生长,细胞形态较一致(图5)。病理诊断:(右半肝)恶性肿瘤。免疫组化:Vim(+)、CK 广(-)、CK 低(-)、CD10(+)、α-AAT(+)、SYN(+)、CD56(+)、CgA(+)、hepa(-)、glypican-3(+)、CD34(-)、S-100(-)、Ki-67阳性约15%(图6)。免疫组化诊断:(右肝)胰腺实性假乳头状肿瘤肝转移。
讨论 胰腺实性假乳头状瘤(solid-pseudopapillary tumor of pancrease,SPTP)于1959年首次报道,据统计,其占胰腺原发肿瘤的0.17%~2.50%,年轻女性多见[1]。2004年 WHO肿瘤组织学分类将其统一命名为实性假乳头状瘤,定义为由形态比较一致的细胞形成的实性巢状和假乳头结构的上皮性肿瘤,常伴出血及囊性变,通常为良性,偶尔可为恶性。免疫组化研究发现SPTP在胰腺内、外分泌和局灶性上皮均有表达,提示SPTP可能起源于胰腺胚胎多能干细胞。
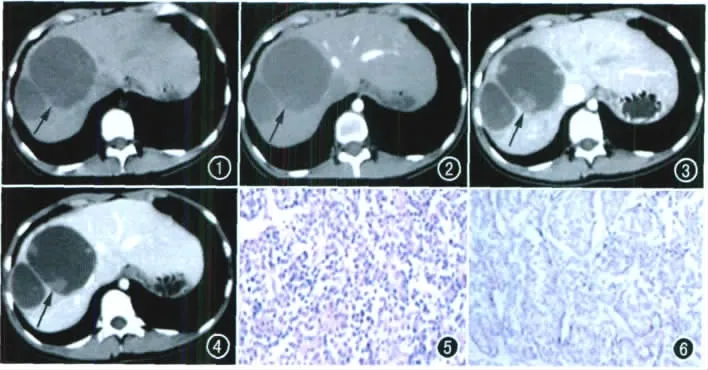
图1 CT平扫示病灶呈囊实性,边界清楚(箭)。 图2 CT增强动脉期示病灶囊内实性成分浅淡强化(箭)。 图3 CT增强门脉期示囊壁、纤细分隔强化,实性成分呈壁结节状分布(箭)。 图4 CT增强延迟期示囊壁、纤细分隔及实性壁结节持续强化(箭)。 图5 镜下示瘤组织呈巢团状排列,浸润性生长,细胞形态较一致(×100,HE)。 图6 免疫组化图示Vim(+)、CD10(+)等。
SPTP病理成分不同,影像学表现亦不同。肿瘤由实性区、假乳头区及二者的过渡区组成,实性区由较为一致的瘤细胞构成,呈片块状或巢状排列,影像学表现为相对均匀的实性成分,实性区亦可因退变、坏死出现微囊,表现为实性成分中的小囊变灶;假乳头区肿瘤细胞排列成片状、索条状或围绕血管及坏死区呈放射状、假乳头状排列,为SPTP的重要病理学特征,影像学表现为不均匀的囊实性区;二者间的过渡区细胞成分相对较少,肿瘤组织围绕血管形成假菊形团,同时离血管较远的区域易发生坏死,表现为完全的囊性区。SPTP具有延迟强化的特点,即实性成分于动脉期、门脉期、延迟期逐渐强化,这是因为实性区与假乳头区之间的过渡区形成假菊形团,相对较少的肿瘤细胞呈网状排列并形成血窦,因此影像学上表现出类似海绵状血管瘤延迟强化的特点,但三期强化程度均低于正常胰腺实质,囊性成分始终无强化。病灶内间隔的强化也体现出延迟强化的特点,且强化程度多高于肿瘤实性部分,仅在动脉期强化程度低于胰腺实质。本例肝脏转移病灶因与SPTP的组织同源,故在影像上与胰腺原发病灶表现一致。
SPTP是一种具有低度恶性倾向的肿瘤,其生物学行为相对良好,复发和转移不常见。文献报道约15%的患者出现肝转移和腹膜转移,总体5年生存率约95%[2],发生转移的患者行转移灶切除及术后复发患者再次行手术切除均可取得较好的效果。
[1]卢光明,徐健,陈君坤.CT读片指南[M].南京:江苏科学技术出版社,2011:369-371.
[2]Hemandez JM,Centeno BA,Kelley ST.Solid pseudopapillary tumors of the pancreas:case presentation and review of the literature[J].Am Surg,2007,73(3):290-293.

