Shewanella piezotolerans WP3中sulfotransferase基因的克隆表达与活性研究
韦海澜,李艳霞,李升康
(1.汕头大学生物系,广东 汕头 515063;2.汕头大学海洋生物研究所,广东 汕头 515063)
0前言
磺基转移酶(sulfotransferase,简称ST)可以催化硫酸基从供体3'-磷酸腺苷-5'-磷酰硫酸(3'-phosphoadenosine-5'-phosphosulfate,简称PAPS)转移至如糖类、蛋白质和各类小分子新陈代谢产物[1-2].磺基转移酶是一个基因超家族,包括酚磺基转移酶、雌激素磺基转移酶、羟基类固醇磺基转移酶以及脱水表雄甾酮磺基转移酶等[3-4].磺基转移酶在动植物及微生物中均有发现[5],但目前对于这类酶的研究主要集中在真核生物[6-7].根据胞内分布和作用底物,真核生物的磺基转移酶被分为两大类别:酚(SULT1)和羟类固醇(SULT2)两大亚族.胞质溶胶的ST可将硫酸基转移至类固醇和其他疏水性的代谢产物上,而高尔基体中的ST则可以硫酸化细胞膜上的糖类和分泌蛋白.相比之下,对细菌ST的分布和功能以及其产物的研究则比较少.
本文以从西太平洋的深海沉积物中分离得到的耐冷耐压菌株WP3为研究材料[8-9],通过克隆表达其磺基转移酶基因并分离异源表达蛋白,以期为后续实验的WP3胞外寡糖的离体(in vitro)硫酸化修饰工作奠定基础.
1 材料与方法
1.1 材料与试剂
1.1.1 材料
菌株WP3为国家海洋局第三海洋研究所海洋遗传资源重点实验室惠赠.大肠埃希菌(E.coli)Top10和BL21(DE3)由汕头大学微生物实验室提供.
1.1.2 试剂
表达载体pQE-30、pQE-70基因组DNA提取试剂盒购于德国Qiagen公司.PCR扩增所用的引物由上海生物工程公司合成,DNA凝胶回收试剂盒以及质粒小量提取试剂盒均购于美国OMEGA公司.克隆载体pMD19-T、Ex-Taq DNA聚合酶、限制性内切酶BamHⅠ和HindIII、T4 DNA连接酶以及DL2000 DNA Marker均购于宝生物工程(大连)有限公司(TaKaRa).Ni-NTA matrix及柱子购于英国Amersham Pharmacia公司,蛋白凝胶电泳染色和脱色采用厦门鹭隆生物公司的蛋白染色试剂盒.
1.2 方法
1.2.1 引物的设计合成
根据GenBank进行同源性搜索,设计了两对sulfotransferase引物.利用GeneTool软件设计并合成特异性引物(由上海生物工程公司合成):PCR引物设计用DNAstar,基因Swp1579的引物序列为:上游引物Swp1579-F:5'GCGT GCA TGC AAT TGT TTT TAT ATA TCA 3'引入SphⅠ酶切位点(下划线部分);下游引物Swp1579-R:5'GCGCG AAG CTT CTA CTC TAT AAT CGG TTT 3'引入HindⅢ酶切位点(下划线部分).基因Swp4147的引物序列为:上游引物Swp4147-F:5'ACAT GCA TGC GA AAA AAG ACA ATT TTA G 3'引入SphⅠ酶切位点(下划线部分);下游引物Swp4147-R:5'GGA AGA TCT TTT GCT GAA TAG CTT CTG A 3'引入BglⅡ酶切位点(下划线部分).
1.2.2 WP3 DNA提取和PCR扩增
WP3使用2216E培养基,于20℃条件下培养,液体培养基设定摇床转速为150 r/min.DNA提取采用酚氯仿抽提方法,用20 μL灭菌双蒸水或者50 μL 10 mM TE缓冲液溶解沉淀,经分光光度计检测合格后-80℃保存.采用Pfu DNA聚合酶进行PCR扩增,PCR反应反应程序为:95℃ 3 min,95℃ 30 s,52℃ 30 s,72℃ 2 min以上,3步循环30次,72℃ 10 min.电泳检测PCR产物,并割胶回收.
1.2.3 PCR产物的克隆和测序
采用E.Z.N.A.TMPlasmid Mini KitⅠ柱式质粒提取试剂盒(Omega公司).利用T4 DNA连接酶将回收纯化的PCR产物与pMD19-T载体进行连接,连接产物转入经CaCl2处理的感受态细胞即E.coli Top 10克隆菌中.通过含氨苄青霉素抗性(Ampr)的LB平板进行抗氨苄筛选,挑取阳性菌落(含重组质粒)进行扩增提取质粒,并对质粒进行双酶切鉴定,pQE-30质粒采用PaeⅠ(SphⅠ)和HindⅢ限制性内切酶进行酶切反应,pQE-70质粒采用PaeⅠ(SphⅠ)和BglⅡ限制性内切酶进行酶切反应.对双酶切合理的质粒进行测序(由深圳华大基因完成)验证.
1.2.4 表达载体的构建以及测序
对测序正确的pMD19-T质粒与原核表达载体pET-32a(+)分别进行BamHⅠ和Hind III双酶切,并将获得的目的基因片段和切开的pET-32a(+)载体进行胶回收.利用T4 DNA连接酶16℃过夜酶连.将重组质粒转化入E.coliTop10,通过含氨苄青霉素抗性(Ampr)的LB平板进行抗氨苄筛选.提取阳性质粒并测序鉴定.
1.2.5 重组目的蛋白在E.coli BL21(DE3)中的表达
将重组表达载体转化到E.coli BL21(DE3)中,阳性菌落于20 mL LB培养基中,37℃ 160 r/min过夜培养.次日转接至500 mL灭菌的新鲜的培养基中,再加入500 μL氨苄青霉素进行培养.待菌液OD595值为0.5~0.6时,取1 mL菌液作为诱导前的对照,其余菌液加入500 μL IPTG 25℃低温诱导4 h.诱导后取1 mL菌液作为诱导后的对照,分别将诱导前、诱导后的菌液离心,并分别用1 mL去离子水清洗,用80 μL纯净水重悬菌体.将上述诱导后的菌液离心、弃上清,沉淀用Tris-HCl(pH8.0)溶解,溶解后超声破碎30 min后离心.将沉淀和上清分装:沉淀先用1 mL去离子水清洗,离心弃上清,用80 μL去离子水重悬.取上清80 μL.然后将诱导前、诱导后的上清和沉淀80 μL分别加入20 μL Loading Buffer,进行蛋白凝胶SDS-PAGE.电泳检测表达情况,以确定其表达产物的可溶性.蛋白凝胶电泳参照《分子克隆实验指导》(第二版).
1.2.6 重组目的蛋白的纯化及浓度测定
采用Ni2+亲和层析法纯化目的蛋白.上样用平衡液(20 mmol/L Tris-HCl,150 mmol/L NaCl,pH 8.0)平衡柱子,分别用40,100,300 mmol/L的咪唑进行洗脱,分别收取洗脱峰液.SDS-PAGE检测纯化结果.采用TIANGEN公司的蛋白质定量试剂盒测定蛋白浓度.
1.2.7 磺基转移酶活性测定
磺基转移酶活性测定依照文献进行[10].化学反应为PAP+PNS→PN+PAPS,反应通过磺基转移酶ST实现.通过检测405 nm的吸光值来检测PN的生成量,PN的特定吸收峰在405 nm.通过PNS底物不同的添加量分析酶的活力情况.分析溶液:50 mmol/L PNS 30 μL,20 mmol/L PAP(磺基受体)290 μL,0.1 mmol/L Tris-HCl,pH8.0 210 μL,酶溶液100 μL,总体积630 μL.测量其于37℃下间隔5 min的405 nm吸光值,加入400 μL 1mol/L NaOH终止反应.
2 结果
2.1 WP3磺基转移酶基因的克隆和原核表达载体的构建
以S.piezotolerans WP3基因组为模板,用根据WP3基因组中含有的两个磺基转移酶基因设计的两对引物进行PCR扩增,均得到了特异的扩增条带,分别在900 bp和1700 bp左右,与预期相符(图1).PCR产物回收后双酶切,经胶回收后连入同样经双酶切的两对载体,转化E.coli,用PCR扩增引物进行菌落PCR挑选阳性克隆子并测序.
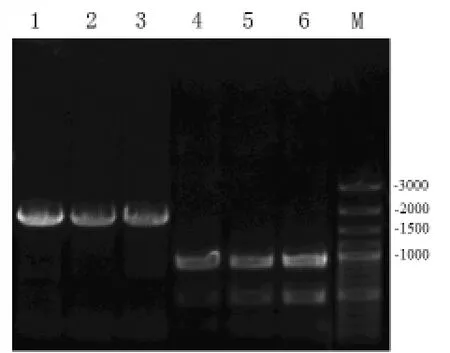
图1 PCR产物的琼脂糖凝胶电泳
2.2 WP3磺基转移酶的表达和纯化
全长849 bp的WP3磺基转移酶基因Swp1579和1707 bp的Swp4147基因分别被克隆到表达载体pQE-30和pQE-70上,在E.coli BL21(DE3)菌株中使用0.5mmol/L IPTG诱导表达,诱导前后的菌
体使用超声波破碎后取菌体总蛋白使用SDS-PAGE分析,可见在分子量约33KDa和60KDa处分别有明显增大的条带,并且Swp4147基因的重组蛋白表达量(图3)要多于Swp1579(图2).
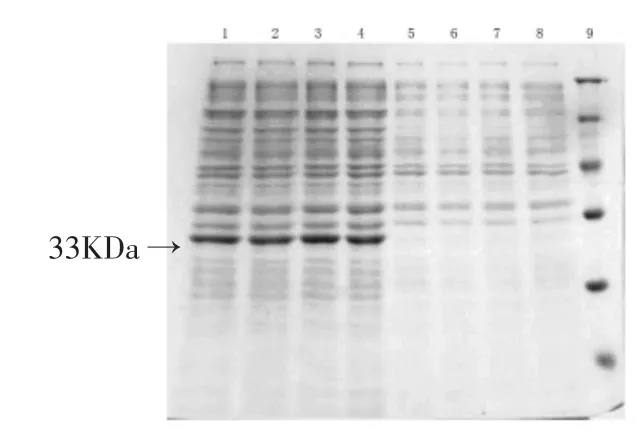
图2 Swp1579基因在E.coli BL21(DE3)中表达蛋白的SDS-PAGE分析结果
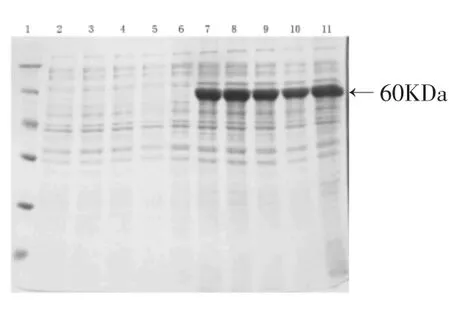
图3 Swp4147基因在E.coli BL21(DE3)中表达蛋白的SDS-PAGE分析结果
2.3 磺基转移酶活性测定
根据磺基转移酶在405 nm的吸光值检测到的PN得率,计算其酶活变化.其酶活变化见图4.由图4可知,本实验在E.coli表达的sulfotransferase rST均有酶活性.相对而言,重组的Swp4147的酶活稍强于Swp1579.
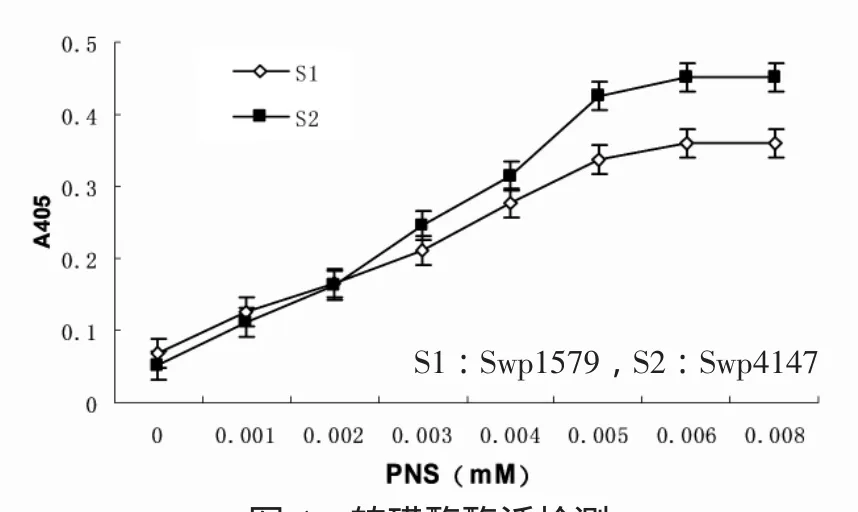
图4 转磺酶酶活检测
3 讨论
为了使目的基因的克隆得到充分的表达,我们在上游的实验设计中即选择了含有强力启动子的表达载体和高效表达宿主.试验结果表明,在IPTG诱导下,诱导温度为37℃时,两个基因的克隆子在表达宿主中均有表达重组磺基转移酶(rST),其中Swp4147基因克隆的重组蛋白表达水平较高.为了提高表达产物的可溶性,需要对温度和IPTG诱导浓度两方面条件进行优化.一般来说降低细菌的培养温度将降低外源基因的转录速度,减慢外源蛋白的合成速率,因而有利于外源蛋白的正确折叠,增加具有活性的可溶性蛋白产量.同时,WP3是一个低温菌[9],考虑使用低温诱导符合这一蛋白的原始表达折叠状态.
硫酸化多糖是一类非常常见的生物活性多糖(biologically active polysaccharides,BAP),而且因其具有很好的生物学活性近年来备受关注[11-12],硫酸化多糖是多糖的衍生物,由多糖链单糖分子上的某些羟基被硫酸根取代而形成.磺基转移酶在多糖的硫酸化修饰中起到了非常重要的作用[13].研究表明,海藻中的硫酸多糖,发现其具有体内抗肿瘤作用[14];美国国家癌症研究所对海洋无脊椎动物筛选发现,其水相提取物显示出较强的抗病毒活性,这些活性组分基本是硫酸多糖[15].另有研究也表明,有些本身不表现抗病毒活性的多糖,经人工化学修饰硫酸化后也具有抗病毒活性;而有抗病毒活性的硫酸多糖被脱去硫酸根后,即失去抗病毒活性.例如,卡拉胶和肝素等具有抑制疱疹病毒复制的作用[12],但是如果将这些多糖的硫酸根除去,上述活性则随之消失.
微生物多糖在工业和日常生活方面具有很多的应用价值,比如工业用的絮凝剂,食品用的保鲜剂,医药用的抗癌剂等等[16].目前,微生物中多糖的修饰包括硫酸化多糖的研究很不多,但是已有研究显示修饰多糖对微生物多糖的活性起了重要的作用.我们通过体外异源的表达表明,WP3中存在很强的磺基转移酶活性,且该酶的相关基因在WP3中存在多拷贝.
[1]Hiraoka N,Petryniak B,Nakayama J,et al.A novel,high endothelial venule-specific sulfotransferase expresses 6-sulfo sialyl Lewis(x),an L-selectin ligand displayed by CD34[J].Immunity,1999,11(1):79-89.
[2]Kester M H A,Bulduk S,Tibboel D,et al.Potent inhibition of estrogen sulfotransferase by hydroxylated PCB metabolites:a novel pathway explaining the estrogenic activity of PCBs[J].Endocrinology,2000,141(5):1897-1900.
[3]Ahima R S,Stanley T L,Khor V K,et al.Estrogen sulfotransferase is expressed in subcutaneous adipose tissue of obese humans in association with TNF-α and SOCS3[J].Journal of Clinical Endocrinology&Metabolism,2011,96(7):E1153-E1158.
[4]Habuchi H,Nagai N,Sugaya N,et al.Mice deficient in heparan sulfate 6-O-sulfotransferase-1 exhibit defective heparan sulfate biosynthesis,abnormal placentation,and late embryonic lethality[J].Journal of Biological Chemistry,2007,282(21):15578-15588.
[5]Hernández-Sebastià C,Varin L,Marsolais F.Sulfotransferases from plants,algae and phototrophic bacteria[J].Sulfur Metabolism in Phototrophic Organisms,2008,27,111-130.
[6]Hattori K,Hirayama M,Suzuki H,et al.Cloning and expression of a novel sulfotransferase with unique substrate specificity from Bombyx mori[J].Bioscience,biotechnology,and biochemistry,2007,71(4):1044-1051.
[7]HolleyR J,DelignyA,WeiW,etal.MucopolysaccharidosistypeI,uniquestructureof accumulated heparan sulfate and increased N-sulfotransferase activity in mice lacking α-l-iduronidase[J]. Journal of Biological Chemistry,2011,286(43):37515-37524.
[8]Wang F,Wang J,Jian H,et al.Environmental adaptation:genomic analysis of the piezotolerant and psychrotolerant deep-sea iron reducing bacterium Shewanella piezotolerans WP3[J].PLoS One,2008,3(4):e1937-e1948.
[9]Xiao X,Wang P,Zeng X,et al.Shewanella psychrophila sp.nov.and Shewanella piezotolerans sp.nov.,isolated from west Pacific deep-sea sediment[J].International journal of systematic and evolutionary microbiology,2007,57(1):60-65.
[10]Burkart M D,Izumi M,Chapman E,et al.Regeneration of PAPS for the enzymatic synthesis of sulfated oligosaccharides[J].J Org Chem,2000,65(18):5565-5574.
[11]黄小燕,孔祥峰,王德云,等.多糖硫酸化修饰和多糖硫酸酯的研究进展[J].天然产物研究与开发,2007,19(2):328-332.
[12]尹晓娟,闫俊,姬胜利,等.肝素类寡糖合成研究进展[J].有机化学,2012,32(8):1388-1400.
[13]王畅,严子琴,赵雷,等.基于修饰 Heparosan合成肝素的研究进展[J].生物技术进展,2012,2(3),177-183.
[14]石必枝,耿飞,胡萍,等.半乳糖-3-O-磺酰基转移酶-2与肿瘤转移关系的研究[J]. 生物化学与生物物理进展,2005,32(7):642-648.
[15]Bouhlal R,Haslin C,Chermann J C,et al.Antiviral activities of sulfated polysaccharides isolated from Sphaerococcus coronopifolius(Rhodophytha,Gigartinales)and Boergeseniella thuyoides(Rhodophyta,Ceramiales)[J].Marine Drugs,2011,9(7):1187-1209.
[16]朱桂兰,童群义.微生物多糖的研究进展[J].食品工业科技,2012,33(6):444-448.

