二硫代氨基甲酸吡咯烷联合卡铂对U251神经胶质瘤细胞增殖、凋亡的影响
王文新,邱建武
(辽宁医学院附属:1.研究生学院;2.第一医院神经外科,辽宁锦州121001)
核转录因子-κB(nuclear factor-kappa B,NF-κB)是一类广泛存在于细胞中的多显性核转录因子,可以调控多种基因的转录和表达,与肿瘤细胞的生长、增殖、凋亡关系密切,在肿瘤的发生、发展中起重要作用[1]。异常的NF-κB活性在人类恶性胶质瘤的局灶性坏死形成中至关重要,NF-κB活性的抑制或NF-κB调节基因被证明能促进脑肿瘤生长、发病和血管转移[2-3]。NF-κB的异 常 激 活 表 达 与 多 种 疾 病 的 发 生 有 关[4-5]。研究表明,多种抗肿瘤药物能引起NF-κB的活化[6]。吡咯烷二硫代氨基甲酸(pyrrolidine dithiocarbamate,PDTC)可抑制NF-κB的亚单位,并具有金属螯合作用,是NF-κB特异性阻断剂,可抑制其活性,具有多靶点高效的抗瘤作用。现将PDTC联合卡铂(carboplatin,CBP)对U251神经胶质瘤细胞增殖与凋亡的影响报道如下。
1 材料与方法
1.1 材料 U251神经胶质瘤细胞,达氏修正依氏培养基(Dulbecco′s modified Eagle′s medium,DMEM),磷酸盐缓冲液(phosphate buffer solution,PBS),pH 7.2~7.4,10%胎牛血清(fetal bocine serum,FBS),四甲基偶氮唑蓝(3-[4,5-dimethylthiazol-2-yl]-2,5diphenyl tetrazolium bromide,MTT),台盼 蓝染色,膜联蛋白-V 型-异硫氰酸 荧光 素 (annexin-V-fluorescein isothiocyanate,annexin V-FITC)、碘化丙啶(propidium iodide,PI)双 染 色 试 剂 盒。PDTC,CBP,二 甲 基 亚 砜 (dimethyl sulfoxide,DMSO)。
1.2 方法
1.2.1 U251神经胶质瘤细胞培养与分组 U251神经胶质瘤细胞在100U/mL青霉素、100μg/mL链霉素和含有10%灭活FBS的高糖DMEM培养基中,置于37℃含5%CO2相对湿度95%的恒温培养箱内培养细胞贴壁生长,每1天换液1次,2~3d以1∶3传代1次,用0.125%胰蛋白酶消化传代培养。将PDTC和CBP用无菌蒸馏水调整为20μg/mL,4℃冰箱避光冷藏。将传代2次后的U251神经胶质瘤细胞随机分4组,对照组加常规培养液,实验A组加PDTC(0.1mg/mL)0.01mL,实验B组加 CBP(1mg/mL)0.01mL,实验 C组加PDTC(0.1mg/mL)0.01mL和CBP(1mg/mL)0.01mL,置于37℃、5%CO2、相对湿度95%的恒温培养箱内培养。
表1 4组不同时间U251神经胶质瘤细胞生长抑制率和凋亡率比较(±s,%)

表1 4组不同时间U251神经胶质瘤细胞生长抑制率和凋亡率比较(±s,%)
*:P<0.05,与对照组比较;△:P<0.05,与实验C组比较。
组别细胞抑制率12h 24h 36h细胞凋亡率对照组 4.28±0.021△ 9.34±0.023△ 13.86±0.025△ 0.80±0.300△实验A组 10.63±0.019*△ 15.06±0.041*△ 28.34±0.032*△ 29.10±1.500*△实验B组 24.16±0.025*△ 33.71±0.053*△ 39.42±0.041*△ 38.70±3.200*△实验C组 32.15±0.016* 40.82±0.046* 45.27±0.031* 61.30±2.700*
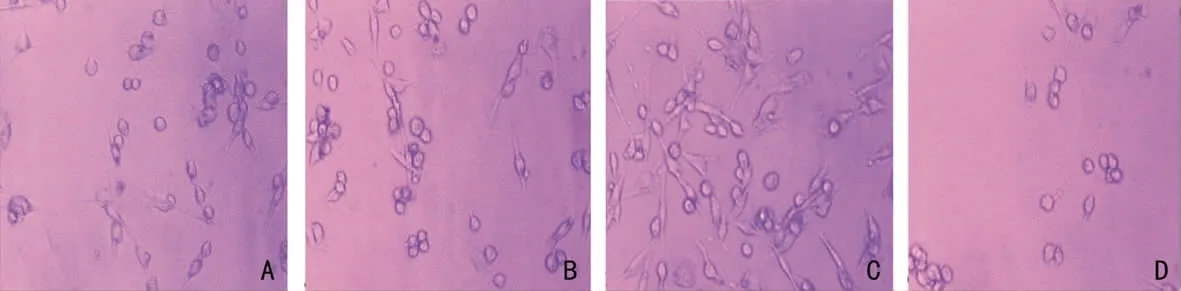
图1 显微镜下4组U251神经胶质瘤细胞形态(台盼蓝染色,×200)
1.2.2 U251神经胶质瘤细胞增殖情况观察 采用MTT法生长抑制率(CGIR),抑制率越低,表示细胞增殖越高。将各组细胞悬液浓度调整为1×104/mL,加入96孔培养板中,每孔200μL,每组设3个平行孔。调零孔放对照组细胞悬液,对照孔分别放实验A、B、C组的细胞悬液。继续分别培养12、24、36h,每孔加入20μL MTT溶液,在培养箱内孵育4h后,终止培养,小心吸尽孔内上清液,每孔加入100μL DMSO,震荡10 min,混匀后用酶联免疫检测仪检测490nm波长处各组细胞的光密度值(optical density,OD),抑制率=1-实验组OD值/对照组OD值。
1.2.3 U251神经胶质瘤细胞凋亡率测算 采用流式细胞仪检测按对照组和实验A、B、C组置孔,每组设置6个复孔,取各组细胞,将细胞收入10mL离心管中,1 500r/min离心3 min,PBS液漂洗离心1次,弃去上清液。100μL PBS液冲悬细胞,轻轻吹匀成单细胞悬液。annexin-V-FITC、PI各加入5 μL,室温避光染色30min,用流式细胞仪检测,取每组6个数值,进行统计分析,得出每组细胞的凋亡率。
1.2.4 台盼蓝染色观察 培养24h后从4个组中随机各取1瓶培养瓶,用0.125%胰酶消化贴壁细胞,制备细胞悬液,并作适当稀释。然后将购买的成品0.4%台盼蓝与细胞悬液以1∶9混合混匀(终浓度0.04%)。接着在3min内,倒置相关显微镜下观察,死细胞被染成明显的蓝色,而活细胞拒染呈无色透明状。
1.3 统计学处理 应用SPSS17.0统计软件进行处理分析,计量资料以±s表示,组间比较采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
4组U251神经胶质瘤细胞生长抑制率和凋亡率见表1。台盼蓝染色在倒置相关显微镜下细胞形态见图1。
3 讨 论
脑神经胶质瘤来源于神经上皮的肿瘤,是颅内最常见的恶性肿瘤,约占全部的颅内肿瘤的40%~50%。预后差,尤其是恶性肿瘤,平均生存期不超过1年。目前治疗方法主要以手术切除为主,但由于其具有肿瘤浸润性生长的特点,难以完全切除,术后复发率高,因此,常需要加以放疗、化疗及生物治疗等辅助治疗。NF-κB广泛存在于机体细胞中,是一类能与多基因启动子部位的κB位点特异结合并促进转录的DNA结合蛋白总称。在静止细胞中,由于IκB蛋白与 NF-κB结合,使NF-κB以无活性状态存在于胞质中。当细胞受到外界刺激时,IκB蛋白可以被IκK激酶复合体磷酸化而导致降解,从而激活NF-κB,使NF-κB自由从胞质进入细胞核,与核内的靶序列结合,调控相关基因的转录,控制细胞增殖、死亡和迁移。NF-κB作为转录因子,通过上调一些促生存基因如Bcl-x l、TRAF 1、TRAF2、SOD等或凋亡蛋白抑制物的水平或直接诱导抗凋亡基因而发挥抗凋亡作用,可阻止由肿瘤坏死因子和其他遗传毒性作用等引起的细胞凋亡[7]。有研究显示,以肿瘤坏死因子诱导NF-κB的表达使乳腺癌细胞对放化疗的抵抗力增加,姜黄素通过抑制 NF-κB而诱导凋亡[8-9]。有研究表明,在健康人脑组织细胞中仅存在无活化的NF-κB的表达,而在胶质瘤细胞中则可以检测到活化的 NF-κB蛋白[1]。Xiong等[10]研究发现,抑制前列腺癌细胞中NF-κB的活性,可下调血管生成因子VEGF和IL-8,减少肿瘤血管形成,从而限制肿瘤的生长和转移。最近,Lavon等[11]报道,在人脑胶质瘤细胞株中,NF-κB可以诱导O6-甲基鸟嘌呤-DNA甲基转移酶蛋白的表达,导致细胞株对烷化剂耐药。NF-κB在肿瘤细胞中有明确的抗凋亡作用,抑制NF-κB的表达可以增加肿瘤坏死因子引起的细胞凋亡及增加肿瘤细胞对放疗、化疗的敏感性[12-13]。人们已逐渐认识到NF-κB在肿瘤中所起的作用,NF-κB的抑制剂可成为恶性肿瘤治疗潜在的靶点。亚硝脲类药物是治疗脑肿瘤的常用药,CBP为第2代铂类化合物,与顺铂同属细胞周期非特异性药物。由于抗肿瘤活性较强,消化道反应及肾毒性较低,因而是临床治疗各种实体肿瘤的常用药。其主要作用DNA的鸟嘌呤的N7和O6原子上,引起DNA链间和链内交联,破坏DNA分子,阻止其螺旋解链,干扰DNA合成,而产生细胞毒作用[14-15]。所以本实验选用NF-κB抑制剂PDTC联合卡铂作用U251神经胶质瘤细胞。实验结果表明,PDTC联合卡铂治疗组较单一组治疗细胞抑制作用增强,细胞凋亡率增高。这表明NF-κB抑制剂PDTC可以提高肿瘤细胞对卡铂的敏感性,二者具有协同作用。其可能机制是NF-κB表达被特异性抑制后,NF-κB处于失活状态,无法从胞质自由进入细胞核,与细胞核内的靶序列结合,就不能调控相关基因的转录、控制细胞增殖、死亡、迁移。并且NF-κB抑制剂PDTC还能抑制MGMT蛋白的表达,降低细胞株对化疗药物的耐药性。
因此,NF-κB抑制剂PDTC联合卡铂可以抑制U251神经胶质瘤细胞的增殖并诱导其凋亡。联合NF-κB抑制剂PDTC可以提高卡铂对神经胶质瘤细胞的化疗效果,抑制NF-κB活化为神经胶质瘤化疗提供靶向,以期延长患者生命。
[1] 唐万忠,夏玉军,孟庆海,等.NF-κB与脑胶质瘤的研究进展[J].中国临床神经外科杂志,2004,9(1):79-81.
[2] Xie TX,Aldape KD,Gong W,et al.Aberrant NF-κB activity is critical in focal necrosis formation of human glioblastoma by regulation of the expression of tissue factor[J].Int J Oncol,2008,33(1):5-15.
[3] Atkinson GP,Nozell SE,Benveniste ET.NF-κB and STAT 3 signaling in glioma:targets for future therapies[J].Expert Rev Neurother,2010,10(4):575-586.
[4] Wang H,Zhang W.Analysis of the activation status of Akt,NF-κB and Stat3in human difuse gliomas[J].Lab Invest,2004,84(8):941-951.
[5] 刘玲.核转录因子的活化在脑缺氧缺血神经细胞凋亡中的调控作用及研究进展[J].实用儿科临床杂志,2003,18(6):474-476.
[6] Li Y,Ahmed F,Ali S,et al.Inactivation of nuclear factor kappa B by soy isoflavone genistein contributes to increased apoptosis induced by chemotherapeutic agents in human cancer cells[J].Cancer Res,2005,65(15):6934-6942.
[7] Karin M,Cao Y,Greten FR,et al.NF-κB in cancer from innocent bystander to major culprit[J].Nat ReV Cancer,2002,2(4):301-310.
[8] Braunstein S,Formenti SC,Schneider RJ.Acquisition of stable inducible up-regulation of nuclear factor-kappaB by tumor necrosis factor exposure confers increased radiation resistance without increased transformation in breast cancer cells[J].Mol Cancer Res,2008,6(1):78-88.
[9] Freudlsperger C,Greten J,Schumacher U.Curcumin induces apoptosis in hunman neuroblastoma cells via inhibition of NF-kappaB[J].Anticancer Res,2008,28(1A):209-214.
[10]Xiong HQ,Abbruzzese JL,Lin E.NF-κB activity blckade impairs the angiogenic potential of human pancreatic cancer cells[J].Int J Cancer,2004,108(2):181-188.
[11]Lavon I,Fuchs D,Zrihan D,et al.Novel mechanism whereby nuclear factor kappaB mediates DNA damage repair through regulation of O (6)-methylguanine-DNA-methyltransferase[J].Cancer Res,2007,67(18):8952-8959.
[12]Hanefner B.NF-κB:arresting a major culprit in cancer[J].Drug Discov Today,2002,7(12):653-663.
[13]Duan L,Aoyagi M,Tamaki M,et al.Impairment of both apoptotic and cytoprotective signalings glioma cells resistant to the combine use of cisplatin and tumor necrosis factor alpha[J].Clin Cancer Res,2004,10(1Pt 1):234-243.
[14]Chang JK,Li CJ,Liao HJ,et al.Anti inflammatory drugs suppress proliferation and induce apoptosis through altering expressions of cell cycle regulators and pro-apoptotic factors in cultured human osteoblasts[J].Toxicology,2009,25(8):148-156.
[15]Carter DL,Asmar L,Barreea D,et al.Favorable survival observed after carboplatin,paclitaxel,and concurrent accelerated hyperfractionated radiotherapy for treatment of locally advanced head and neck carcinoma[J].Invest New drugs,2008,26(5):473-481.

