固体胶原蛋白加热变性过程中的太赫兹介电谱研究
李向军, 付秀华, 刘建军, 杜 勇, 洪 治
1.中国计量学院太赫兹技术与应用研究所,杭州 310018;
2.中国计量学院信息工程学院,杭州 310018
引 言
胶原蛋白是一种白色、不透明、无支链的纤维性蛋白质,由三个多肽超螺旋结构组成,平均分子量为0.36 MD,是重要的细胞外间质成分,广泛存在于人体的皮肤、骨骼、肌肉、软骨、关节等组织中,起支撑、修复、保护三重作用,生理功能极其重要。因此,胶原蛋白成为临床应用较为广泛的蛋白质类药物。然而,同大多数蛋白类药物一样,胶原蛋白在生产、运输和储藏过程中,多以固体形式存在,易受环境温度的影响而发生变性。这是由于胶原蛋白的稳定性有赖于分子间和分子内各种作用的协同效应,加热可使分子间作用力减弱,破坏三股螺旋的稳定性,从而使其丧失生物功能[1]。
目前,用于蛋白质结构研究的有示差扫描量热法(differential scanning calorimetry,DSC)[2]、核磁共振 (nuclear magnetic resonance,NMR)[3]、X射线衍射[4]、微波介电谱[5]和各类光谱法。介电谱和光谱法具有快速、无损的特点,因而更具应用潜力。目前已应用到蛋白质药物检测的光谱法包括紫外吸收谱、可见光吸收谱、圆二色谱 (circular dichroism,CD)、荧光光谱、傅里叶变换红外光谱 (Fourier transform infrared spectroscopy,FTIR)和拉曼光谱等。其中,大部分技术都不能提供分子的整体构象和分子间相互作用的信息,而这些却是对蛋白质功能起决定性作用的[6]。
人们发现,反映DNA、RNA和蛋白质等生物大分子构象的分子集体振动转动能级位于THz波段,虽然我们可以用FTIR、自由电子激光、可调谐p-Ge激光和 (terahertz time domain spectroscopy,THz-TDS)等多种技术得到物质的宽带THz谱,但THz-TDS技术的出现才真正改变了THz谱研究的面貌。THz-TDS系统可以在常温下工作,系统体积小,并可方便地用激励源激发样品,且光路灵活,可随时监测;尤其是可以同时测量太赫兹波电场的幅度和相位,可以直接得到样品的吸收系数和折射率,或复介电常数,比单一的吸收谱可提供更多的样品信息。这有利于对分子的振动/转动模式进行极化响应建模,利用各种动力学理论在THz波段研究蛋白质热变性问题[5]。THz-TDS除了可以对物质的复介电响应表征外,还可以进行具有时间分辨率的测量,即对分子构象改变而引起的振动/转动模式演化进行实时测量。
研究者已经利用THz-TDS技术对蛋白质展开了一系列研究。Markelz等[7]首次利用THz-TDS研究了DNA、牛血清蛋白和胶原质在0.06~2.00 THz波段的性质,发现这些生物分子的THz谱可以很好地反映它们的低频集体振动模式。他们对集体振动模式的驰豫极化进行研究后发现,生物大分子在THz波段的介电响应谱带范围较宽且特征吸收并不明显,但该响应却对水合作用、温度、绑定、构造改变等高度敏感[6]。He等[8]通过THz-TDS技术研究天然状态和变性的鸡蛋清溶菌酶的动态跃迁,发现蛋白质结构不是产生动态跃迁的必要因素,而与温度相关。Havenith等[9]利用THz-TDS研究了蛋白质折叠过程中的THz电场衰减和相转移,并与荧光法、圆二色谱、小角度X射线散射的数据进行对比,发现THz谱可检测折叠早期和二级结构形成时结合水-蛋白质相互作用的重排现象,证明了蛋白质二级结构的形成与溶剂动力学相关。Chen等[10]利用THz-TDS观察到了PsbO蛋白的可逆性构象变化。以上研究都证明了利用THz-TDS谱技术研究蛋白质结构及构象变化的巨大潜力。上述THz-TDS对蛋白质的动力学研究多在溶液中或水合状态下进行,用其研究固体蛋白质的温度稳定性还未见诸文献报道。
本文利用太赫兹时域光谱技术对胶原蛋白从25℃至120℃的加热变性过程进行了THz光谱测量,发现加热后的吸收和折射谱均逐渐减小,与DSC测量结果对比,确认蛋白质分子结构发生了解折叠的热变性过程。然后,把吸收率和折射率转化为介电谱,并利用一阶Debye模型拟合加热过程中胶原蛋白的介电谱,获得了相应的弛豫时间,发现这些弛豫时间随温度变化而逐渐变大,与加热过程中分子内部构象解折叠变性过程中的偶极矩变化对应,并可以用Arrihenius方程拟合,得到的活化能为5.53 kJ/K·mol。同时,利用介电弛豫理论对其变化进行了分析,为进一步利用THz-TDS技术研究固态蛋白质及多肽类药物的温度稳定性进行了有益的探索。
材料和方法
实验材料及装置
胶原蛋白为购自Sigma公司的牛肌腱胶原蛋白I型,纯度大于95%以上,样品为絮状晶体粉末,实验前未经进一步纯化处理。实验前,在4 MPa压力下将胶原蛋白制备成直径为13 mm、厚度约为1.5 mm左右的结构均匀且两端面平行的测试样品。然后,分别在变温装置中测量样品在25、50、75和120℃下的THz时域谱。加热完成后,在返回25℃时,再测量一次样品的THz时域谱。
THz-TDS实验装置是购自美国Zomega公司的Z-2太赫兹时域光谱系统[12],该系统信噪比可达70 dB,整个测量环境为干燥的氮气环境,相对湿度为0%。
示差扫描量热仪为瑞士梅特勒-托利多公司产品,型号为Metttler SMP/PF7548/MET/600 W,升温速率设置为10℃/min,试样测量时的气氛为空气,铝坩埚作为参考。
数据处理及理论方法
样品THz光学参数的提取采用Duvillaret等人[13]提出的方法,参考信号和样品信号分别是通过测量氮气和样品的五次平均所得的THz时域信号。将时域信号进行快速傅里叶变换得到参考和样品的THz频域信号,分别记为Eref(ω)和Esam(ω),两者相除可以得到传递函数H(ω):
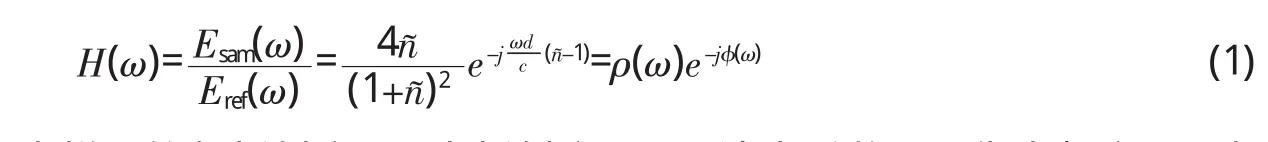
其中,ñ=n-ik,代表样品的复折射率,n为折射率,k是消光系数;ω代表频率;d表示样品厚度;ρ(ω)为H(ω)的振幅;φ(ω)为H(ω)的相位。经过数学推导可以得到样品的折射率 n(ω)、消光系数 k(ω)、吸收系数 α(ω)和复介电谱ε~(ω)等光学参数。
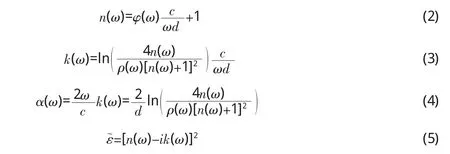
介电谱描述物质或体系的介电常数随电场频率的变化,本质上是物质与电磁波相互作用的结果,从近红外到紫外的大约1011~1016Hz频率段,反映了电磁场与原子的外层电子、晶体中的原子或离子相互作用的位移极化及分子偶极极化响应。其中,THz介电谱对分子转动和分子间相互作用非常敏感,可以从介电弛豫过程中了解分子运动的特征时间,获得与分子结构与运动相关的大量信息[6]。
弛豫是指系统在外力场的作用下 (如力场,电场、磁场和化学势场),从一个平衡态过渡到另一个平衡态时经历的过程,其描述特征参量为弛豫时间,若该过程必须克服高度为△E的能垒,Kauzmann等人[14]指出该弛豫响应对应一个激活反应,相应的分子结构变化和键的破坏与重排导致偶极子运动变化,则弛豫时间可以描述为:

其中,kb是玻尔兹曼常数,T为绝对温度,τ0称为指前因子,△E一般也被称为激活能或活化能等,符合Arrhenius方程描述的规律。Markelz等[15]研究发现,可以用单一弛豫时间Debye模型来表征固态蛋白质分子在温度变化过程中,由于分子结构改变导致的介电弛豫响应过程,其表达式为:
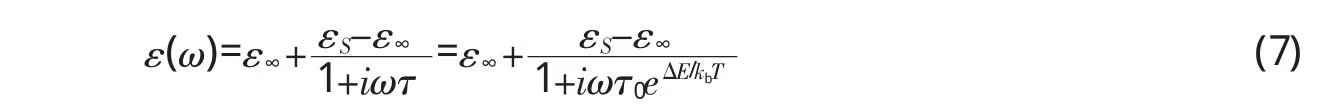
本文认为,介电弛豫时间可以反应分子构象随温度发生的变化。蛋白质分子通过加热从天然态到变性状态过程中分子的解折叠过程,可用弛豫时间加以定量刻画。而活化能则反映该加热变性过程的难易程度,可以作为蛋白质药物稳定性的一个定量指标。
结果与讨论
胶原蛋白的THz光谱
分别在变温装置中测量25、50、75和120℃下固体胶原蛋白样品THz的时域谱,经过傅里叶变换得到频域谱,利用公式(2)~(4)得到样品的THz吸收系数和折射率,如图1所示。
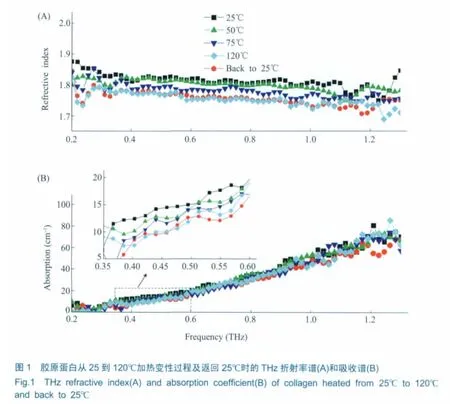
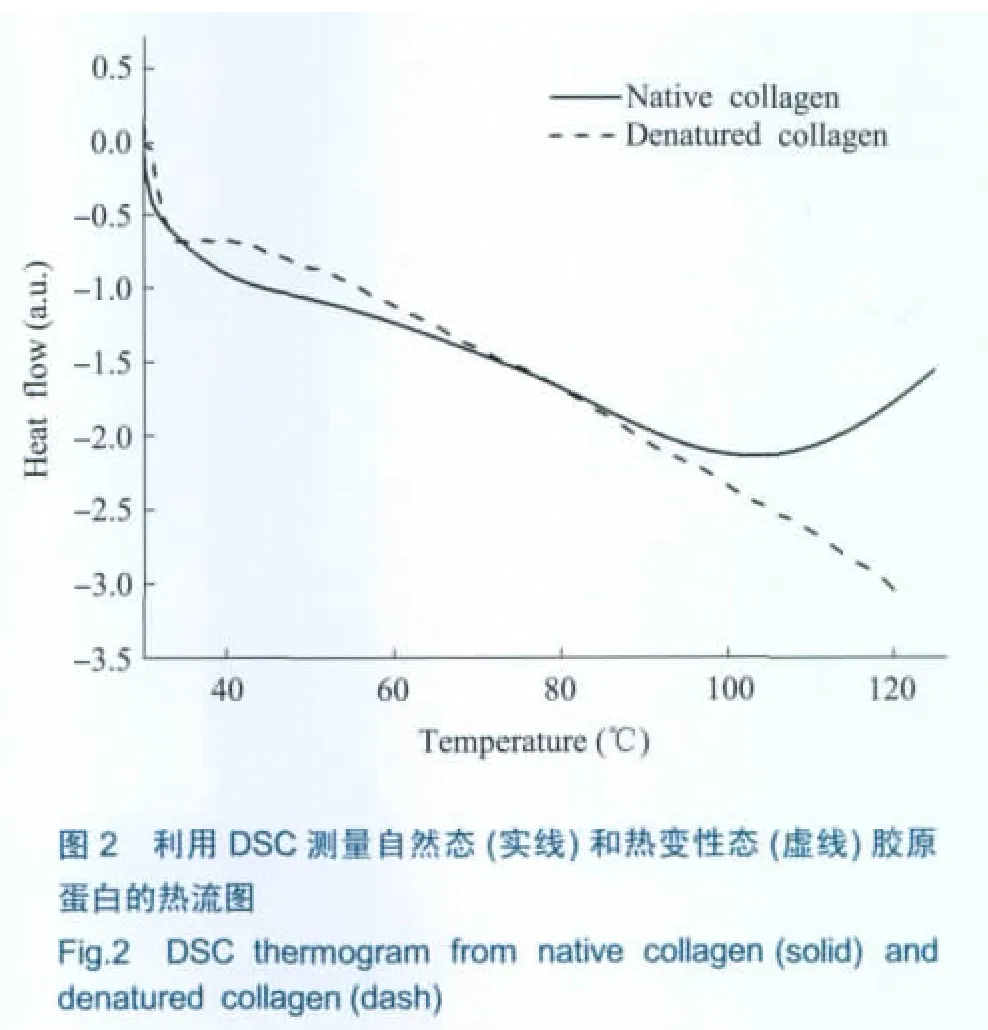
从图1中可以看出,胶原蛋白的吸收曲线比较平滑,呈现一种类似玻璃态的响应,是谐振和弛豫过程的一种积分效果[6]。胶原蛋白加热过程中的吸收谱和折射谱整体上呈减小趋势,可能有两方面的原因,一方面,经过冻干处理的胶原蛋白仍含有少量维持蛋白质结构的结晶水和水合水,加热将会使蛋白质分子内部的结晶水和表面的水合水的水分子减少,而水分子在THz波段的吸收率和折射率都比较大;另一方面,胶原蛋白分子中含有的螺旋结构在加热激活的过程中具有伸展和解折叠的趋势。加热变性过程在吸收谱中的变化不十分明显,但在折射率谱中则非常清晰,这体现了THz-TDS的优势。已知在加热到一定温度后,胶原蛋白还将发生不可逆的热变性过程,即使温度重新降到室温时,胶原蛋白分子也不能恢复到变性前的各级构象结构。可以从图1中看到,加热后返回25℃时测量的吸收系数和折射率与开始25℃时的值相差较大,而与120℃时测量的比较接近,说明了加热变性的不可逆性。为了证实本文胶原蛋白样品加热到120℃时已经发生了不可逆的热变性过程,我们用DSC法测量了相同样品,得到胶原蛋白在加热过程中的热流变化轨迹 (如图2所示)。可以看到,本实验样品在100℃左右发生了热变性。
为了定量分析这种加热过程对胶原蛋白分子THz波段介电响应的改变,分别用公式(5)和公式(7)计算拟合了胶原蛋白THz介电谱的虚部和实部,见图3(A)~(D)。从图3介电谱中可以更加清晰地看到,胶原蛋白分子在脱水过程和解折叠期间发生了显著的偶极矩变化,对应的弛豫时间相应变化。这也是多数吸收谱光谱无法提供的重要信息。
图3(C)和(D)拟合的结果说明,可以用一阶Debye模型来表征固态蛋白质分子在加热过程中由于分子结构改变而导致的介电弛豫响应过程,与文献[15]的结论一致。同时,表1给出了加热过程中样品在25、50、75和120℃及返回25℃时,拟合得到的单一弛豫时间τ的一阶Debye模型的各个参数。从表1中可以看出,胶原蛋白分子的弛豫时间随着温度的升高而逐渐变大,说明固体蛋白质的热变性是构象渐变过程,即变性过程中维系胶原蛋白空间结构的次级键被破坏,原有的空间结构改变,整个分子的形状具有从天然紧密的球形结构伸展为松散的无特定空间结构的链状分子的趋势;另外,返回25℃时测量的弛豫时间与开始25℃时的值相差较大,而与120℃时测量的比较接近,不难推测,胶原蛋白在加热变性后,不但失去了水合水分子,而且空间构象复杂度降低,胶原蛋白分子中含有的三个多肽超螺旋结构在加热激活过程中具有伸展的趋势,这使其THz介电响应的偶极矩改变,相应的弛豫时间变长,且该变性过程不可逆,变性后的空间结构在返回室温时基本保持不变。该现象可以用蛋白质变性的渐变模型做较好的解释[16],即固体蛋白质的热变性过程是从天然态逐渐过渡到变性态的渐变过程,除自然态和变性态之外,还存在若干过渡态。
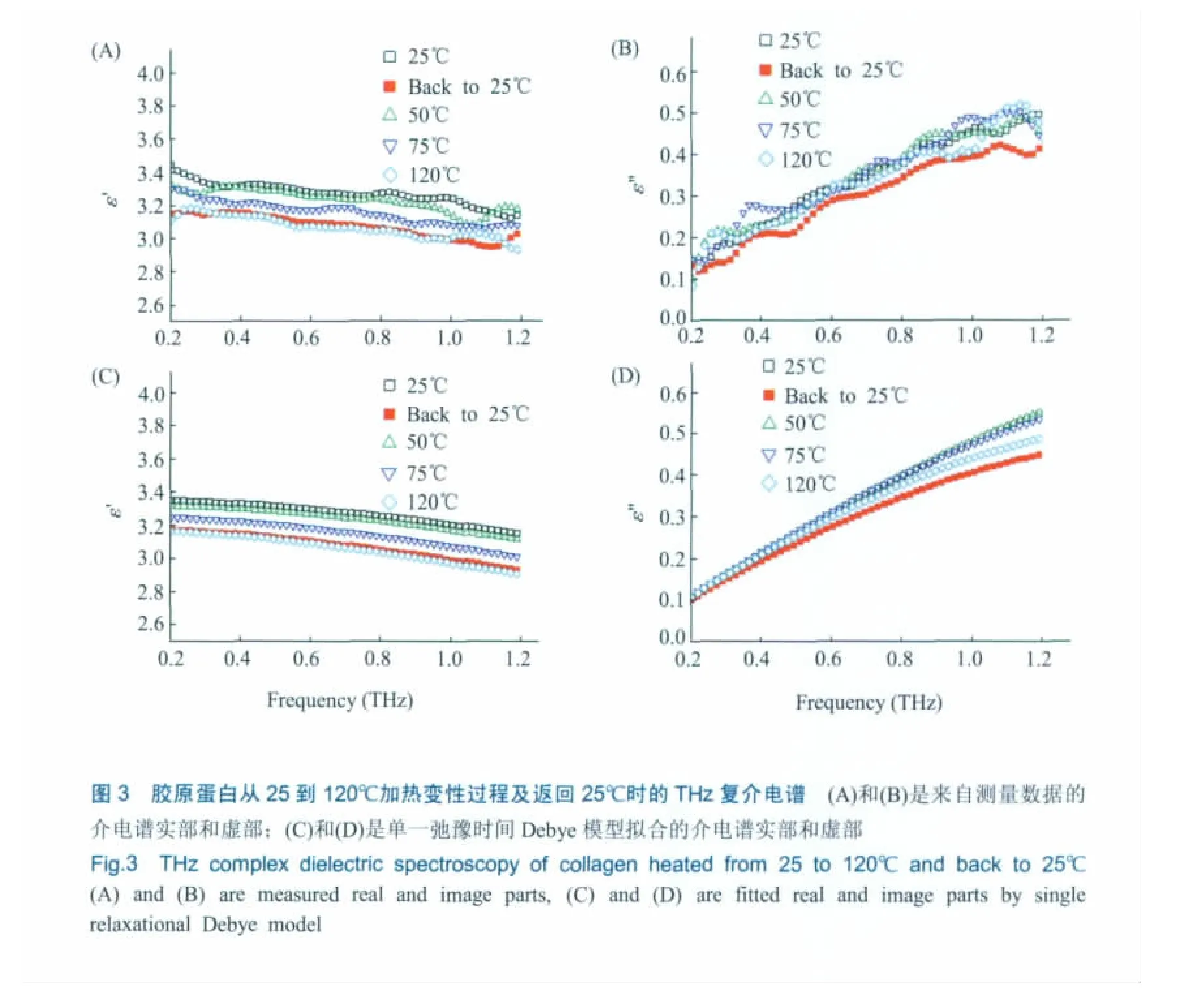
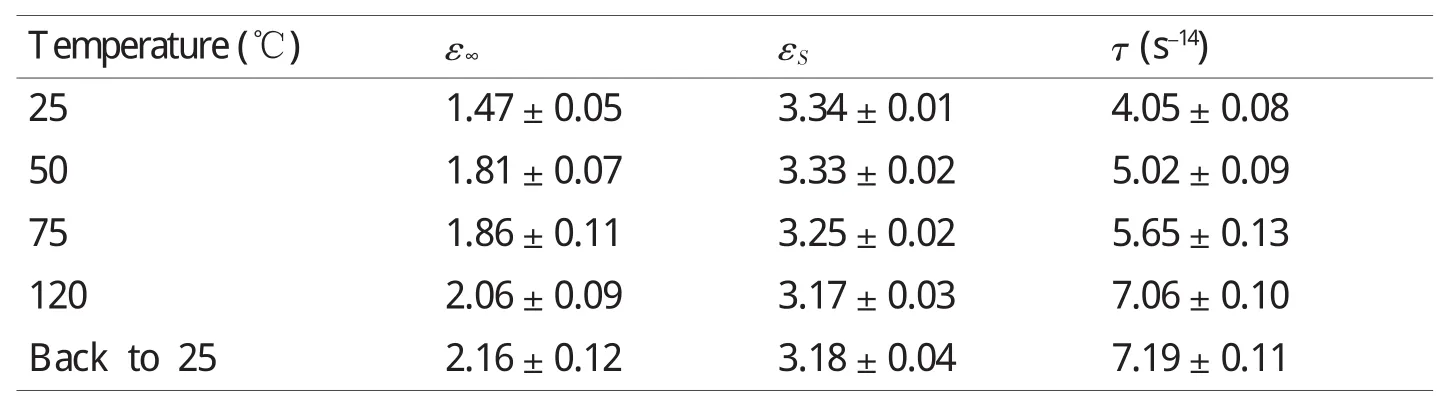
表1 拟合得到的胶原蛋白加热过程中及返回25℃时的弛豫时间Table 1 Fitted relaxation time for collagen during heating and back to 25℃
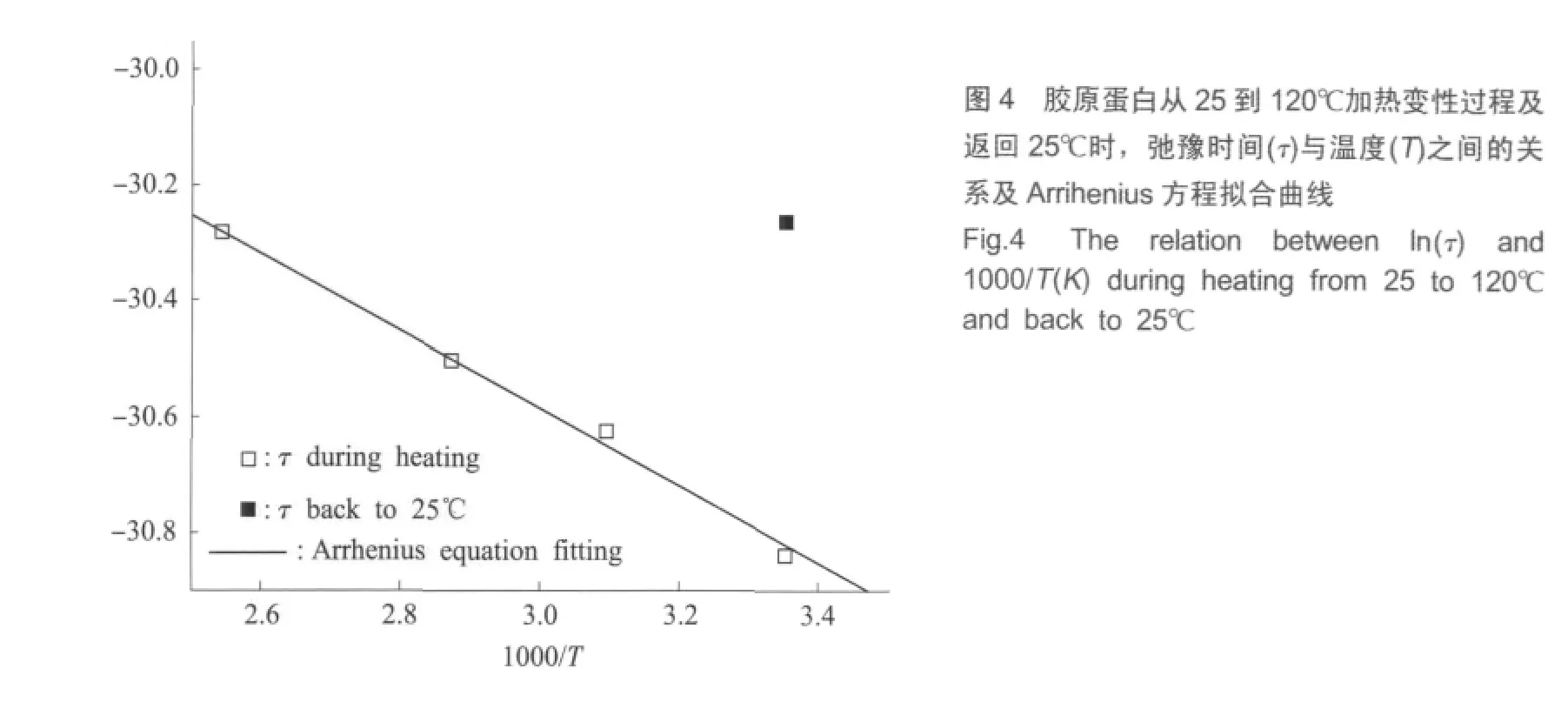
为了进一步定量分析这种由加热引起的胶原蛋白变性过程,本文发现可以利用公式(6)给出Arrhenius方程拟合加热过程中的弛豫时间τ(如图4所示),计算得到变性过程的活化能为5.53 kJ/K·mol,可以定量刻画加热变性过程的难易程度。这也印证了玻璃态动力学理论可以用于蛋白质热变性的研究,说明蛋白质是一种韧性玻璃态物质[17]。无定形固体分为韧性玻璃态和脆性玻璃态物质两大类,其中,韧性玻璃态物质的许多动力学性质满足Arrhenius方程。固体蛋白质作为玻璃态物质,其分子主骨架无法大幅移动,而侧链则可以摆动或转动,形成不同构象。
结论及展望
本文利用太赫兹时域光谱技术,对胶原蛋白从25℃至120℃的加热变性过程进行了THz光谱测量,发现加热前后的吸收和折射谱有明显变化。主要原因是加热将会使蛋白质原有表面的水分子减少,且高温加热使得分子空间构象发生改变,结果吸收减小,折射率变小。变性后胶原蛋白分子的结构发生了不可逆的根本变化。同时,利用一阶Debye模型拟合了加热过程中胶原蛋白的介电谱,获得了相应的弛豫时间,发现胶原蛋白分子的脱水过程和折叠结构改变期间发生了显著的偶极矩变化,弛豫时间随着温度的升高而逐渐变大,说明胶原蛋白的加热变性是构象渐变过程。弛豫时间随温度的变化满足Arrihenius方程,拟合得到的活化能为5.53 kJ/K·mol,该数值表征了胶原蛋白加热变性过程的难易程度,给出了其在固态下热稳定性的定量评价标准。同时,实验印证了固态蛋白质可以被看做一种韧性玻璃态物质,在分子主骨架不能移动的情况下,其侧链在不同构象间转换的时间为皮秒量级。
我们下一步的工作将结合分子模拟计算工具,全面揭示胶原蛋白加热变性的物理机理,特别是其非谐振弛豫响应无法被常用分子模拟软件中的正规谐振模式所包含的、来自蛋白分子的肽链在THz电磁场作用下的偶极子弛豫过程[15],因为这些非谐振响应必须通过计算整个体系中所有分子的运动轨迹才能全面揭示。
1. Wright NT,Humphrey JD.Denaturation of collagen via heating:An irreversible rate process.Annu Rev Biomed Eng,2002,4:109~128
2.Xia ZY,Calderon-Colon X,Trexler M,Elisseeff J,Guo QY.Thermal denaturation of type I collagen vitrified gels.Thermochim Acta,2012,527(10):172~179
3. Yoshioka S,Aso Y,Kojima S,Sakurai S,Fujiwara T,Akutsu H. Molecular mobility of protein in lyophilized formulations linked to the molecular mobility of polymer excipients,as determined by high resolution 13C solid-state NMR.Pharmaceut Res,1999,16(10):1621~1625
4. Frauenfelder H,Petsko GA,Tsernoglou D.Temperaturedependent X-ray diffraction as a probe of protein structural dynamics.Nature,1979,280(5723):558~563
5. Shinyashiki N,Yamamoto W,Yokoyama A,Yoshinari T,Yagihara S, Kita R, Ngai KL, Capaccioli S. Glass transitions in aqueous solutions of protein(bovine serum albumin).J Phys Chem B,2009,113(43):14448~14456
6. Markelz AG.Terahertz dielectric sensitivity to biomolecular structure and function.IEEE J Sel Top Quantum Electron,2008,14(1):180~190
7. Markelz AG,Roitberg A,Heilweil EJ.Pulsed terahertz spectroscopy of DNA,bovine serum albumin and collagen between 0.1 and 2.0 THz.Chem Phys Lett,2000,320(1):42~48
8.He YF,Ku PI,Knab JR,Chen JY,Markelz AG.Protein dynamical transition does not require protein structure.Phys Rev Lett,2008,101(17):178103
9.Leitner DM,Gruebele M,Havenith M.Solvation dynamics of biomolecules:Modeling and terahertz experiments.HFSP J,2008,2(6):314~323
10. Chen H, Chen GY, Li SQ, Wang L. Reversible conformational changes of PsbO protein detected by terahertz Time-domain spectroscopy.Chin Phys Lett,2009,26(8),084204.DOI:10.1088/0256-307X/26/8/084204
11.Kambara O, Tamura A, Uchino T, Yamamoto K,Tominagal K. Terahertz time-domain spectroscopy of poly-L-lysine.Biopolymers,2010,93(8):735~739
12.Li XJ,Hong Z,He JL,Chen YQ.Precisely optical material parameter determination by time domain waveform rebuilding with THz time-domain spectroscopy. Opt Commun,2010,283(23):4701~4706
13.Duvillaret L,Garet F,Coutaz JL.A reliable method for extraction of material parameters in terahertz time-domain spectroscopy.IEEE J Sel Top Quantum Electron,1996,2(3):7739~7746
14.Kauzman NW.Dielectric relaxation as a chemical rate process.Rev Mod Phys,1942,14(1):12~44
15.Lipps F,Levy S,Markelz AG.Hydration and temperature interdependence of protein picosecond dynamics. Phys Chem Chem Phys,2012,14(18):6375~6381
16.萨楚尔夫,罗辽复.蛋白质变性的渐变模型.内蒙古师范大学学报(自然科学汉文版),2002,31(1):26~30 Sachurfu, Luo LF. A sequential model on protein denaturation.J Inn Mong Norm Univ(Nat Sci Ed),2002,31(1):26~30
17.Chang L,Pikal MJ.Mechanisms of protein stabilization in the solid state.J Pharmaceut Sci,2009,98(9):2886~2908