线粒体钙离子转运的研究进展
陆久维, 翟宇佳, 孙 飞
中国科学院生物物理研究所,生物大分子国家重点实验室,北京100101
引 言
早在130年前,Ringer[1]就发现钙离子在心肌细胞收缩中具有重要作用,由此开启了研究钙信号的时代。事实上,细胞内钙信号的形成和传导都是受到高度调节的,存在“开”和“关”两种机制以精确调控钙离子的时空分布[2]。
线粒体作为细胞内的能量工厂,其提供的能量约占细胞生命活动所需能量的95%[3]。此外,线粒体还参与细胞凋亡、细胞周期调控及细胞发育调节等生理活动[4]。研究发现,无论是分离的还是体内的线粒体都可以自发吸收和释放钙离子。那么,钙离子是否在线粒体发挥生理功能中起到重要作用呢?事实上,人们对于这个问题的认识经历了近半个世纪的发展历程[5]。研究表明,钙离子不但能被线粒体吸收和释放,而且线粒体的钙吸收和释放在维持胞浆钙稳态中起到十分重要的作用[6];线粒体内自由钙离子的浓度与其能量代谢水平和膜的通透性改变密切相关[7~9];线粒体的钙吸收和释放过程也会对细胞内的钙信号进行修饰[10];该过程的异常与心脏病、癫痫和神经退行性疾病等的发生关系密切[11~13]。
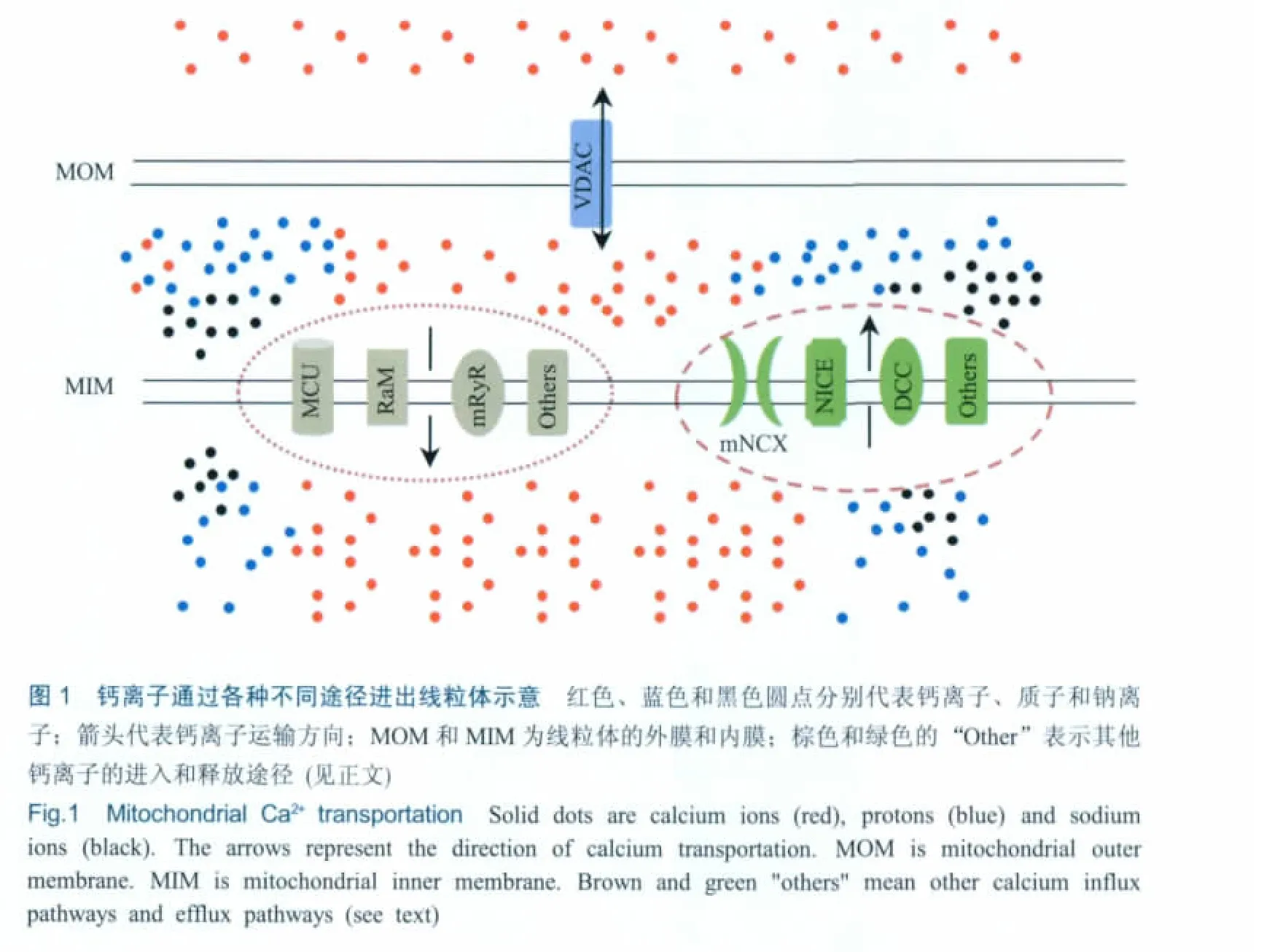
线粒体是具有双层膜的钙存储细胞器,钙离子分布在其膜间隙和线粒体基质中。由于线粒体外膜的钙离子高通透性,膜间隙内的钙离子浓度与胞浆内的钙浓度相当。在静息状态下,线粒体基质内的钙离子浓度 (~100 nmol/L)与胞浆内相当[14]。当细胞处于兴奋时,胞浆内的钙浓度可以达到2~3μmol/L,而此时,线粒体基质内的钙浓度可以上升至10μmol/L,甚至更高 (500μmol/L)[15,16]。那么,线粒体上存在哪些途径来转运钙离子呢?
本文将结合最新研究进展,就线粒体外膜钙离子转运——线粒体外膜电压依赖的阴离子选择性通道 (voltage dependent anion-selective channel,VDAC),线粒体内膜钙离子吸收——依赖单向吸收体的钙离子吸收(mitochondrial calcium uniporter,MCU)、快速钙离子吸收 (rapid mitochondrial calcium uptake,RaM)和依赖线粒体雷诺丁受体 (mitochondrial ryanodine receptor,mRyR)的钙离子吸收,以及线粒体内膜钙离子释放——钠离子依赖(mitochondrial Na+-dependent calcium efflux,mNCX)和钠离子非依赖的钙离子释放(Na+-independent calcium efflux,NICE)等钙离子转运方式进行综述 (图1)。
钙离子穿梭线粒体外膜
线粒体外膜上的电压依赖性阴离子通道 (VDAC)是受线粒体外膜电势调控的一类选择性通道。目前发现人源线粒体中构成通道的蛋白存在VDAC1~3三种形式[17],它们有着组织表达差异性[18],且能够与不同的调节蛋白相互作用而行使功能[19~21];VDAC是许多阴离子、阳离子和线粒体代谢底物的转运通道,这其中也包括钙离子[22~24]。那么,VDAC是怎样运输钙离子的呢?脂质体实验表明,开放状态的VDAC直径大小在3~4 nm之间,能够允许小于5 kDa的分子自由通过[25];鼠VDAC1-Ca2+晶体结构及叠氮化钌 (AzRu)结合显示VDAC1中的两个谷氨酸即为钙离子结合位点[26,27];Rapizzi等[28]在HeLa细胞和骨骼肌细胞中过表达VDAC1时发现,在激动剂诱导内质网钙离子释放的同时,线粒体内钙离子浓度升高的幅度高于对照组;反之,敲除VDAC1则线粒体内的钙离子浓度会降低。结合上述现象,Rizzuto等[29]认为钙离子可以自由穿梭VDAC,VDAC的拷贝数决定线粒体外膜转运钙离子的能力。然而,Bathori等[30]发现VDAC的开和关与钙离子浓度密切相关。因此,相信VDAC转运钙离子不仅依赖于VDAC的拷贝数,还存在调节孔道开关的其他途径。
钙离子由膜间隙进入线粒体基质
钙离子由膜间隙进入线粒体基质主要有三种方式,分别为依赖线粒体钙离子单向吸收体 (MCU)的单向钙吸收、快速线粒体钙吸收 (RaM),以及依赖线粒体雷诺丁受体 (mRyR)的钙吸收。此外,研究还提示存在其他的钙离子进入途径[31],线粒体内膜上负责钙离子释放的交换体在病理状态下也可将钙离子吸收至线粒体内[32]。
依赖MCU的单向吸收
在依赖MCU的单向吸收过程中,钙离子是单一的被吸收而不伴随其他离子的跨膜转运[33];无论是氧化磷酸化、ATP水解还是钾离子载体——缬氨酶素(valinomycin)建立的内膜跨膜电势都可以激活此吸收过程[34~36];单向吸收动力学方程具有电化学扩散过程特征[36,37]。因此,钙离子依赖MCU进入基质的过程是一个依赖于线粒体内膜电势、不需要额外能量、顺钙离子电化学梯度扩散的过程。此外,据报道MCU只倾向于介导钙离子的吸收而不介导钙离子的释放,因此,研究者将MCU称为单向吸收体[38]。
单向吸收过程的抑制剂、激动剂及动力学特征
依赖MCU单向吸收的过程除了转运钙离子外,其活性还受胞浆钙离子浓度的调节,特别是当胞浆钙离子浓度持续上升时,其活性会受到抑制[39,40]。此外,其它离子、化合物及药物类分子也可抑制此吸收过程,主要有:1)可以被单向吸收方式所转运的竞争型抑制剂,如锶离子 (Sr2+)、锰离子 (Mn2+)、钡离子 (Ba2+)、亚铁离子 (Fe2+)及镧系元素离子(La3+、Gd3+和 Pr3+等),MCU对它们的选择为 Ca2+>Sr2+≫Mn2+>Ba2+>Fe2+>La2+[38,41~43]。2)不能被单向吸收方式所转运的抑制剂,包括:①镁离子、氢离子和聚氨类,它们可能通过结合或屏蔽转运位点而抑制钙离子的转运[36];②钌红、钌360和六胺合钴等强效型抑制剂,它们可结合MCU的钙离子结合位点,从而起抑制作用。相比竞争型抑制剂,这些强效型抑制剂具有长效性且抑制常数Ki通常在10 nmol/L以下[38];目前,钌360是抑制效应最强、最为常用的抑制剂,突变人源MCU的259位丝氨酸可消除其抑制作用[44]。3)药物类抑制剂,包括Beta类抑制物[45]、胍类[46]和利尿类[47]等。
无机磷酸可以增加MCU吸收钙离子的速率,但其中的机理目前还未知[48]。在线粒体外低钙离子浓度条件下,包括精胺和亚精胺在内的多胺类化合物可以激活MCU的吸收过程[49],但所需浓度具有细胞依赖性[50]。此外,由于单向吸收过程对钙离子具有协同性,因此,上述竞争性抑制剂在低浓度时也可起激活作用。值得注意的是,精胺在线粒体外高钙离子浓度时反而对MCU具有抑制作用[51,52]。
单向吸收过程的动力学方程为 V={[V max[Ca2+]H]/[K0.5H+[Ca2+]H]}×{(ΔФ/2)(eΔФ/2)/[sin h(ΔФ/2)]}。其中,V max为最大转移速率,ΔФ与内膜跨膜电势相关,K0.5为解离常数,H为希尔系数[53]。研究发现,不同组织来源的、依赖MCU吸收钙离子过程的V max存在差异性,有报道指出肝脏线粒体的Vmax要高于心脏线粒体[36]。早期研究发现分离线粒体的K0.5要大于10μmol/L[54~56],因此,人们最初怀疑细胞内的线粒体是否真的会通过此吸收模式来大量吸收钙离子。Rizzuto等[57]对细胞内钙离子浓度的研究改变了人们对于细胞内钙离子分布的认识。研究表明,细胞内的部分线粒体会趋向定位于钙微区的部位,这些区域的钙离子浓度在兴奋时可达到50μmol/L,甚至更高。因此,目前大家普遍接受细胞内的线粒体可以通过MCU来吸收钙离子的事实。根据分离线粒体的钙离子吸收动力学方程,人们推算出H为2;结合其他实验,Gunter等[36]推测MCU存在一个钙离子激活位点和一个转运位点。然而,最近的研究显示,细胞内线粒体的单向吸收过程似乎对钙离子具有更高的协同性——H约为3.2[58]。
MCU的分子机制
自单向吸收过程被发现以来,人们一直力图找出它的分子本质。1972年,Sottocasa等[59]分离出一种被镧和钌红抑制的糖蛋白。1993年,Saris等[60]从鼠肝脏的线粒体内膜体(mitoplast)上分离出一个40 kDa的糖蛋白,并检测了其钙离子吸收活性。1994年,Zazueta等[61]从鼠肾脏线粒体中分离出一种可以介导钙吸收并被钌360所抑制的20 kDa蛋白。这些早期努力都未真正找到MCU。根据估算MCU的turnover数并与已知通道和载体蛋白的turnover数进行比较,人们推测MCU可能是载体蛋白或门控通道[36]。2004年,Kirichok等[38]通过膜片钳技术研究了COS-7细胞的线粒体内膜体 (mitoplast)的钙通道,发现线粒体内膜上存在一种钙离子高选择性的内向整流 (inwardly rectifying current)通道,并称之为MiCa(mitochondrial calcium)通道;他们分析了MiCa通道的动力学和抑制剂特征,认为MiCa通道即为MCU。至此,人们第一次认识到MCU是一个通道而不是一种载体蛋白。然而,MCU的基因筛查直到最近几年才有了新的突破。
2007~2008年,Trenker等[62]和 Brookes等[63]通过对 UCP2/UCP3(uncoupling protein 2/3)的研究,否定了它们作为 MCU的可能性,但同时也指出它们能够影响线粒体的钙离子吸收。2010年,Perocchi等[14]利用鼠源多个组织线粒体基因组数据库——MitoCarta和基因定位 (gene mapping)手段,筛选出了人源线粒体中一个影响线粒体钙吸收的基因MICU1(mitochondrial calcium uptake 1)。有趣的是,此前已报道的人类自身过敏源 (human autoallergen)Hom s 4即为MICU1,它与遗传性过敏皮炎 (atopic dermatitis)密切相关[64]。人源MICU1含有三种剪切形式,全长MICU1分子量为54 kDa且定位于线粒体内膜上,具有一次跨膜螺旋和两个钙离子结合区 (EF hand),推测MICU1本身不能形成孔道,但具有调节MCU的功能[14]。随后,Baughman等[44,66]和Stefani等[65,66]发现了存在于线粒体内膜上、通过与MICU1相互作用而介导线粒体吸收钙离子的MCU;MCU单体的大小为40 kDa,含有两个跨膜螺旋,螺旋之间的连接处富含与钙离子转运相关的酸性氨基酸;根据非变性胶(native PAGE)结果,推测单体蛋白会以高聚的形式发挥钙离子吸收功能。至此,人们才真正地找到了MCU的基因。随后,Bick等[67]又分析了MICU1和MCU在不同物种中的分布情况,结果显示两者的关键区域在进化中非常保守。目前,关于MICU1在调节线粒体通过MCU吸收钙离子过程中的具体作用,存在两种相反的观点。一方面,Perocchi等[14]的研究显示MICU1的敲除会降低线粒体的基础钙离子水平,MICU1敲除的细胞中过表达MICU1会恢复线粒体的钙离子吸收,这显示MICU1起激活作用;然而,Mallilankaraman等[58]发现在线粒体内低钙离子浓度条件下,MICU1抑制MCU吸收钙离子,从而维持线粒体基质内较低的基础钙离子浓度,这又表明 MICU1起抑制作用。在发现MICU1后,Mallilankaraman等[68]及Plovanich等[69]又鉴定出了其它具有调节MCU功能的新分子,包括MCUR1(mitochondrial calcium uniporter regulator 1)、MICU2(mitochondrial calcium uptake 2)及MICU3(mitochondrial calcium uptake 3),它们能够与MCU相互作用而调节钙的吸收。这使得我们相信线粒体通过MCU吸收钙离子是一个高度复杂并受精确调节的过程。
虽然目前已经鉴定出了MCU及其部分调节蛋白的基因,但仍有诸多问题亟待回答,如:人源MCU具有3种剪切形式,拟南芥MCU也有6种剪切形式[70],不同的剪切形式是否与MCU的组织特异性相关?MICU1~3的分布具有组织特异性[69],不同组织的MCU活性是否与此相关?是否存在MCUR1及MICU1~3以外的调节蛋白?MCU转运钙的分子机理是什么,其转运活性如何受到调节?VDAC是否与MCU相互作用来调节钙吸收过程?UCP2/UPC3在线粒体钙离子吸收过程中到底起什么作用?
依赖于RaM的快速线粒体钙吸收
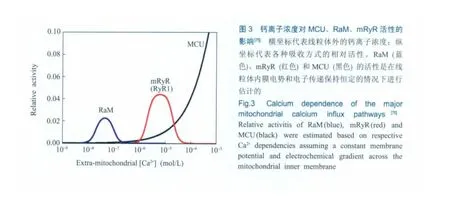
细胞内的钙信号通常是以钙脉冲的形式出现,钙脉冲峰值通常在1μmol/L。通过模拟细胞内的钙离子脉冲,可以测定鼠肝脏线粒体在不同钙离子浓度下的钙吸收曲线。结果表明,所有吸收曲线都很好地吻合单向吸收过程。然而,如果将吸收曲线的时间轴外推至零点,就会发现线粒体在每一个脉冲开始的短时间内会吸收大量的钙离子[71~73](图2);此吸收模式在哺乳类及鸟类的心脏、肝脏和大脑等组织中广泛存在[10]。此外,估算发现,此吸收模式的速率为单向吸收的1000倍以上[74],由此人们称之为快速线粒体钙吸收RaM。
和单向吸收过程一样,RaM依赖于线粒体的内膜电势,可被解偶联剂和钌红等抑制(图2)。此外,不同组织来源的线粒体的RaM存在差异性,特别是在抑制剂和激活剂方面[10,75]。

RaM可以被线粒体外高浓度的钙离子所抑制,而当钙离子浓度降低到一定值 (鼠肝脏线粒体为100 nmol/L)时,RaM就可以在短时间内再次被激活[74]。因此,根据RaM具有转运速率高、可以被低浓度钙离子反复激活的特征,Gunter等[10]推测不处于钙微区的线粒体在不能利用MCU单向吸收钙离子的情况下,可以利用RaM调控ATP合成的速率,以满足细胞的能量代谢需求。目前,RaM所依赖的分子机制研究进展缓慢,通过对比RaM与MCU抑制剂及其动力学过程,人们推测RaM可能为MCU的不同构象[10,58]。
依赖于线粒体雷诺丁受体的钙吸收
雷诺丁受体 (ryanodine receptor,RyR)是内质网/肌质网上负责将钙离子释放至胞浆中的一种钙通道,且是已知最大的钙通道 (>2MD)。目前已鉴定出三种雷诺丁剪切形式,分别是RyR1、2和3,它们会形成同源四聚体来行使通道功能[76];三种剪切形式有着不同的药理学特征和组织表达特异性[77]。相对于内网上存在RyR的事实,线粒体内膜 (嵴)上是否存在RyR目前仍处于争论之中。利用免疫电镜和免疫杂交等手段,Beutner等[78]发现存在一个600 kDa大小的线粒体雷诺丁受体mRyR定位在鼠心脏线粒体嵴上,且与RyR1相似;由于线粒体存在内膜负电势,Beutner等及其他研究组[80,81]认为mRyR在生理条件下行使线粒体钙吸收功能,线粒体钙过载时则会介导线粒体钙的释放,且其活性受胞浆内钙离子浓度的调节。然而,Salnikov等[82]认为鼠心脏线粒体嵴上不存在mRyR。此外,Uehara等[83]报道在鼠脾脏静脉窦上皮细胞线粒体嵴上也存在mRyR,并与RyR3相似。因此,是否存在mRyR还需要进一步的验证。
MCU、RaM和mRyR的活性对钙离子浓度的依赖是不同的——RaM在低钙离子浓度下被激活,在高钙离子浓度下被抑制;MCU在低钙离子浓度下活性很低,在高钙离子浓度下被激活;mRyR通道只有在一定的钙离子浓度下才开放,并受到线粒体内膜电势调节。依据MCU、RaM和mRyR的吸收动力学特征,一种猜测认为——在鼠心脏线粒体钙离子吸收的最初阶段,钙离子浓度较低,钙离子吸收以RaM为主;当线粒体外钙离子浓度逐渐升高时,RaM会被抑制而转向以依赖mRyR和MCU为主的吸收[75,84](图3)。但是,由于线粒体上是否存在mRyR还存在争议,这个模型是否成立还值得商榷。
其他钙吸收方式——人类心脏线粒体mCa1和mCa2电流
Michels等[85]于2009年通过膜片钳技术鉴定出人类心肌细胞线粒体内膜上的两种钙离子转运通道电流——mCa1和mCa2。通过对其激活剂和抑制剂的研究,他们倾向于认为mCa1就是MCU形成的通道电流,而mCa2形成的机制目前尚不清楚。
线粒体的钙离子释放
由于线粒体的内膜存在负电势 (通常在-150~-180 mV之间),其钙离子的释放必然是一个克服电化学梯度的过程。因此,钙离子释放过程需要与其他放能过程相偶联。通常认为线粒体可以通过以下几种方式释放钙离子:1)钠离子依赖的钙离子释放 (mNCX);2)钠离子非依赖的钙离子释放 (NICE);3)其他释放方式:DAG激活的阳离子通道(DAG-activated cation-selective channel,DCC)和线粒体通透性转变孔道 (mitochondrial permeability transition pore,mPTP)介导的钙释放。
钠离子依赖的钙离子释放(mNCX)
mNCX主要存在于心脏、大脑、骨骼肌、腮腺等兴奋组织,以及大多数癌症组织中。mNCX介导Ca2+与Na+交换的过程中,Ca2+可以被Sr2+替代,Na+可以被Li+替代[86]。通过大量的研究,Brand等[31]认为mNCX介导Na+与Ca2+交换的过程中,Na+与Ca2+的比例为3而不是2。地尔硫卓、氯硝安定及苯并硫氮杂卓类化合物 (例如CGP37157)可以作为mNCX的抑制剂,其中,CGP37157最为常用[87]。但是,这些化合物的抑制效果具有细胞类型依赖性[6,12]。此外,钾离子和质子对mNCX也具有一定的调节作用,这种调节作用依赖于膜电势[86]。
与MCU相似,mNCX的分子机制研究也一直进展缓慢。1992年,Li等[88]从鼠心脏线粒体中分离出一种能够介导钠离子依赖的钙离子释放的、大小为110 kDa的蛋白。2004年,Paucek等[89]分离出了牛心线粒体中的Na+/Ca2+交换体。然而这些结果没有得到重复。2004年,Cai等[90]通过对包括Na+/Ca2+的阳离子/钙离子交换体超家族 (Cation/Ca2+exchanger)的生物信息学研究,发现了该超家族中的一个新基因。随后,他们对该基因进行功能研究,发现它具有介导Na+/Ca2+交换的活性,且该活性依赖于钾离子的存在,因此将其命名为NCKX6[91]。但是,Palty等[92]随后发现NCKX6具有不依赖于钾离子的Na+/Ca2+交换活性,且与mNCX一致的是,在交换过程中锂离子可以替换钠离子,因此,他们将其改称为NCLX。2010年,Palty等[93]发现NCLX定位在线粒体嵴上,并能够影响线粒体钙的释放。至此,人们推测NCLX可能就是线粒体mNXC的基因。
虽然已鉴定出线粒体mNCX的基因——NCLX,但目前关于NCLX的功能和结构研究很少[92,94],存在许多亟待解决的问题。例如,鼠不同组织来源的NCLX蛋白表达水平的差异与相应组织的mNCX活性并不线性相关[91],那么,不同组织,特别是兴奋组织的mNCX活性是否与NCLX的蛋白翻译后修饰有关?另一方面,NCLX是否只定位在线粒体上?Cai等[91]发现表达在HEK293中的鼠全长NCLX定位在内质网上,而截短体定位在质膜上,但Palty等[93]发现NCLX只定位在线粒体内膜上。此外,NCLX存在分子量为70 kDa和55 kDa两种剪切形式,它们都具有Na+/Ca2+交换活性,这两种剪切形式的生理意义是什么[92]?NCLX介导钙释放的分子机制是什么且与其它通道介导的Na+/Ca2+交换区别是什么?
钠离子非依赖性的钙离子释放(NICE)
在发现mNCX的同时,研究者发现在肝脏、肾脏、肺和平滑肌等非兴奋组织中存在钠离子非依赖的钙释放途径,即NICE。NICE除了能够介导释放Ca2+,还能够释放Sr2+、Ba2+和Mn2+。因此,人们认为NICE不仅仅是钙离子释放的方式,而是线粒体内二价离子释放的统一模式[86]。研究表明,NICE介导钙离子释放是一个电中性的过程——即它介导两个H+和一个Ca2+的相对转运,因此,人们认为NICE介导钙离子释放所需能量完全等价于质子运输过程中释放的能量。但是,计算表明NICE释放钙所需的能量是质子电化学梯度的3.5到47倍,因此推测 NICE介导钙释放的过程中还需要其他的能量来源[95]。据报道,NICE除了可以被一些氧化抑制剂和解偶联剂抑制外,还可以被钌红抑制[86]。
迄今为止,关于NICE的分子机制研究进展缓慢。1998年,Villa等[96]分离出鼠肝线粒体中一个66 kDa的H+/Ca2+交换体。但后续研究没有重复出该结果。2009年,Jiang等[97]在果蝇和HeLa细胞线粒体中发现Letm1(leucine zipper EF hand-containing transmembrane protein 1)可以介导H+/Ca2+交换,它可以在低钙浓度下介导1个H+和1个Ca2+的交换。然而,Jiang等的研究仅观察到Letm1介导线粒体钙的吸收——HeLa细胞中过表达Letm1可以在激动剂诱导下使线粒体内钙离子浓度上升。相反的是,Waldeck等[98]发现增加上皮细胞内线粒体外的钙离子浓度时,过表达Letm1并不能使线粒体内的钙离子浓度上升。有趣的是,Dimmer等[99]发现在酵母细胞中敲除Letm1的同源基因Mdm38后,加入尼日利亚菌素(H+/K+交换体)可以使酵母恢复生长,由此他们推测Letm1是一个H+/K+交换体,而不是行使H+/Ca2+交换的功能[66]。
其他钙离子释放途径
膜片钳实验研究发现,在人脑线粒体中,二酰基甘油 (diacyl glycerol,DAG)能够激活对镧敏感的阳离子通道,说明存在DAG激活的阳离子通道DCC(DAG-activated cation-selective channel)。虽然体内实验表明DCC能够介导线粒体释放钙离子,但在DCC单独重组的脂质体实验中,并没有发现其具钙转运活性。结合电导和抑制剂实验,研究者推测DCC参与的线粒体钙离子释放需要除DCC以外的其他分子参与[75,100]。
已有的动力学数据表明,线粒体内膜上已知的钙离子释放途径的释放速率小于其吸收速率,因此,必然存在其他的钙离子释放途径,以避免正常线粒体的钙过载。有人认为线粒体通透性转变孔道mPTP可以通过在短暂的开放和关闭之间进行跳跃 (Flicker),来参与正常线粒体的钙离子释放[10]。但是,mPTP是否行使钙离子释放仍然是一个疑问——mPTP是一个高通量、低选择性的激活孔道,它可以被高浓度钙离子激活而开放;然而,当mPTP被持续性激活后就有可能导致细胞凋亡[9,101]。因此,研究者认为即使mPTP以Fliker形式参与正常线粒体的钙释放,它也需要精确的调控。
线粒体钙离子吸收释放与疾病
由于线粒体内的钙离子浓度会影响线粒体ATP的合成、线粒体mPTP的开放、细胞质内的钙信号及胞浆钙稳态的维持。因此,保持正常的线粒体钙离子转运能力具有重要生理意义,它的异常与许多重要疾病相关。
无论是在缺血/再灌流还是在缺氧/再供氧的情况下,肌细胞线粒体内的钙离子浓度都会增加,这或者增加心肌细胞能量的供应,或者导致心肌细胞的死亡。Griffth等[11]认为,在缺氧状态下,心肌细胞线粒体内钙离子浓度的增加是由于mNCX会逆转而吸收钙离子。Castaldo等[12]通过对大脑缺血、癫痫和老年痴呆情况下线粒体内钙离子的研究,发现线粒体内钙离子浓度的变化与神经细胞的存活密切相关。
在动物模型中使用线粒体钙转运抑制剂来观察线粒体钙转运对生理功能的影响,发现不同种类抑制剂的使用具有细胞类型依赖性。此外,研究还发现,使用钌红、钌360、地尔硫卓、氯硝安定和CGP37157等抑制剂并没有得到理想的效果,有时甚至得到相反的效果[6,12]。因此,人们迫切希望解决线粒体钙转运的分子机制,以期获得特异性的药物来调控线粒体的钙转运。
结 语
钙离子通过线粒体上的不同转运机制穿梭于线粒体与细胞质之间,调节线粒体乃至整个细胞的生理功能。近半个世纪以来,人们通过生化、电生理等方法研究了线粒体的各种钙离子转运途径,获得了它们的离子选择特异性、激活剂/抑制剂、动力学、电导等多种特征,使我们对这些过程有了一定程度的认识。近年来,由于分子生物学和生物信息学等技术手段的发展与成熟,人们对这些钙离子转运途径所依赖的分子基础有了一定的认识。未来人们将通过结构生物学和生物化学等手段,对不同组织来源的、诸如MCU依赖的钙离子单向吸收和钠离子依赖的钙离子释放等过程的分子机制做出深入的揭示,从而丰富人们对线粒体钙转运平衡机制的认识。此外,由于MCU、MICU1、NCLX等线粒体钙转运基因的鉴定,线粒体钙转运的研究将从传统的细胞水平转向分子水平,从而更直接准确地阐释线粒体钙转运的生理功能。同时,由于线粒体处于不断融合分裂和沿细胞骨架运动的动态过程中,线粒体与内质网/肌质网、质膜等细胞器在时空上存在着密切的关联,因此,线粒体的钙转运必定与这些细胞器上的钙转运密切相关并相互作用和影响,这也将成为下一步的研究重点。
1. Ringer S.A further contribution regarding the influence of the different constituents of the blood on the contraction of the heart.J Physiol,1883,4(1):29~42.3
2. Berridge MJ, Bootman MD, Roderick HL. Calcium signalling:Dynamics,homeostasis and remodelling.Nat Rev Mol Cell Biol,2003,4(7):517~529
3. Gunter TE,Yule DI,Gunter KK,Eliseev RA,Salter JD.Calcium and mitochondria. FEBS lett, 2004, 567(1):96~102
4.Schatz G.The magic garden.Annu Rev Biochem,2007,76:673~678
5. Carafoli E. The fateful encounter of mitochondria with calcium:How did it happen?Biochim Biophys Acta,2010,1797(6-7):595~606
6. Pizzo P,Drago I,Filadi R,Pozzan T.Mitochondrial Ca2+homeostasis:Mechanism,role,and tissue specificities.Pflugers Archiv J,2012,464(1):3~17
7.McCormack JG,Denton RM.Role of calcium ions in the regulation of intramitochondrial metabolism.Properties of the Ca2+-sensitive dehydrogenases within intact uncoupled mitochondria from the white and brown adipose tissue of the rat.Biochem J,1980,190(1):95~105
8.Cortassa S,Aon MA,Marban E,Winslow RL,O'Rourke B.An integrated model of cardiac mitochondrial energy metabolism and calcium dynamics.Biophys J,2003,84(4):2734~2755
9.Vieira HL,Kroemer G.Pathophysiology of mitochondrial cell death control.Cell Mol Life Sci,1999,56(11-12):971~976
10.Gunter TE,Sheu SS.Characteristics and possible functions of mitochondrial Ca(2+)transport mechanisms.Biochim Biophys Acta,2009,1787(11):1291~1308
11.Griffiths EJ.Mitochondrial calcium transport in the heart:Physiological and pathological roles.J Mol Cell Cardiol,2009,46(6):789~803
12.Castaldo P,Cataldi M,Magi S,Lariccia V,Arcangeli S,Amoroso S. Role of the mitochondrial sodium/calcium exchanger in neuronal physiology and in the pathogenesis of neurological diseases.Prog Neurobiol,2009,87(1):58~79
13.Contreras L,Drago I,Zampese E,Pozzan T.Mitochondria:The calcium connection.Biochim Biophys Acta,2010,1797(6-7):607~618
14.Perocchi F,Gohil VM,Girgis HS,Bao XR,McCombs JE,Palmer AE,Mootha VK.MICU1 encodes a mitochondrial EF hand protein required for Ca(2+)uptake.Nature,2010,467(7313):291~296
15.Rizzuto R,Pozzan T.Microdomains of intracellular Ca2+:Molecular determinants and functional consequences.Physiol Rev,2006,86(1):369~408
16.Montero M,Alonso MT,Carnicero E,Cuchillo-Ibanez I,Albillos A, Garcia AG, Garcia-Sancho J, Alvarez J.Chromaffin-cell stimulation triggers fast millimolar mitochondrial Ca2+transients that modulate secretion.Nat Cell Biol,2000,2(2):57~61
17.Sampson MJ,Lovell RS,Davison DB,Craigen WJ.A novel mouse mitochondrial voltage-dependent anion channel gene localizes to chromosome 8.Genomics,1996,36(1):192~196
18.De Pinto V,Guarino F,Guarnera A,Messina A,Reina S,Tomasello FM,Palermo V,Mazzoni C.Characterization of human VDAC isoforms:A peculiar function for VDAC3?Biochim Biophys Acta,2010,1797(6-7):1268~1275
19.Roy SS,Ehrlich AM,Craigen WJ,Hajnoczky G.VDAC2 is required for truncated BID-induced mitochondrial apoptosis by recruiting BAK to the mitochondria.EMBO Rep,2009,10(12):1341~1347
20.Roy SS,Madesh M,Davies E,Antonsson B,Danial N,Hajnoczky G.Bad targets the permeability transition pore independent of Bax or Bak to switch between Ca2+-dependent cell survival and death.Mol Cell,2009,33(3):377~388
21.Cheng EH,Sheiko TV,Fisher JK,Craigen WJ,Korsmeyer SJ. VDAC2 inhibits BAK activation and mitochondrial apoptosis.Science,2003,301(5632):513~517
22.Schein SJ,Colombini M,Finkelstein A.Reconstitution in planar lipid bilayers of a voltage-dependent anion-selective channel obtained from paramecium mitochondria.J Membr Biol,1976,30(2):99~120
23.Shoshan-Barmatz V,Gincel D.The voltage-dependent anion channel:Characterization,modulation,and role in mitochondrial function in cell life and death.Cell Biochem Biophys,2003,39(3):279~292
24.Gincel D,Zaid H,Shoshan-Barmatz V.Calcium binding and translocation by the voltage-dependent anion channel:A possible regulatory mechanism in mitochondrial function.Biochem J,2001,358(Pt 1):147~155
25.Colombini M.Structure and mode of action of a voltage dependent anion-selective channel(VDAC)located in the outer mitochondrial membrane.Ann N Y Acad Sci,1980,341:552~563
26.Ujwal R,Cascio D,Colletier JP,Faham S,Zhang J,Toro L,Ping P,Abramson J.The crystal structure of mouse VDAC1 at 2.3Åresolution reveals mechanistic insights into metabolite gating.Proc Natl Acad Sci USA,2008,105(46):17742~17747
27. Israelson A, Abu-Hamad S, Zaid H, Nahon E,Shoshan-Barmatz V.Localization of the voltage-dependent anion channel-1 Ca2+-binding sites.Cell Calcium,2007,41(3):235~244
28.Rapizzi E,Pinton P,Szabadkai G,Wieckowski MR,Vandecasteele G,Baird G,Tuft RA,Fogarty KE,Rizzuto R.Recombinant expression of the voltage-dependent anion channel enhances the transfer of Ca2+microdomains to mitochondria.J Cell Biol,2002,159(4):613~624
29.Rizzuto R,De Stefani D,Raffaello A,Mammucari C.Mitochondria as sensors and regulators of calcium signalling.Nat Rev Mol Cell Biol,2012,13(9):566~578
30. Bathori G, Csordas G, Garcia-Perez C, Davies E,Hajnoczky G.Ca2+-dependent control of the permeability properties of the mitochondrial outer membrane and voltage-dependent anion-selective channel(VDAC).J Biol Chem,2006,281(25):17347~17358
31.Brand MD.The stoichiometry of the exchange catalysed by the mitochondrial calcium/sodium antiporter.Biochem J,1985,229(1):161~166
32.Griffiths EJ,Ocampo CJ,Savage JS,Rutter GA,Hansford RG, Stern MD, Silverman HS. Mitochondrial calcium transporting pathways during hypoxia and reoxygenation in single rat cardiomyocytes.Cardiovasc Res,1998,39(2):423~433
33.Selwyn MJ,Dawson AP,Dunnett SJ.Calcium transport in mitochondria.FEBS Lett,1970,10(1):1~5
34. Lehninger AL,Carafoli E,Rossi CS.Energy-linked ion movements in mitochondrial systems.Adv Enzymol Relat Areas Mol Biol,1967,29:259~320
35.Scarpa A,Azzone GF.The mechanism of ion translocation in mitochondria.4.Coupling of K+efflux with Ca2+uptake.Eur J Biochem,1970,12(2):328~335
36.Gunter TE,Pfeiffer DR.Mechanisms by which mitochondria transport calcium.Am J Physiol,1990,258(5 Pt 1):C755~786
37.Wingrove DE,Amatruda JM,Gunter TE.Glucagon effects on the membrane potential and calcium uptake rate of rat liver mitochondria.J Biol Chem,1984,259(15):9390~9394
38.Kirichok Y,Krapivinsky G,Clapham DE.The mitochondrial calcium uniporter is a highly selective ion channel.Nature,2004,427(6972):360~364
39.Moreau B,Nelson C,Parekh AB.Biphasic regulation of mitochondrial Ca2+uptake by cytosolic Ca2+concentration.Curr Biol,2006,16(16):1672~1677
40.Putney JW Jr,Thomas AP.Calcium signaling:Double duty for calcium at the mitochondrial uniporter.Curr Biol,2006,16(18):R812~815
41.Drahota Z,Gazzotti P,Carafoli E,Rossi CS.A comparison of the effects of different divalent cations on a number of mitochondrial reactions linked to ion translocation. Arch Biochem Biophys,1969,130(1):267~273
42.Vainio H,Mela L,Chance B.Energy dependent bivalent cation translocation in rat liver mitochondria. Eur J Biochem,1970,12(2):387~391
43. Tew WP. Use of the coulombic interactions of the lanthanide series to identify two classes of Ca2+binding sites in mitochondria.Biochem Biophys Res Commun,1977,78(2):624~630
44.Baughman JM,Perocchi F,Girgis HS,Plovanich M,Belcher-Timme CA,Sancak Y,Bao XR,Strittmatter L,Goldberger O,Bogorad RL,Koteliansky V,Mootha VK.Integrative genomics identifies MCU as an essential component of the mitochondrial calcium uniporter.Nature,2011,476(7360):341~345
45.Noack E, Greeff K. Inhibition of calcium transport in mitochondria by -receptor blocking substances and its reactivation by phospholipids.Experientia,1971,27(7):810~811
46.Davidoff F.Effects of guanidine derivatives on mitochondrial function.Ca2+uptake and release.J Biol Chem,1974,249(20):6406~6415
47.Gemba M.Effect of diuretics on ion transport of kidney cortex mitochondria.II.Mode of action of ethacrynic acid on mitochondrial calcium pump.Japan J Pharmacol,1974,24(2):271~277
48.Crompton M,Kessar P,Al-Nasser I.The alpha-adrenergicmediated activation of the cardiac mitochondrial Ca2+uniporter and its role in the control of intramitochondrial Ca2+in vivo.Biochem J,1983,216(2):333~342
49.Nicchitta CV,Williamson JR.Spermine.A regulator of mitochondrial calcium cycling.J Biol Chem,1984,259(21):12978~12983
50. Pegg AE, McCann PP. Polyamine metabolism and function.Am J Physiol,1982,243(5):C212~221
51.Kroner H.Spermine,another specific allosteric activator of calcium uptake in rat liver mitochondria. Arch Biochem Biophys,1988,267(1):205~210
52.Lenzen S,Hickethier R,Panten U.Interactions between spermine and Mg2+on mitochondrial Ca2+transport.J Biol Chem,1986,261(35):16478~16483
53.Gunter TE,Gunter KK.Uptake of calcium by mitochondria:Transport and possible function.IUBMB Life,2001,52(3-5):197~204
54.Vinogradov A,Scarpa A.The initial velocities of calcium uptake by rat liver mitochondria.J Biol Chem, 1973,248(15):5527~5531
55.Akerman KE.Effect of cations on the temperature sensitivity of Ca2+transport in rat-liver mitochondria and safranine uptake by liposomes.J Bioenerg Biomembr,1977,9(2):141~149
56.Akerman KE.Effect of Mg2+and spermine on the kinetics of Ca2+transport in rat-liver mitochondria. J Bioenerg Biomembr,1977,9(1):65-72
57.Rizzuto R,Simpson AW,Brini M,Pozzan T.Rapid changes of mitochondrial Ca2+revealed by specifically targeted recombinant aequorin.Nature,1992,358(6384):325~327
58.Mallilankaraman K,Doonan P,Cardenas C,Chandramoorthy HC,Muller M,Miller R,Hoffman NE,Gandhirajan RK,Molgo J,Birnbaum MJ,Rothberg BS,Mak DO,Foskett JK,Madesh M.MICU1 is an essential gatekeeper for MCU-mediated mitochondrial Ca(2+)uptake that regulates cell survival.Cell,2012,151(3):630~644
59.Sottocasa G,Sandri G,Panfili E,De Bernard B,Gazzotti P,Vasington FD,Carafoli E.Isolation of a soluble Ca2+binding glycoprotein from ox liver mitochondria.Biochem Biophys Res Commun,1972,47(4):808~813
60.Saris NE,Sirota TV,Virtanen I,Niva K,Penttila T,Dolgachova LP, Mironova GD. Inhibition of the mitochondrial calcium uniporter by antibodies against a 40-kDa glycoprotein T.J Bioenerg Biomembr,1993,25(3):307~312
61.Zazueta C,Masso F,Paez A,Bravo C,Vega A,Montano L,Vazquez M,Ramirez J,Chavez E.Identification of a 20-kDa protein with calcium uptake transport activity.Reconstitution in a membrane model. J Bioenerg Biomembr,1994,26(5):555~562
62.Trenker M,Malli R,Fertschai I,Levak-Frank S,Graier WF.Uncoupling proteins 2 and 3 are fundamental for mitochondrial Ca2+uniport. Nat Cell Biol, 2007, 9(4):445~452
63.Brookes PS,Parker N,Buckingham JA,Vidal-Puig A,Halestrap AP, Gunter TE, Nicholls DG, Bernardi P,Lemasters JJ,Brand MD.UCPs——Unlikely calcium porters.Nat Cell Biol,2008,10(11):1235~1237;Author reply 1237~1240
64.Aichberger KJ,Mittermann I,Reininger R,Seiberler S,Swoboda I,Spitzauer S,Kopp T,Stingl G,Sperr WR,Valent P,Repa A,Bohle B,Kraft D,Valenta R.Hom s 4,an IgE-reactive autoantigen belonging to a new subfamily of calcium-binding proteins, can induce Th cell type 1-mediated autoreactivity. J Immunol, 2005, 175(2):1286~1294
65.De Stefani D,Raffaello A,Teardo E,Szabo I,Rizzuto R.A forty-kilodalton protein of the inner membrane is the mitochondrial calcium uniporter.Nature,2011,476(7360):336~340
66. Drago I, Pizzo P, Pozzan T. After half a century mitochondrial calcium in-and efflux machineries reveal themselves.EMBO J,2011,30(20):4119~4125
67.Bick AG,Calvo SE,Mootha VK.Evolutionary diversity of the mitochondrial calcium uniporter. Science, 2012,336(6083):886
68.Mallilankaraman K,Cardenas C,Doonan PJ,Chandramoorthy HC,Irrinki KM,Golenar T,Csordas G,Madireddi P,Yang J,Muller M,Miller R,Kolesar JE,Molgo J,Kaufman B,Hajnoczky G,Foskett JK,Madesh M.MCUR1 is an essential component of mitochondrial Ca2+uptake that regulates cellular metabolism.Nat Cell Biol,2012,14(12):1336~1343
69.Plovanich M,Bogorad RL,Sancak Y,Kamer KJ,Strittmatter L,Li AA,Girgis HS,Kuchimanchi S,De Groot J,Speciner L,Taneja N,Oshea J,Koteliansky V,Mootha VK.MICU2,a paralog of MICU1, resides within the mitochondrial uniporter complex to regulate calcium handling.PLoS One,2013,8(2):e55785
70.Stael S,Wurzinger B,Mair A,Mehlmer N,Vothknecht UC,Teige M.Plant organellar calcium signalling:An emerging field.J Exper Bot,2012,63(4):1525~1542
71.Sparagna GC,Gunter KK,Gunter TE.A system for producing and monitoring in vitro calcium pulses similar to those observed in vivo.Anal Biochem,1994,219(1):96~103
72.Hajnoczky G,Robb-Gaspers LD,Seitz MB,Thomas AP.Decoding of cytosolic calcium oscillations in the mitochondria.Cell,1995,82(3):415~424
73.Gunter TE,Buntinas L,Sparagna GC,Gunter KK.The Ca2+transport mechanisms of mitochondria and Ca2+uptake from physiological-type Ca2+transients. Biochim Biophys Acta,1998,1366(1-2):5~15
74. Sparagna GC, Gunter KK, Sheu SS, Gunter TE.Mitochondrial calcium uptake from physiological-type pulses of calcium.A description of the rapid uptake mode.J Biol Chem,1995,270(46):27510~27515
75.Ryu SY,Beutner G,Dirksen RT,Kinnally KW,Sheu SS.Mitochondrial ryanodine receptors and other mitochondrial Ca2+permeable channels.FEBS Lett,2010,584(10):1948~1955
76. Lanner JT, Georgiou DK, Joshi AD, Hamilton SL.Ryanodine receptors:Structure, expression, molecular details,and function in calcium release.Cold Spring Harb Perspect Biol,2010,2(11):a003996
77.Shoshan-Barmatz V,Ashley RH.The structure,function,and cellular regulation of ryanodine-sensitive Ca2+release channels.Int Rev Cytol,1998,183:185~270
78.Beutner G,Sharma VK,Giovannucci DR,Yule DI,Sheu SS. Identification of a ryanodine receptor in rat heart mitochondria.J Biol Chem,2001,276(24):21482~21488
79.Beutner G,Sharma VK,Lin L,Ryu SY,Dirksen RT,Sheu SS.Type 1 ryanodine receptor in cardiac mitochondria:Transducer of excitation-metabolism coupling. Biochim Biophys Acta,2005,1717(1):1~10
80.Zhao F,Li P,Chen SR,Louis CF,Fruen BR.Dantrolene inhibition of ryanodine receptor Ca2+release channels.Molecular mechanism and isoform selectivity.J Biol Chem,2001,276(17):13810~13816
81.Tripathy A,Resch W,Xu L,Valdivia HH,Meissner G.Imperatoxin A induces subconductance states in Ca2+release channels (ryanodine receptors) of cardiac and skeletal muscle.J Gen Physiol,1998,111(5):679~690
82.Salnikov V,Lukyanenko YO,Lederer WJ,Lukyanenko V.Distribution of ryanodine receptors in rat ventricular myocytes.J Muscle Res Cell Motil,2009,30(3-4):161~170
83.Uehara K,Onoue H,Jeyakumar LH,Fleischer S,Uehara A. Localization of ryanodine receptor 3 in the sinus endothelial cells of the rat spleen.Cell Tissue Res,2004,317(2):137~145
84.Hoppe UC.Mitochondrial calcium channels.FEBS Lett,2010,584(10):1975~1981
85.Michels G,Khan IF,Endres-Becker J,Rottlaender D,Herzig S,Ruhparwar A,Wahlers T,Hoppe UC.Regulation of the human cardiac mitochondrial Ca2+uptake by 2 different voltage-gated Ca2+channels. Circulation, 2009,119(18):2435~2443
86.Gunter TE,Buntinas L,Sparagna G,Eliseev R,Gunter K.Mitochondrial calcium transport:mechanisms and functions.Cell Calcium,2000,28(5-6):285~296
87. Chiesi M, Schwaller R, Eichenberger K. Structural dependency of the inhibitory action of benzodiazepines and related compounds on the mitochondrial Na+-Ca2+exchanger.Biochem Pharmacol,1988,37(22):4399~4403
88.Li W,Shariat-Madar Z,Powers M,Sun X,Lane RD,Garlid KD. Reconstitution, identification, purification, and immunological characterization of the 110-kDa Na+/Ca2+antiporter from beef heart mitochondria. J Biol Chem,1992,267(25):17983~17989
89.Paucek P,Jaburek M.Kinetics and ion specificity of Na(+)/Ca(2+)exchange mediated by the reconstituted beef heart mitochondrial Na(+)/Ca(2+) antiporter. Biochim Biophys Acta,2004,1659(1):83~91
90.Cai X,Lytton J.The cation/Ca(2+)exchanger superfamily:Phylogenetic analysis and structural implications.Mol Biol Evol,2004,21(9):1692~1703
91.Cai X,Lytton J.Molecular cloning of a sixth member of the K+-dependent Na+/Ca2+exchanger gene family,NCKX6.J Biol Chem,2004,279(7):5867~5876
92.Palty R,Ohana E,Hershfinkel M,Volokita M,Elgazar V,Beharier O, Silverman WF, Argaman M, Sekler I.Lithium-calcium exchange is mediated by a distinct potassium-independent sodium-calcium exchanger.J Biol Chem,2004,279(24):25234~25240
93.Palty R,Silverman WF,Hershfinkel M,Caporale T,Sensi SL,Parnis J,Nolte C,Fishman D,Shoshan-Barmatz V,Herrmann S, Khananshvili D, Sekler I. NCLX is an essential component of mitochondrial Na+/Ca2+exchange.Proc Natl Acad Sci USA,2010,107(1):436~441
94.Palty R,Hershfinkel M,Yagev O,Saar D,Barkalifa R,Khananshvili D,Peretz A,Grossman Y,Sekler I.Single alpha-domain constructs of the Na+/Ca2+exchanger,NCLX,oligomerize to form a functional exchanger.Biochemistry,2006,45(39):11856~11866
95.Gunter KK,Zuscik MJ,Gunter TE.The Na(+)-independent Ca2+efflux mechanism of liver mitochondria is not a passive Ca2+/2H+exchanger.J Biol Chem,1991,266(32):21640~21648
96.Villa A,Garcia-Simon MI,Blanco P,Sese B,Bogonez E,Satrustegui J. Affinity chromatography purification of mitochondrial inner membrane proteins with calcium transport activity.Biochim Biophys Acta,1998,1373(2):347~359
97.Jiang D,Zhao L,Clapham DE.Genome-wide RNAi screen identifies Letm1 as a mitochondrial Ca2+/H+antiporter.Science,2009,326(5949):144~147
98.Waldeck-Weiermair M,Jean-Quartier C,Rost R,Khan MJ,Vishnu N,Bondarenko AI,Imamura H,Malli R,Graier WF.Leucine zipper EF hand-containing transmembrane protein 1(Letm1) and uncoupling proteins 2 and 3(UCP2/3)contribute to two distinct mitochondrial Ca2+uptake pathways.J Biol Chem,2011,286(32):28444~28455
99.Dimmer KS,Navoni F,Casarin A,Trevisson E,Endele S,Winterpacht A,Salviati L,Scorrano L.LETM1,deleted in Wolf-Hirschhorn syndrome is required for normal mitochondrial morphology and cellular viability.Hum Mol Genet,2008,17(2):201~214
100.Chinopoulos C,Starkov AA,Grigoriev S,Dejean LM,Kinnally KW, Liu X, Ambudkar IS, Fiskum G.Diacylglycerols activate mitochondrial cationic channel(s)and release sequestered Ca(2+).J Bioenerg Biomembr,2005,37(4):237~247
101.Crompton M.The mitochondrial permeability transition pore and its role in cell death.Biochem J,1999,341(Pt 2):233~249