MMP-9和TIMP-1mRNA在食管鳞状细胞癌组织中的表达及其意义
孙晓宏,吕红博,李 卉,尹 娜,李慧武,庞作良
(1.新疆医科大学附属肿瘤医院胸外科,新疆 乌鲁木齐830011;
2.新疆医科大学基础医学院科研中心,新疆 乌鲁木齐 830001)
食管癌是最具侵袭力的消化道恶性肿瘤,其发病率在全球呈现上升趋势[1-2]。肿瘤进展和转移的第一步就是微血管及表皮基底膜的降解。肿瘤细胞的迁移与细胞外基质(extra cellular matrix,ECM)的降解有关[3]。ECM由各种大分子组成,如胶原、纤维黏连蛋白、层黏连蛋白和结缔组织蛋白多糖。ECM组分由各种蛋白裂解酶降解,其中包括基质金属蛋白酶(matrix metalloproteinase,MMP)和基质金属蛋白酶组织抑制剂(tissue inhibitor of matrix metalloproteinase,TIMP)。以往国外鲜有关于MMP和TIMP与食管癌发生发展关系的报道,国内对于MMP和TIMP的研究多采用免疫组织化学法研究其在蛋白水平的作用,而且多是单独针对MMP或TIMP的单一基因的研究。本研究应用逆转录多聚酶链反应(RT-PCR)技术检测MMP-9和TIMP-1基因在食管癌组织和其相对应的癌旁组织中的表达情况,在基因水平探讨MMP-9和TIMP-1在食管癌发生、发展和转移中的作用。
1 材料与方法
1.1 一般资料 选取2009年12月—2011年9月在新疆医科大学附属肿瘤医院行根治性切除的食管癌手术标本98例,每例标本分别取癌组织和其相对应的癌旁组织各1份。98例患者的肿瘤组织病理学类型均为食管鳞状细胞癌,其中男性患者
70例,女性患者28例;年龄37~80岁,平均年龄为57.3岁。根据食管癌TNM分期标准,T1+T2期患者共37例,T3+T4期患者共61例。并发淋巴结转移患者51例,无淋巴结转移的患者47例。细胞分化程度呈高、中和低分化的分别有18、58和22例。
1.2 主要试剂和仪器 Trizol试剂盒购自美国Invitrogen公司,逆转录试剂盒购自美国Promega公司,PCR试剂盒购自上海生物工程有限公司,新疆医科大学基础医学院科研中心为本次实验提供了的其他所需试剂,如溴化乙锭(EB)、琼脂糖、氯仿、无水乙醇、异戊醇和异丙醇等;PCR扩增仪和凝胶成像分析仪购自美国Bio-Rad公司。
1.3 组织标本中总RNA的提取和浓度检测 按照Trizol试剂盒的说明书,逐步进行组织标本中总RNA的提取,然后使用紫外分光光度计分别测定1μg组织标本所提取RNA在波长260和280nm处的吸光度(A260和A280)值,计算两者的比值,确保所提取的RNA浓度和纯度在1.8~2.1。配制浓度为1.2%琼脂糖凝胶,取5μL RNA于上述琼脂糖凝胶中电泳,于凝胶成像分析仪下观察提取RNA的18S和28S条带,以此判定所提取的RNA的质量。
1.4 互补DNA(cDNA)的合成 分别将1μL引物和9μL双蒸水加入1μL总RNA标本中,混合液混匀后于72℃恒温下温浴10min后取出,将混合液放置在冰上,依次向其中加入4μL MgCl2、2μL dNTP、2μL10倍缓冲液、0.5μL RNA酶抑制剂和0.5μL逆转录酶,混匀后于42℃恒温下反应1h,95℃恒温下反应5min,结束反应后取出并放置在冰上,向其中加入80μL双蒸水使最终逆转录产物体积为100μL。
1.5 PCR反应体系的配制和PCR反应 取6μL双蒸水,向其中依次加入目的基因正向引物1μL、目的基因反向引物1μL和2倍浓度的PCR试剂盒反应溶液10μL,再取2μL上述 “1.4”中已合成的cDNA加入其中,使最终的PCR反应体系体积为20μL。GAPDH、MMP-9和TIMP-1引物序列和PCR反应条件见表1。

表1 GAPDH、MMP-9和TIMP-1的引物序列和PCR反应条件Tab.1 Primer sequences of GAPDH,MMP-9,and TIMP-1and reation conditions of PCR
1.6 PCR扩增产物的判定 5μL PCR反应产物加入1μL缓冲液(buffer)后在2%琼脂糖凝胶上电泳,在DC 2000凝胶成像分析仪下观察胶块上目的基因条带,保存成像结果。如在300bp附近出现亮色条带,则视为MMP-9表达阳性,否则视为阴性;如在250bp附近出现亮色条带,则视为TIMP-1表达阳性,否则视为阴性。
1.7 统计学分析 采用SPSS 16.0统计软件进行统计分析。癌组织和癌旁组织中MMP-9和TIMP-1mRNA阳性表达率比较采用χ2检验,不同临床病理特征食管癌患者癌组织中 MMP-9和TIMP-1 mRNA表达率比较采用χ2检验,癌组织组中MMP-9与 TIMP-1表达率的相关性分析采用Pearson相关分析法。
2 结 果
2.1 癌 组 织 和 癌 旁 组 织 中 MMP-9 和 TIMP-1 mRNA表达 食管癌组织中MMP-9mRNA阳性表达率为46.9%(46/98),对应癌旁组织中阳性表达率为15.3%(15/98),阳性表达率比较差异有统计学意义(χ2=22.873,P=0.000);食管癌组织中TIMP-1mRNA阳性表达率为83.7%(82/98),对应癌旁正常组织中其阳性表达率为66.3%(65/98),阳性表达率比较差异有统计学意义(χ2=7.864,P=0.005)。食管癌组织中 MMP-9 mRNA表达阳性6例,表达阴性6例,对应癌旁组织中MMP-9mRNA表达阳性2例,表达阴性10例;食管癌组织中TIMP-1mRNA表达阳性10例,表达阴性2例,对应癌旁正常组织中TIMP-1 mRNA表达阳性9例,表达阴性3例。见图1。
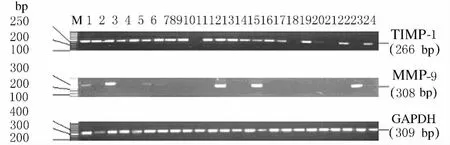
图1 食管癌组织和癌旁组织中MMP-9和TIMP-1表达电泳图Fig.1 Electrophoregram of expressions of MMP-9and TIMP-1in carcinoma tissue and adjacent tissue
2.2 食管癌组织中 MMP-9和 TIMP-1mRNA表达与食管鳞状细胞癌临床病理特征的关联性
MMP-9和TIMP-1mRNA的表达与肿瘤浸润深度有关联,与肿瘤淋巴结转移、患者的性别、年龄和肿瘤分化程度均无关联(P>0.05)。见表2。
2.3 食管癌组织中 MMP-9和 TIMP-1mRNA表达率的相关性 在食管癌组织中MMP-9表达率与TIMP-1mRNA的表达率呈正相关关系(r=2.524,P=0.013),见表3。
3 讨 论
MMP是一类能够降解ECM和基底膜组分的蛋白水解酶,目前发现其家族成员已超过20个,蛋白水平根据各自降解底物的特异性和自身结构的不同分为胶原酶、间质溶解素和明胶酶。近年研究[4-6]显示:MMP在多种肿瘤组织中呈高表达,且与肿瘤浸润有关联,如关于胃癌的研究结果显示:MMP-9在癌组织中的表达高于癌旁胃黏膜组织,且MMP-9表达与胃癌浸润深度有关联;有关结直肠癌的研究[7-8]结果显示:MMP-9在癌组织中的表达高于癌旁正常组织,且其表达与结直肠癌浸润深度有关联。本研究结果显示:MMP-9mRNA表达在食管癌组织中均明显高于癌旁组织,并且其表达与肿瘤浸润深度有关联。本研究结果与上述各研究结论一致,故认为MMP-9在食管癌发生和浸润性生长过程中发挥了重要作用。Koskensalo等[9]应用免疫组化法对结直肠癌的研究发现:MMP-9表达与肿瘤淋巴结转移无关联。Durlik等[10]应用免疫组织化学法对胰腺癌的研究发现:MMP-9表达与淋巴结转移无关联。Oshima等[11]应用 RT-PCR法对结直肠癌的研究发现:MMP-9表达与肿瘤淋巴结转移无关联。Lu等[12]应用免疫组织化学法对食管癌的研究发现:MMP-9表达与淋巴结转移无关联。本研究结果显示:MMP-9表达与肿瘤淋巴结转移无关联,结果与上述研究结果一致,故认为MMP-9在食管癌淋巴结转移方面不发挥关键作用。
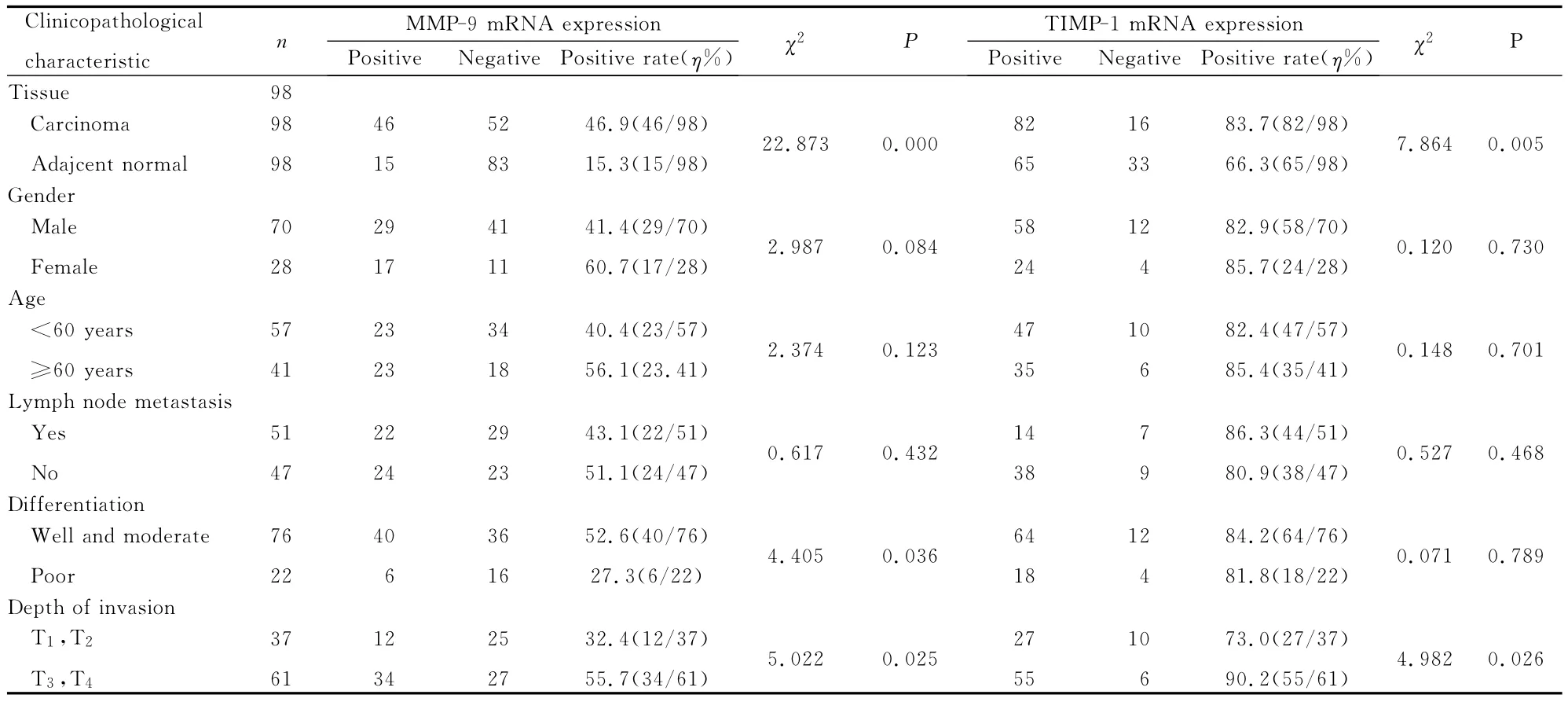
表2 食管癌组织中MMP-9和TIMP-1mRNA表达与临床病理特征的关联性分析结果Tab.2 Relationships between clinicopathological characteristics and expressions of MMP-9and TIMP-1mRNA in esophageal squamous cell carinoma tissue
表3 食管癌组织中MMP-9和TIMP-1mRNA表达的相关性Tab.3 Relationship between expressions of MMP-9and TIMP-1mRNA in esophageal carcinoma tissue(±s)

表3 食管癌组织中MMP-9和TIMP-1mRNA表达的相关性Tab.3 Relationship between expressions of MMP-9and TIMP-1mRNA in esophageal carcinoma tissue(±s)
r P Positive Negative Expression of MMP-9mRNA Expression of TIMP-1mRNA Positive Negative 43 39 3 132.524 0.013
TIMP 属 于 MMP 家 族,分 为 TIMP-1、TIMP-2、TIMP-3和TIMP-4。TIMP在蛋白水平对MMP发挥抑制作用,这种抑制作用是通过TIMP与MMP以1∶1结合成非共价复合物而实现的[13]。李秀梅等[14]应用 RT-PCR 法对哈萨克族人食管癌的研究发现:TIMP-1在哈萨克族人食管癌组织中的表达较正常组织增高,且TIMP-1表达与肿瘤浸润深度有关联。本研究结果亦显示:TIMP-1mRNA表达在食管癌组织中均明显高于癌旁组织,并且TIMP-1mRNA表达与肿瘤侵润深度有关联。本研究结果与上述研究结果一致,故认为TIMP-1在食管癌发生和浸润性生长过程中发挥了重要作用。陈其军等[5]应用免疫组织化学法对胃癌的研究发现:TIMP-1的表达与淋巴结转移无关联。雒洪志等[15]采用RT-PCR和免疫组织化学法对结肠癌的研究发现:TIMP-1表达与结肠癌淋巴结转移无关联。Zhang等[16]采用RT-PCR法对乳腺癌的研究发现:TIMP-1表达与乳腺癌的淋巴结转移无关联。Shim等[17]采用RT-PCR法对胃癌的研究发现:TIMP-1表达与胃癌淋巴结转移无关联。本研究结果显示:TIMP-1的表达与食管癌淋巴结转移无关联,与上述研究结果一致,故认为TIMP-1在食管癌淋巴结转移方面不发挥关键作用。
本研究结果显示:食管癌组织中 MMP-9与TIMP-1mRNA表达率呈正相关关系,说明TIMP-1mRNA的表达率随着 MMP-9mRNA表达的增强而升高,进而在蛋白水平发挥其对MMP-9的抑制作用,从而抑制肿瘤的浸润,降低肿瘤转移的几率,可能对机体自身产生保护作用。Brun等[18]对卵巢癌的研究也发现了TIMP-1的这种自身性保护作用。
综上所述,食管癌的发生发展不是由单一基因控制的反应过程。本研究结果显示:MMP-9 mRNA表达可能促进了食管鳞状细胞癌的发生,同时可能增强了食管鳞状细胞癌的浸润生长能力。TIMP-1mRNA可能作为自身保护机制之一,限制由于MMP-9mRNA过度表达而造成的肿瘤过度浸润生长。MMP-9和TIMP-1mRNA与食管癌淋巴结转移可能均无关联。MMP-9mRNA表达水平的上调可能是食管癌发病的机制之一,TIMP-1 mRNA表达水平的上调可能是抑制食管癌浸润生长的机制之一。对MMP-9和TIMP-1mRNA表达的联合检测可评价食管鳞状细胞癌的浸润生长程度,并为进一步阐明食管癌的发生、发展和转移提供实验依据。
[1]Crew KD,Neugut A.Epidemiology of upper gastrointestinal malignancies[J].Semin Oncol,2004,31(4):450-464.
[2]Pohn H, Welch HG. The role of overdiagnosis and reclassification in the marked increase of esophageal adenocarcinoma incidence [J].Natl Cancer Inst,2005,97(2):142-146.
[3]Gu ZD,Li JY,Li M,et al.Matrix metalloproteinases expression correlates with survival in patients with esophageal squamous cell carcinoma [J].Am J Gastroenterol,2005,100(8):1835-1843.
[4]董刚强,王永占,蒲 红,等.基质金属蛋白酶MMP-9在胃癌中的表达及其临床意义 [J].肿瘤预防与治疗,2012,25(4):240-242.
[5]陈其军,吕自力,党裔武,等.MMP-9和TIMP-1在胃癌组织中的表达失衡及其与ZHX2的相关性 [J].世界华人消化杂志,2012,20(20):1832-1837.
[6]郑海燕,王兴芬,潘彦珞,等.胃癌组织中MCP-1、MMP-9的表达与间质中TAMs浸润的关系 [J].临床肿瘤学杂志,2010,15(3):218-221.
[7]杨丽君,陈 钟.OPN和MMP-9在结直肠癌中的表达及其与肝转移的相关性 [J].当代医学,2012,18(12):7-9.
[8]李卫东,姚庆娟,刘 刚,等.结直肠癌VEGF和 MMP-9基因的表达 [J].中国肿瘤临床,2008,35(13):756-760.
[9]Koskensalo S,Hagström J,Linder N,et al.Lack of MMP-9expression is a marker for poor prognosis in Dukes’B colorectal cancer[J].BMC Clin Pathol,2012,12(7):12-24.
[10]Durlik M,Gardian K.Metalloproteinase 2and 9activity in the development of pancreatic cancer[J].Pol Przegl Chir,2012,84(8):377-382.
[11]Oshima T, Kunisaki C, Yoshihara K, et al.Clinicopathological significance of the gene expression of matrix metalloproteinases and reversion-inducing cysteine-rich protein with Kazal motifs in patients with colorectal cancer:MMP-2gene expression is a useful predictor of liver metastasis from colorectal cancer[J].Oncol Rep,2008,19(5):1285-1291.
[12]Lu CL,Ji Y,Ge D,et al.The expression of CXCR4and its relationship with matrix metalloproteinase-9/vascular endothelial growth factor in esophageal squamous cell cancer[J].Dis Esophagus,2011,24(4):283-290.
[13]Gomez DE,Alonso DF,Yoshiji H,et al.Tissue inhibitors of metalloproteinases:structure,regulation and biological functions[J].Eur J Cell Biol,1997,74(2):111-122.
[14]李秀梅,陈 艳,王洪江,等.哈萨克族食管癌中MMP-1、MMP-2、MMP-7、TIMP-1和 MTA1的表达及其临床病理意义 [J].癌变·畸变·突变,2011,23(3):190-193,198.
[15]雒洪志,黄宗海,余元龙,等.MMP-9和TIMP-1在结肠癌组织中的表达及其临床意义 [J].临床肿瘤学杂志,2012,17(8):712-716.
[16]Zhang M,Teng XD,Guo XX,et al.Expression of tissue levels of matrix metalloproteinases and their inhibitors in breast cancer[J].Breast,2012,9(17):201-203.
[17]Shim KN,Jung SA,Joo YH,et al.Clinical significance of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric cancer[J].J Gastroenterol,2007,42(2):120-128.
[18]Brun JL,Cortez A,Commo F,et al.Serous and mucinous ovarian tumors express different profiles of MMP-2,7,9,MTA1,TIMP-1and -2 [J].Oncology,2008,33(6):1239-1246.

