阿托伐他汀预处理对大鼠心肌缺血再灌注后不同时间点心肌组织中HIF-α和VEGF表达的影响
石 博,黄可欣,叶保国,张 艳,黄可敬
(1.吉林大学白求恩医学院形态学中心,吉林 长春 130021;2.吉林大学第一医院麻醉科,吉林 长春 130021;3.内蒙古自治区民族大学附属医院儿科,内蒙古 通辽028007;4.吉林省长春市中心血站检验科,吉林 长春 130033)
随着临床上经皮冠状动脉介入、冠状动脉搭桥和溶栓治疗的广泛应用,心肌缺血再灌注(myocardial ischemia reperfusion,I/R)损伤已经成为阻碍缺血心肌从再灌注疗法中获得最佳疗效的主要难题[1]。I/R损伤可以诱导心肌细胞凋亡,增加心肌梗死面积,从而解释了急性心肌梗死患者在进行有效的心肌再灌注之后病死率仍高达10%的原因[2]。缺 氧 诱 导 因 子 α(hypoxia inducible factorα,HIF-α)作为缺氧转录反应的主要转录因子,参与细胞对缺氧微环境的适应性反应,在细胞缺氧后的调节中起核心作用。HIF-α在非低氧细胞中几乎不表达,在缺氧条件下表达明显增加,且HIF-α可通过调控血管内皮生长因子(vascular endothelial growth factor,VEGF)的表达影响局部氧供应和侧支循环的建立,在I/R损伤中发挥着重要的调节作用[3]。研究[4]证实:他汀类药物在心血管保护方面具有多效性,有许多独立于降脂外的作用,这些非降脂作用包括抗氧化、改善血管内皮功能、降低血管炎症反应、抑制平滑肌增殖和免疫调节等。但阿托伐他汀预处理(atorvastatin pretreatment,AT)对I/R损伤大鼠心肌组织HIF-α和VEGF的影响国内外尚未见报道。本实验旨在通过观察I/R损伤大鼠心肌组织HIF-α和VEGF的表达,研究AT对I/R大鼠心肌的早期保护作用。
1 材料与方法
1.1 实验动物、主要试剂和仪器 健康雄性Wistar大鼠50只,体质量(240±10)g,由吉林大学白求恩医学部动物实验中心提供(动物许可证号:SCXK2007-吉大-0003);阿托伐他汀由大连辉瑞制药有限公司提供,实验用阿托伐他汀用生理盐水稀释,Trizol、RNA提取试剂盒、反转录试剂和dNTP购于北京鼎国生物有限公司,石蜡切片机、捞片机、兔抗鼠HIF-α多克隆抗体和兔抗鼠VEGF多克隆抗体由北京博奥森生物技术有限公司提供,SP9710检测试剂盒及DAB显色试剂盒由福州迈新生物有限公司提供;实时荧光定量PCR仪购于美国MJ Research公司,包埋机购于德国Laica公司。
1.2 动物分组及造模前准备 50只大鼠适应性喂养1周后,随机分为假手术组 [仅穿线不结扎左冠状动脉前降支(LAD)]、缺血30min再灌注2h模型组(I30minR2h组,于结扎LAD前30min右颈静脉注射等容量生理盐水,结扎30min后松扎,再灌注2h);缺血30min再灌注6h模型组(I30minR6h组,于结扎LAD前30min右颈静脉注射等容量生理盐水,结扎30min后松扎,再灌注6h);缺血 30min 再 灌 注 2hAT 组(I30minR2hAT组,10mg·kg-1,于结扎 LAD 前30min于右颈静脉注射AT 10mg·kg-1,结扎30min后松扎,再灌注2h);缺血30min再灌注6hAT组(I30minR6hAT组,10mg·kg-1,于结扎LAD前30min于右颈静脉注射AT 10mg·kg-1,结扎30min后松扎,再灌注6h)。
1.3 造模方法 采用利多卡因腹腔麻醉后,将大鼠固定于解剖台,颈部消毒,行颈前正中切口暴露气管,经口腔用8号灌胃针头进行气管插管并接动物呼吸机(呼吸频率60~80次·min-1,潮气量7~9mL)。用脱毛膏脱去大鼠胸毛,碘伏消毒。于左侧第3或第4肋间打开胸腔,轻压将心脏挤出胸腔,剪开心包,以冠状动脉主干为标志,左心耳根部下方2mm处,在LAD面放置一小硅胶管连同冠脉用无创伤缝合线一起结扎,造成左心室室壁缺血。迅速将心脏送回胸腔,医用缝合线的两端留置体外备用。用长嘴止血钳将胸部皮肤和肌肉和心脏挂线夹紧,防止发生气胸。30min后,放松挂线,抽出硅胶管,形成再灌注模型。造模结束时,逐层缝合肌肉、皮肤,切口处注入少许青霉素注射液,再次碘伏消毒,预防感染。
1.4 各组大鼠心肌梗死面积比检测 大鼠心肌缺血再灌注120min后,每组取10只大鼠,摘取心脏,行2,3,5-氯化三苯基四氮唑(TTC)染色,明确未梗死与梗死心肌。未梗死区呈红色,梗死区染呈白色,采用Motic Images Advanced 3.2图像分析软件测量。心肌梗死面积比=(梗死区心肌面积/整个心肌面积)×100%。
1.5 各组大鼠心肌组织HIF-α和VEGF蛋白表达水平的检测 各组均处死10只大鼠,取大鼠心肌组织,石蜡包埋,切片4μm,采用SP免疫组织化学染色法,根据试剂盒说明检测大鼠心肌组织HIF-α和 VEGF蛋白的表达水平,采用 Motic
Images Advanced 3.2图像分析软件 测得大鼠心肌组织HIF-α和VEGF蛋白的灰度值,灰度值越低其阳性表达水平越高,灰度值越高其阳性表达水平越低。
1.6 各组大鼠心肌组织 HIF-α和VEGF mRNA水平的检测 采用Trizol提取每组10只大鼠心肌组织总RNA,反转录后行实时荧光定量PCR检测HIF-α和VEGF mRNA水平;内参:上游引物,5′-GTAACCCGTTGAACCCCATT-3′,下游引物,5′-CCATCCAATCGGTAGTAGCG-3′; HIF-α:上 游 引 物,5′-ACTGATTGCATCTCCACCTTCT-3′, 下 游 引 物,5′-TCGCTTCCTCTGAGCATTCT-3′;VEGF : 上 游 引 物,5′-TGCACCCACGACAGAAGGG-3′,下游引物,5′-TCACCGCCTTGGCTTGTCACAT-3′,凝胶成像后用凝胶图像分析系统分析结果。
1.7 统计学分析 采用SPSS 13.0软件进行统计分析。HIF-α和 VEGF蛋白表达灰度值、HIF-α和VEGF mRNA表达水平以±s表示,组间比较采用t检验。
2 结 果
2.1 各组大鼠心肌梗死面积比 与假手术组(10.19%±1.03%)比较,I30minR2h组和I30minR6h组大鼠的心肌梗死面积比(81.51%±6.18%和82.73%±6.95%)明显增大(P<0.001);与I30minR2h组 和 I30minR6h组(81.51% ±6.18% 和82.73%±6.95%)比较,I30minR2hAT组和I30minR6hAT组大鼠的心肌梗死面积比(16.09%±1.73%和18.91%±2.08%)明显减小(P<0.01);而I30minR2hAT组与I30minR6hAT组之间大鼠心肌梗死面积比差异无统计学意义(P>0.05)。
2.2 各组大鼠心肌组织HIF-α和VEGF蛋白的表达水平 与假手术组比较,I30minR2h组 、I30minR6h组、I30minR2hAT组和I30minR6hAT组大鼠心肌组织HIF-α和VEGF蛋白的阳性表达水平均显著升高,差异有统计学意义(P<0.01);且I30minR6h组低于I30minR2h组,I30minR6hAT组低于I30minR2hAT组,差异均有统计学意义(P<0.01);与I30minR2h组比较,I30minR2hAT组大鼠HIF-α和VEGF蛋白阳性表达水平均升高(P<0.01);与I30minR6h组比较,I30minR6hAT组大鼠HIF-α和VEGF蛋白阳性表达水平均显著升高(P<0.01)。见表1、图1(插页二)和2(插页三)。
2.3 各组大鼠心肌组织 HIF-α和VEGF mRNA水平 与假手术组比较,I30minR2h组 、I30minR6h组、I30minR2hAT组和I30minR6hAT组 HIF-1和VEGF mRNA表达水平均显著升高(P<0.01);且I30minR6h组HIF-1和VEGF mRNA表达水平低于I30minR2h组,I30minR6hAT组 HIF-1和VEGF mRNA表达水平低于I30minR2hAT组(P<0.01);与I30min R2h组比较,I30minR2hAT组 HIF-1和VEGF mRNA表达水平均显著升高(P<0.01);与I30minR6h组比较,I30minR6hAT组HIF-1和VEGF mRNA表达水平均显著升高(P<0.01)。见表2、图3和4。
表1 各组大鼠心肌组织中HIF-α和VEGF蛋白表达水平Tab.1 Expression levels of HIF-αand VEGF protein in myocardium tissue of rats in various groups(n=10,±s)

表1 各组大鼠心肌组织中HIF-α和VEGF蛋白表达水平Tab.1 Expression levels of HIF-αand VEGF protein in myocardium tissue of rats in various groups(n=10,±s)
* P<0.01compared with sham operation group;△P<0.01 compared with I30minR2hgroup;# P<0.01compared with I30minR6hgroup.
Group Gray value of HIF-α Gray eration 174.53±7.26 175.31±6.93 I30minR2h 130.17±5.24* 132.12±4.67*I30minR6h 145.17±4.91*△ 150.22±5.01*△I30minR2hAT 100.24±3.78*△ 102.16±4.32*△I30minR6hAT 124.17±5.65*# 128.43±4.79*value of VEGF Sham op#
表2 各组大鼠心肌组织中HIF-α和VEGF mRNA表达水平Tab.2 Expression levels of HIF-αand VEGF mRNA in myocardium tissue of rats in various groups(n=10,±s)
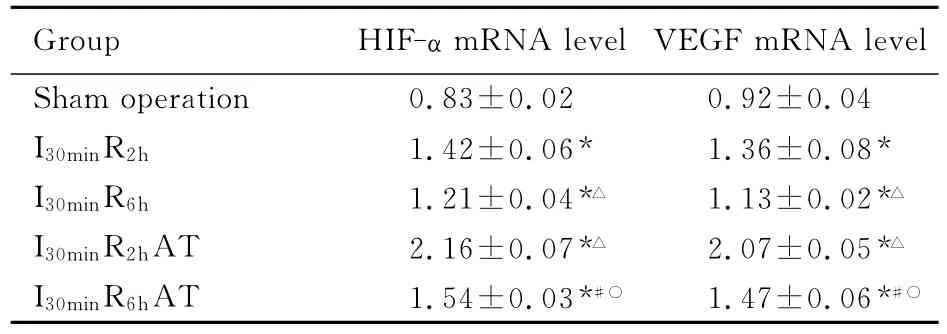
表2 各组大鼠心肌组织中HIF-α和VEGF mRNA表达水平Tab.2 Expression levels of HIF-αand VEGF mRNA in myocardium tissue of rats in various groups(n=10,±s)
* P<0.01compared with sham operation group;△P<0.01 compared with I30minR2hgroup;# P <0.01compared with I30minR6hgroup;○P<0.01compared with I30minR2hAT group.
Group HIF-α eration 0.83±0.02 0.92±0.04 I30minR2h 1.42±0.06* 1.36±0.08*I30minR6h 1.21±0.04*△ 1.13±0.02*△I30minR2hAT 2.16±0.07*△ 2.07±0.05*△I30minR6hAT 1.54±0.03*#○ 1.47±0.06*#○mRNA level VEGF mRNA level Sham op
3 讨 论
I/R损伤的心功能障碍有4种类型:无复流现象、心肌顿抑、致死性再灌注损伤和再灌注心律失常。I/R损伤的发生可能与氧自由基、钙超载和炎症反应等 因素有 关[5-6]。近年 来大量 研究[7-8]显 示:I/R损伤会进一步加大心肌缺血,心功能障碍程度比急性心肌梗死严重,病死率更高,I/R不可避免地导致心肌损伤,发生心肌缺血和梗死。
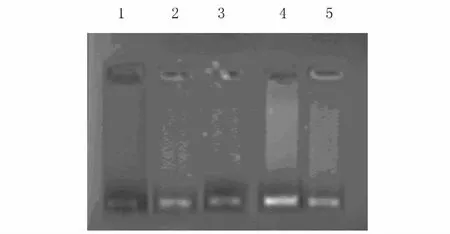
图3 RT-PCR法检测各组大鼠心肌组织中 HIF-αmRNA表达电泳图Fig.3 Electrophoregram of expressions of HIF-αmRNA in myocardium tissue of rats in various groups detected by RTPCR method

图4 RT-PCR法检测各组大鼠心肌组织中VEGF mRNA表达电泳图Fig.4 Electrophoregram of expressions of VEGF mRNA in myocardium tissue of rats in various groups detected by RTPCR method
HIF-α是在心肌氧平衡中起关键作用的转录因子,其可以通过调节多种靶基因的表达介导细胞缺氧反应,从而保护组织免受缺血损伤。在正常情况下,HIF-α合成后通过泛素-蛋白酶体途径很快降解[9]。缺氧时 HIF-α的泛素化水平急剧减少,翻译后修饰减弱,从而使HIF-α的蛋白稳定性和转录激活能力上调,由于其降解被抑制,使HIF-α在胞浆中积聚,并从胞浆转位至胞核,进而与其靶基因增强子中的特异序列结合,增强该基因的表达[11]。研究[12]显示:在缺氧条件下,机体可以通过上调HIF-α的表达诱导体内一些血管活性物质VEGF的表达,从而使机体适应缺氧环境。VEGF是HIF-α的下游因子,是血管生成初期的关键性生长因子,VEGF可以通过增加侧支循环改善再灌注损伤[13]。以往研究[3,11]表 明:在大鼠I/R 损 伤的早期,缺血心肌组织中 HIF-α、VEGF蛋白和mRNA可以被诱导表达,提示在再灌注早期,HIF-α和VEGF表达的增加是对I/R损伤的早期应答,这种应答反应可理解为心肌细胞对心肌缺血早期的多种适应性改变之一,是对急性心肌损伤的一种有益保护。HIF-α是引发各种缺氧应激蛋白表达的转录因子,在缺血的适应性反应中起核心作用,可以通过促进下游相关基因VEGF的转录和表达,增加缺血心肌新生血管的生成,从而使机体对缺血、缺氧产生代偿性适应反应[14-17]。本研究结果显示:I30minR2hAT组大鼠HIF-α、VEGF蛋白和mRNA的表达高于I30minR2h组,I30minR6hAT组大鼠HIF-α、VEGF蛋白和mRNA的表达高于I30minR6h组,提示AT能进一步提高HIF-α、VEGF蛋白和mRNA的表达。
综上所述,AT能够通过上调HIF-α、VEGF蛋白和mRNA表达对早期I/R大鼠心肌组织起到保护作用。
[1]Yellon DM, Hausenloy DJ. Myocardial reperfusion injury [J].N Engl J Med,2007,357(11):1121-1135.
[2]Ostadal B.The past,the present and the future of experimental research on myocardial ischemia and protection [J].Pharmacol Rep,2009,61(1):3-12.
[3]吴冬鸣,唐 燕,韩 艺,等.大鼠心肌缺血再灌注后不同时间点心脏及肝脏中 HIF-1、VEGF的表达 [J].南京医科大学学报:自然科学版,2012,32(8):1047-1051.
[4]孟 红,张英杰.阿托伐他汀对大鼠缺血再灌注心肌细胞凋亡的影响 [J].中国全科医学,2009,12(3):465-468.
[5]车忠应,陈还珍.辛伐他汀预处理对大鼠心肌缺血再灌注损伤Bcl-2和Bax表达的影响 [J].中国医疗前沿,2011,6(2):26-28.
[6]邵 莹,吴启南,周 倩,等.淡竹叶黄酮对大鼠心肌缺血/再灌注损伤的保护作用 [J].中国药理学通报,2013,29(2):241-247.
[7]Qin F,Liu YX,Zhao HW,et al.Chinese medicinal formula Guan-Xin-Er-Hao protects the heart against oxidative stress induced by acute ischemic myocardial injury in rats [J].Phytomedicine,2009,16(2/3):215-221.
[8]Zalewski J,Nessler J.The endogenous cardioprotection during reperfusion in acute myocardialinfarction [J].Kardiol Pol,2011,69(Suppl 3):67-74.
[9]Xie L,Liu Z,Ji Y,et al.Pyridoxine inhibits uncoupled endothelial NOS uncoupling induced by oxidized lowdensity lipoprotein via the PKCαsignaling pathway in human umbilical vein endothelial cells [J].Br J Pharmacol,2012,165(3):754-764.
[10]Knudsen AR,Kannerup AS,Mortensen FV,et al.Effects of ischemic pre-and postconditioning on HIF-1α,VEGF and TGF-βexpression after warm ischemia and reperfusion in the rat liver[J].Comp Hepatol,2011,10(1):3-9.
[11]范新明,周 鸣,彭建强,等.HIF在心肌缺血再灌注中的作用 [J].现代生物医学展,2011,11(20):3994-3996.
[12]Zhao HX,Wang XL,Wang YH,et al.Attenuation of myocardial injury by postconditioning:role of hypoxia inducible factor-1α [J].Basic Res Cardiol,2010,105(1):109-118.
[13]孙晓峰,所 剑,王 琦,等.HIF-1α与VEGF在动脉粥样硬化闭塞症患者缺血下肢血管及及组织中的表达及意义 [J].吉林大学学报:医学版,2009,35(2):337-340.
[14]Li H,Liu F,Lou YL,et al.The expression level of HIF after renal ischemia-reperfusion injury in mice [J].Exp Lab Med,2011,29(1):6-8.
[15]Ndubuizu OI,Tsipis CP,Li A,et al.Hypoxia-inducible factor-1(HIF-1)independent microvas-cular angiogenesis in the aged rat brain [J].Brain Res,2010,1366(34):101-109.
[16]王 阳,米树华,贾淑杰.心肌缺血再灌注损伤药物研究现状及进展 [J].中国实用内科杂志,2012,32(12):958-960.
[17]孙兴国.运动心肺功能鉴别心源性呼吸困难 [J].中国实用内科杂志,2013,33(suppl 1):12-13.

