厄贝沙坦对病毒性心肌炎慢性期小鼠心肌组织中periostin表达的影响及其抗心肌纤维化作用机制
吴 岚,张春艳,孙景辉,宋丽君
(吉林大学第一医院儿科,吉林 长春 130021)
病毒性心肌炎(viral myocarditis,VMC)是小儿心血管系统常见病,病情轻重不一,心肌纤维化贯穿VMC病程始终,VMC部分可发展为扩张性心肌病[1],严重威胁儿童身体健康。目前公认肾素-血管紧张素系统的激活是VMC心肌纤维化的重要机制。periostin是近年来发现的一种细胞外基质蛋白,作为血管紧张素Ⅱ(AngⅡ)下游因子参与多种心血管疾病病理过程[2-3],在心肌纤维化、心室顺应性下降和心脏重构过程中,periostin表达水平均增高[4]。厄贝沙坦为近年来临床常用的AngⅡ受体拮抗剂,有研究[5]表明:厄贝沙坦可减轻心肌梗死和高血压所致的心肌纤维化及心室重塑,但关于VMC的抗纤维化作用及其机制的相关报道。国内外尚少见。本研究旨在探讨VMC慢性期厄贝沙坦抗心肌纤维化的作用及其对心肌periostin表达的影响,探讨其可能机制,为临床用药提供一定实验依据。
1 材料与方法
1.1 实验动物、主要试剂及仪器 4周龄雄性纯种近系BALA/c小鼠50只,饲养于清洁级环境中,体质量(18±1)g,由吉林大学实验动物中心提供,实验动物许可证号:SCXK(吉)2009-0032,随机分为对照组10只,VMC模型组40只;AngⅡELISA试剂盒(北京博奥森生物技术有限公司),Trizol试剂盒(美国Invitrogen公司),引物合成由上海生工生物工程公司完成,厄倍沙坦(irbesartan,商品名这安博维,0.15g/片,杭州赛诺菲圣德拉堡民生制药有限公司);Vivid 7超声仪(美国GE公司)。
1.2 VMC模型的建立 VMC模型建立采用腹腔接种柯萨奇病毒B3(CoxsackievirusB3,CVB3)方法。CVB3(Nancy株)由吉林大学白求恩医学部免疫学教研室惠赠。病毒液组织培养半数感染量为100TCID50/0.1mL。VMC模型组小鼠腹腔无菌接种100TCID50/0.1mL的CVB3病毒稀释液0.1mL,每个月1次,共3次,每次病毒量递增0.05mL。第3个月末共死亡13只小鼠,对第3个月末仍存活的小鼠进行心脏超声检测。随机抽取6只,进行心肌组织HE染色病理学检测发现:炎症细胞数明显减少,坏死心肌细胞由纤维组织代替,心肌组织可见弥漫性胶原明显增多,符合慢性病毒性心肌炎心肌纤维化小鼠的特点,与相关报道[6]一致,表明VMC慢性期心肌纤维化模型成功建立。对照组小鼠同期腹腔注射等体积不含病毒的Eagle’s液,对照组小鼠无一死亡。将21只剩余VMC模型小鼠随机分为模型组(n=11)和厄贝沙坦组(n=10)。模型组小鼠每日1mL自来水灌胃1次;厄贝沙坦组小鼠给予厄倍沙坦50mg·kg-1·d-1,每日药物溶于1mL自来水中灌胃1次,共持续60d。对照组小鼠同期每日给予1mL自来水灌胃1次,共60d。小鼠用药量根据人和动物间按体表面积折算的等效剂量比值表[7]计算。
1.3 标本采集 待观察时间到达终点,先将存活小鼠行心脏超声,随后摘眼球取血,分离出血清于-70℃冻存备用;开胸取心脏组织分为2部分,分别于10%中性甲醛PBS溶液中固定以及液氮冻存后转入-70℃冰箱。
1.4 小鼠心脏超声检查 采用Vidid7超声诊断仪和I13L型号小动物超声探头(14MHz)由心脏超声测得左室收缩末内径(ventricular end-diastolic dimension,LVEDd)和左室舒张末内径(left ventricular end-systolic dimension ,LVEDs),并计算左室射血分数缩短率(left ventricular fractional shortening,FS)。
1.5 小鼠心肌胶原纤维Masson染色及心肌胶原容积分数(CVF)测定 留取的心肌组织切片脱蜡后水化;先后苏木素染,丽春红酸性品红液中染;1%磷铝酸中染,滴加苯胺蓝液后烘干,二甲苯透明树胶封片。阳性结果判定标准:胶原纤维呈蓝色,胞核呈蓝色,胞浆呈红色。采用医学图像分析软件image-pro plus 6.0,在盲法下,每张切片选择5个视野,测量胶原纤维染色阳性面积。CVF=胶原面积/全视野面积×100%,并计算平均值。
1.6 小鼠血清AngⅡ浓度测定 采用ELISA法测定小鼠血清AngⅡ的浓度,按试剂盒说明书操作。
1.7 小鼠心肌组织中periostin mRNA和TGF-β1 mRNA的检测 Trizol试剂提取小鼠心肌组织总RNA,使用逆转录酶将总RNA合成cDNA。取3μL逆转录产物,进行PCR扩增。反应参数为:94℃、5min,95℃、40s,55℃、30s,72℃、45s,循环30次,最后72℃延伸10min。扩增产物在1.5%琼脂糖凝胶电泳,在紫外灯下拍照。光密度灰度扫描后图片经Image J软件进行分析。结果以检测蛋白/β-actin的电泳条带光密度比值作为检测蛋白mRNA的相对表达量。TGF-β1mRNA(或)periostin mRNA 的相对表达量= TGF-β1(或)periostin产物电泳条带光密度/β-actin的产物电泳条带光密度。引物序列见表1。1.8 统计学分析 应用SPSS13.0统计软件进行数据分析。LVEDd、LVEDs、FS、CVF、血清AngⅡ浓度、心肌组织中periostin mRNA及TGF-β1mRNA 相对表达量以±s表示,多组均数比较采用方差分析,两组间比较采用q检验(Newman-Keuls法);各组小鼠死亡率组间比较采用卡方检验。

表1 periostin、TGF-β1和β-actin引物序列Tab.1 Primer sequences of periostin,TGF-β1,andβ-actin
2 结 果
2.1 3组小鼠的一般状况和死亡率 造模成功的40只小鼠首次注射病毒后第3天开始陆续出现毛色灰暗、稀便、懒动,进食减少,对刺激反应减退;症状逐渐加重,第1个月死亡7只小鼠;2次注射病毒后,小鼠再次出现上述症状,但较前一次程度减轻,且死亡数减少,第2月死亡4只小鼠;第3个月死亡2只小鼠。第3个月末,与对照组比较,模型组小鼠毛色灰暗松散、粗糙、懒动,行动迟缓,进食少,对刺激反应弱。对照组小鼠动作灵敏,毛色发亮,反应灵活,食欲正常,体质量增加,无一例死亡。自采用厄贝沙坦开始干预至60d结束,模型组11只小鼠死亡3只(死亡率为27.2%),厄贝沙坦组10只小鼠死亡2只(死亡率为20.0%)。药物干预治疗后小鼠死亡率下降,但差异无统计学意义(χ2=3.125,P>0.05)。
2.2 3组小鼠LVEDd、LVEDs和FS 3组小鼠LVEDd、LVEDs和FS比较差异均有统计学意义(P<0.01)。与对照组比较,模型组小鼠LVEDd和LVEDs明显升高,而FS明显下降;与模型组比较,厄贝沙坦组小鼠LVEDd和LVEDs下降,而FS则升高,差异有统计学意义(q=3.91,8.22,3.49,P<0.05)。见表2。
2.3 3组小鼠心肌胶原纤维Masson染色和CVF
经Masson染色后,小鼠正常心肌组织呈橘红色,胶原纤维呈蓝色。对照组小鼠可见心肌细胞规整,其间散在少量蓝色胶原纤维。模型组小鼠可见坏死心肌细胞,在坏死灶周围有大量蓝色胶原纤维。厄贝沙坦组小鼠心肌组织可见蓝色胶原,较模型组减少,心肌细胞形态排列亦见规整。3组小鼠心肌CVF差异有统计学意义(P<0.01)。与对照组比较,模型组小鼠的CVF水平明显升高(P<0.01)。与模型组比较,厄贝沙坦组小鼠CVF水平下降(P<0.01)。见表2。
2.4 3组小鼠血清AngⅡ浓度 与对照组比较,模型组和厄倍沙坦组小鼠血清AngⅡ浓度明显增加(P<0.01);厄倍沙坦组与模型组AngⅡ水平相近,差异无统计学意义(P>0.05)。见表2。
2.5 3 组 小 鼠 心 肌 periostin mRNA 和 TGF-β1 mRNA表达水平 与对照组比较,模型组小鼠periostin mRNA和TGF-β1mRNA表达水平明显增高,差异有统计学意义(P<0.01)。与模型组比较,厄倍沙坦组小鼠periostin mRNA和TGF-β1mRNA表达水平明显降低(P<0.01)。见表3、图1和2。
表2 3组小鼠LVEDd、LVEDS、FS、CVF和血清AngⅡ浓度Tab.2 LVEDd,LVEDS,FS,CVF,and concentration of AngⅡ of mice in three groups (±s)

表2 3组小鼠LVEDd、LVEDS、FS、CVF和血清AngⅡ浓度Tab.2 LVEDd,LVEDS,FS,CVF,and concentration of AngⅡ of mice in three groups (±s)
* P<0.01 vs control group;△P<0.05 vs model group.
8±0.61 312.76±141.30 Model 8 4.08±0.63* 2.64±0.29* 35.2±5.24* 5.07±0.98* 1096.46±288.50*Irbesartan 8 3.44±0.42△ 1.97±0.24*△ 41.0±3.97*△ 3.45±0.84*△ 1236.83±334.70*F 7.700 47.330 26.940 32.550 33.950 P)]Control 10 3.24±0.32 1.58±0.16 51.6±4.78 1.9 Group n LVEDd(l/mm) LVEDs(l/mm) FS(η/%) CVF(η/%) AngⅡ[ρB/(ng·L-1 0.003 0.000 0.000 0.000 0.000
表3 3组小鼠心肌组织periostin mRNA和TGF-β1mRNA相对表达量Tab.3 Relative expression quantities of periostin mRNA and TGF-β1mRNA in myocardium tissues of mice in three groups (±s)
表3 3组小鼠心肌组织periostin mRNA和TGF-β1mRNA相对表达量Tab.3 Relative expression quantities of periostin mRNA and TGF-β1mRNA in myocardium tissues of mice in three groups (±s)
* P<0.01 vs control group;△P<0.05 vs model group.
Group n Periostin/β-actin TGF-β1/β-actin Control 10 0.09±0.075 0.164±0.024 Model 8 0.653±0.143* 0.805±0.057*Irbesartan 8 0.486±0.096*△ 0.569±0.074*△F 64.610 78.790 P 0.000 0.000
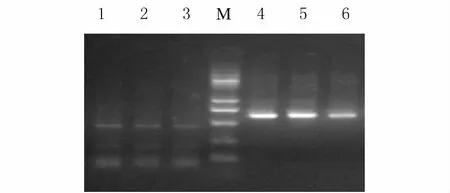
图1 3组小鼠心肌组织中periostin mRNA的RT-PCR产物电泳图Fig.1 Electrophoregram of RT-PCR products of periostin mRNA in myocardium tissues of mice in three groups
3 讨 论

图2 3组小鼠心肌组织中TGF-β1mRNA的RT-PCR产物电泳图Fig.2 Electrophoregram of RT-PCR products of TGF-β mRNA in myocardium tissues of mice in three groups
心肌纤维化贯穿VMC各期,慢性期反应性纤维化是心脏扩大和心功能恶化的重要原因,此时干预治疗对纠正心功能和改善预后有重要意义。本研究发现:模型组小鼠心肌Masson染色胶原纤维明显增多,尤其在坏死灶周围增多明显,CVF明显高于对照组,存在明显心肌纤维化。同时心脏超声提示:LVEDd和LVEDs增大,心脏扩大;FS变小,心功能下降;符合慢性期病毒性心肌炎小鼠的病理特点和心功能改变。给予厄贝沙坦干预后小鼠心肌胶原增生程度减轻,同时心功能有恢复,提示在VMC慢性期应用厄贝沙坦有减轻心肌纤维化和改善心功能的作用。
periostin[8]是 从 小 鼠 成 骨 细 胞 系 MC3T3-E1cDNA文库中克隆出的一种具有调节成骨细胞分化和黏附的功能骨黏附分子,属于细胞外基质蛋白家族。近年来研究[9-11]发现:在纤维化条件下,periostin在多种脏器均可过表达,如肾间质纤维化、气道纤维化和肺纤维化等。在心脏中,periostin主要由心肌成纤维细胞表达,并由心肌成纤维细胞直接分泌[12]。在心脏中,periostin通过与其他细胞外基质蛋白结合,参与调节心脏基质结构的完整性,并维持相应的信号传导通路[4]。periostin可以促进胶原纤维的形成,影响胶原纤维的成熟度和融合[13]。periostin影响心脏表型的另一种机制是通过与整联蛋白αvβ3、αvβ5和 α4β6结合,将细胞外信号向细胞内传递,进而引起细胞的迁移黏附和细胞形态的转化[14]。研究[3]表明:periostin在多种心血管疾病进展中过度表达,并且发挥着重要作用,在VMC中,periostin与心肌纤维化程度密切相关,并且与TGF-β1表达呈正相关关系,可能是致心肌纤维化重要因子之一。本研究结果显示:模型组小鼠心肌periostin表达水平显著升高,心肌纤维化明显,心功能指标下降,给予厄贝沙坦干预后,periostin表达水平明显下降,心肌纤维化程度减轻,心功能指标有所恢复,由此推测VMC小鼠心肌纤维化与心功能改变与periostin的过表达有关,而厄贝沙坦可能通过抑制periostin的表达起到治疗作用。肾素-血管紧张素的激活是VMC心肌纤维化的重要机制,TGF-β1是AngⅡ下游重要的致纤维化因子[15],是诸多因素导致心肌纤维化最后的共同中介物之一。有研究[16]表明:肾素-血管紧张素的激活可以调节periostin的表达,外源性给予AngⅡ可促进大鼠心脏成纤维细胞表达periostin。且periostin与激活的TGF-β1密切相关,对心肌成纤维细胞外源性给予TGF-β1后periostin的表达水平上调;相反,在应用TGF-β1中和性抗体或TGF-β1受体阻断剂时,periostin的表达水平下降[17-18],仅 TGF-β1本身增加并不出现胶原增多和心肌纤维化,只有导致periostin蛋白水平上调后才会出现心肌纤维化的表现[17]。本研究结果表明:与对照组比较,模型组小鼠血清AngⅡ浓度和心肌TGF-β1表达水平明显升高,故心肌periostin的表达水平升高,考虑与之相关。与模型组比较,厄贝沙坦组小鼠血清AngⅡ浓度升高,但心肌TGF-β1及periostin表达水平明显减少,由此推测periostin作为AngⅡ-TGF-β1信号途径的下游因子在心肌纤维化中起作用,AngⅡ浓度升高可能机制为厄贝沙坦作为AngⅡ受体(AT1)选择性拮抗作用导致了AngⅡ浓度反馈性升高。厄贝沙坦拮抗了AngⅡ的作用,导致其下游因子TGF-β1在心肌表达减少,进而periostin作为TGF-β1的下游因子,表达也减少,periostin的缺失影响了其促纤维化作用及胶原纤维的成熟度和融合,心肌纤维化程度减轻,心功能得到改善。
综上所述,本研究发现:periostin作为一种重要的致纤维化因子,参与了VMC慢性期小鼠心肌纤维化过程,给予厄贝沙坦后,心肌TGF-β1和periostin的表达水平减少,CVF下降,心肌纤维化程度减轻,心功能改善,因此厄贝沙坦具有抗VMC心肌纤维化的作用,其可以减少TGF-β1表达,进而减少periostin的表达。本研究结果为临床用药提供了新的意见,同时本文作者认为periostin可能成为治疗VCM心肌纤维化的新靶点。
[1]李 乐,张彩玲.病毒性心肌炎心肌纤维化机制的研究进展 [J].亚太传统医药,2009,5(1):137-140.
[2]余 炜,林海燕,林运灵,等.Periostin与缺血性心脏病研究现状 [J].医学综述,2009,15(3):389-391.
[3]吴 岚,宋丽君,王朝霞,等.骨膜蛋白在实验性病毒性心肌炎小鼠的表达及意义 [J].临床儿科杂志,2011,29(7):661-664.
[4]Kudo A.Periostin in fibrillogenesis for tissue regeneration:periostin actions inside and outside the cell[J].Cell Mol Life Sci,2011,68(19):3201-3207.
[5]艾文伟,雷梦觉,涂燕平,等.厄贝沙坦对慢性心力衰竭和心肌纤维化的影响 [J].中国心血管病研究,2011,9(2):112-115.
[6]张召才,李双杰,杨英珍,等.黄芪甲甙对慢性心肌炎心肌纤维化的影响 [J].中国中西医结合杂志,2007,27(8):728-731.
[7]施新猷.现代医学实验动物学 [M],北京:人民军医出版社,2000:421.
[8]Takeshita S,Kikuno R,Tezuka K,et al.Osteoblast specific factor 2:cloning of a putative bone adhesion protein with homology with the insect protein fasciclin I [J].Biochem J,1993,294(Pt 1):271-278.
[9]卞保平,万 英,陈 蓉,等.梗阻性肾病大鼠肾组织periostin的表达及意义 [J].中华肾脏病杂志,2012,28(8):628-632.
[10]Sidhu SS,Yuan S,Innes AL,et al.Roles of epithelial cellderived periostin in TGF-beta activation,collagen production,and collagen gel elasticity in asthma [J].Proc Natl Acad Sci USA,2010,107(32):14170-14175.
[11]Naik PK,Bozyk PD,Bentley JK,et al.Periostin promotes fibrosis and predicts progression in patients with idiopathic pulmonary fibrosis [J].Am J Physiol Lung Cell Mol Physiol,2012,303(12):1046-1056.
[12]Shimazaki M,Nakamura K,Kii I,et al.Periostin is essential for cardiac healing after acute myocardial infarction[J].Exp Med,2008,205(2):295-303.
[13]Norris R,Damon B,Mironov V,et al.Periostin regulates collagen fibrillogenesis and the biomechanical properties of connective tissues[J].Cell Biochem,2007,101(3):695-711.
[14]Gillan L,Matei D,Fishman DA,et al.Periostin secreted by epithelial ovarian carcinoma is a ligand for alphaVbeta3and alphaVbeta5integrins and promotes cell motility [J].Cancer Res,2002,62(18):5358-5364.
[15]Chen P,Xie Y,Shen E,et al.Astragaloside IV attenuates myocardial fibrosis by inhibiting TGF-β1signaling in coxsackievirus B3-induced cardiomyopathy [J]. Eur J Pharmacol,2011,658(2/3):168-174.
[16]邹 平,吴 丹,吴市玲,等.AngⅡ促进成年大鼠心脏成纤维细胞periostin表达的信号通路研究 [J].现代预防医学杂志,201l,38(2):3265-3269.
[17]Snider P,Hinton RB,Moreno· Rodriguez RA,et al.Periostin is required for maturation and extracellular matrix stabilization of noncardiomyocytc lineages of the heart [J].Circ Res,2008,102(7):752-760.
[18]Chen YF,Feng JA,Li P,et al. Dominant negative mutation of the TGF-beta receptor blocks hypoxia-induced pulmonary vascular remodeling [J].Appl Physiol,2006,100(7):564-571.

