药用乳糖性质对低剂量片剂含量均匀度的影响
黄 晚,王晨晖,杞少鋆,姚 举,孙凤英
(吉林大学生命科学学院,吉林 长春 130012)
低剂量制剂一般指活性药物成分(API)占总体比重为2%(欧洲标准)或者1%(美国标准)[1]以下的药物制剂,适用于治疗窗狭窄、副作用在较高剂量时比较明显或者本身生物利用度较高的药物.目前已上市的低剂量制剂其剂型绝大多数为片剂,少数为硬胶囊.片剂的常规制备方法包括干法制粒(DG)、湿法制粒(WG)等,也可以通过选择适宜的辅料进行混合后直接压片(DC).片剂最重要的考察指标为含量均匀度(CU),对于API含量极少,每片绝大部分为辅料的低剂量片剂,获得合格的含量均匀度,无疑是对辅料、工艺及制备手段的挑战.目前已上市的低剂量片剂,处方复杂,制备工艺对机器和辅料要求很高,同时为了进一步改善低剂量片剂的含量均匀度,新型辅料的研发及设备的改良优化也在不断进行之中,检测手段亦推陈出新[2].喷雾干燥乳糖为新型的药用-水乳糖,通过喷雾干燥技术制得的球形乳糖颗粒,具有极好的流动性,目前已被推广用于直接压片和干法制粒,并特别指出适用于低剂量片剂的制备及控制片重.另一方面,常规应用于湿法制粒或干法制粒的研磨/过筛-水乳糖,其颗粒外形多为不规则块状,流动性较差.以往的研究表明,将喷雾干燥乳糖应用于手工湿法制粒压片与研磨/过筛乳糖相比,可以得到更好的含量均匀度,这一结果在大规模投料生产上已得到印证.本文使用本实验室自行合成的帕潘立酮衍生物——正戊立酮作为模型药物,针对喷雾干燥乳糖、研磨/过筛乳糖及其制备出的颗粒的粉体性质和最终成片的评价结果进行了研究和分析.
1 材料和方法
1.1 材料
1.1.1 药物和辅料
正戊立酮盐酸盐,本实验室合成;乳糖:MEGGLE FLOWLAC 100(M 100),MEGGLE GRANULAC 200(M 200)(德国 MEGGLE集团上海办事处惠赠);Foremost Spray Dried Lactose NF 316Fastflo(F 316),NF Lactose Monohydrate 314WG_GENERAL(F 314)(北京凤礼精求商贸有限责任公司惠赠);METHOCEL HPMC K100LV,K4M,K15M(上海卡乐康包衣技术有限公司惠赠).硬脂酸镁(辽宁奥达制药有限公司提供).
1.1.2 其他试剂
盐酸,磷酸氢二钠,磷酸二氢钠,磷酸钠,正辛醇,北京化工厂出品;色谱甲醇,Fisher SCI;无水乙醇,国药集团出品.
1.2 方法
1.2.1 干/湿颗粒压片
压片处方比例见表1.称量相应药物和辅料(药物和辅料均过细筛),使用三维混合运动仪(SYH-5,南京方鸥机械设备制造厂生产)混合辅料与药物.使用干法制粒机(GL2-25,开创机械生产)干法制粒;湿法制粒,使用搅拌机(JB-10L,江苏泰兴机械生产)及喷雾喷洒70%乙醇水溶液作为润湿剂制备软材,使用多功能湿颗粒机(Pharmag WG-30,德国)制备湿颗粒,45℃烘箱干燥.所得的干/湿颗粒混合1%硬脂酸镁进行压片(ZP-8旋转压片机,上海天祥健台制药机械有限公司生产).

表1 处方设计
1.2.2 粉体性质研究
使用激光粒度仪(L-13320mW,贝克曼库尔特,美国)测量粒径;使用粉末性能测试仪(PTG S4,PTTD200,Pharma-test,德国)测量松/紧密度、流动性和休止角;利用差式扫描量热仪(DSC 1,梅特勒-托利多公司,美国)研究药物和辅料的热稳定性质;利用SEM扫描电镜(JSM-6700F,日本电子株式会社)拍摄颗粒的微观表面形态.
1.2.3 正戊利酮体外分析方法的建立
体外分析方法如下:流动相为甲醇-水-三乙胺(V甲醇∶V水∶V三乙胺=80∶19.5∶0.5),冰醋酸调pH值至10.22.吸收波长为280nm,色谱柱:Luna C18(2)(4.6mm×150mm,孔径5μm,Phenomenex).流速1.0mL/min,柱温30℃.
1.2.4 药片相关性质检测
根据中国药典相关要求进行药片硬度、脆碎度的检查.含量均匀度检查方法如下:取制得的药片(n=10或n=39)投入含500mL去离子水的烧杯中,持续搅拌至药片完全溶解;取释放介质5mL过0.45μm滤膜,收集滤液,进行HPLC检测;根据标准曲线得出每片含药量,根据中国药典(2010版)关于含量均匀度检查法的相关描述进行检查.溶出曲线绘制方法为:将每批次药片(n=6)投入含500mL溶出介质为去离子水的溶出杯中,溶出条件为溶出法第二法,即浆法,50r/min,37℃.在给定的时间点(0.5,1,1.5,2,4,6,8h)通过取样针头取样5mL并回补5mL溶出介质.将取样液体过0.45μm 滤膜,取滤液进行HPLC检测.利用Origin软件处理相关数据,绘制溶出曲线.
2 结果和分析
2.1 粉体性质
分别使用Foremost和MEGGLE两种品牌的乳糖,混合HPMC和药物后所得到的混合物(DC)以及经制粒后所形成的干/湿颗粒(DG/WG)粉体性质差别很大(见表2).
M 100和F 316是喷雾干燥乳糖,可以应用于直接压片.与药物和HPMC进行混合后(M 100DC,F 316DC),其流动性优异.但是研磨/过筛-水乳糖M 200和F 314经过混合HPMC、药物所得到的混合物M 200DC和F 314DC因为流动性太差以至于未能得到检测数据.经过湿法制粒后,研磨/过筛乳糖湿颗粒(M 200WG,F 314WG)的流动性改善很多,但仍劣于喷雾干燥乳糖湿颗粒(M 100WG,F 316 WG).另一方面,经干法制粒后,研磨/过筛乳糖干颗粒的流动性为可接受/好,与之前的混合物相比有所改善.至于喷雾干燥乳糖干颗粒(M 100DG,F 316DG),对比两者的100g下落时间及相似的休止角,可以发现M 100DG的流动性变化不大,具有自发流动的性质,F 316DG则更倾向于在外力作用下进行流动,因此所花费的下落时间更多.其原因可能为这两种喷雾干燥乳糖的粒径分布虽然均处于100μm范围内,但其实际粒径分布则有所差别,M 100具有更多小颗粒分布于<32μm的范围内.
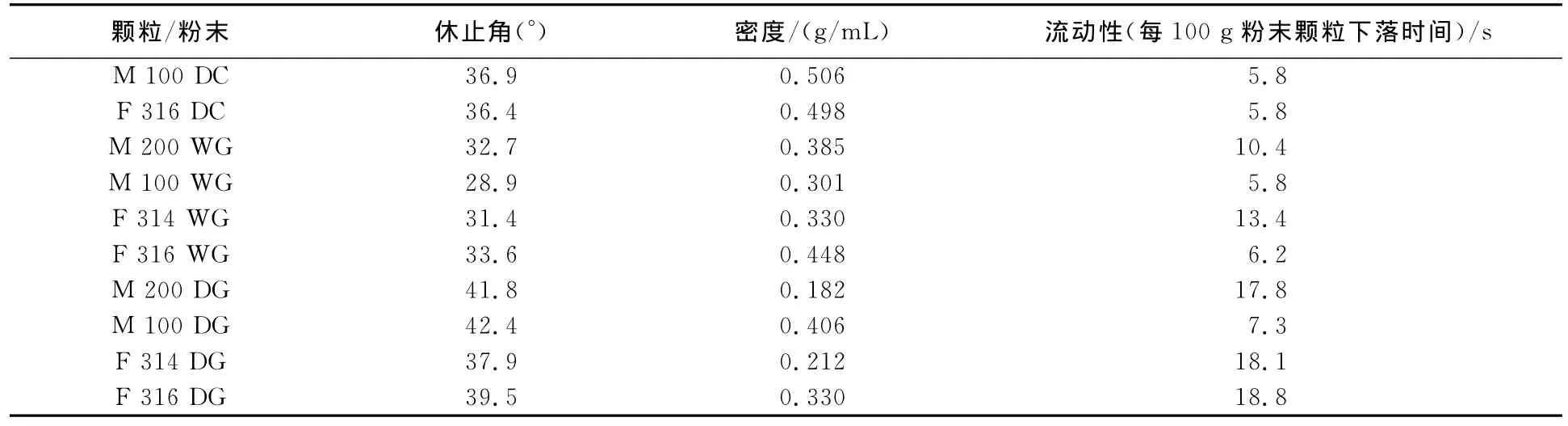
表2 混合物,干/湿颗粒粉体性质
松/紧密度是衡量粉体性质的另一项指标,并由此可计算出粉体的Carr系数和Hausner系数,分别说明物料的可压性[4]和流动性[5].M 100DG的Carr指数为16.67,显著大于F 316DG的11.11(见表3),从侧面印证了其自发流动性好,因此在同样压力的压片环境下,可压性差(颗粒易流动造成更多缝隙,不易成片,需加大压片压力),但在重力作用下好的流动性可使得整体制备过程中混合药物分布得更加均匀.
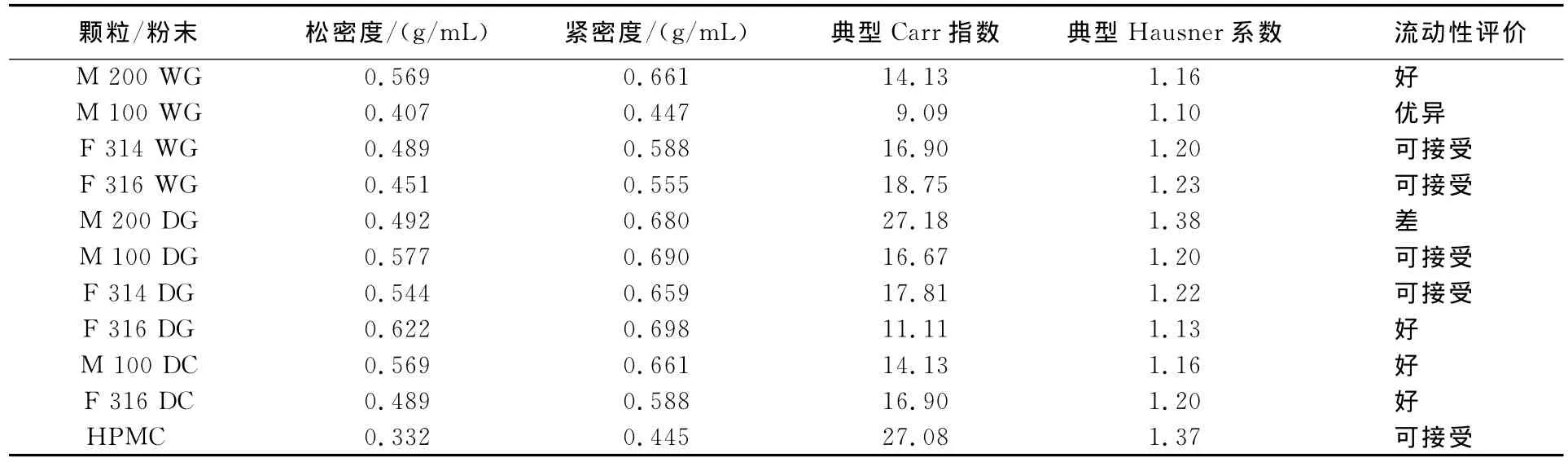
表3 混合物,干/湿颗粒粉体性质松/紧密度及流动性评价
粒度分布(见图1及表4)反映出粉体样品中不同粒径颗粒占颗粒总量的百分数,常用的指标有d10,d50,d90.d90是指某样品的累计粒度分布数达到90%时所对应的粒径大小,其物理意义是粒径小于它的颗粒占总量的90%.d50,d10以此类推,其中d50常用来表示粉体的平均粒度.跨距是描述粒度分布宽窄的数值,越小则说明粒度分布越集中,因此在物料贮存、运输和生产时因重力等外界作用造成分层的程度越轻且易于重新混匀.由表4及图1的结果可见,湿颗粒的粒径均远大于使用同样乳糖所制备的干颗粒,且粒度分布更趋向统一.经过制粒过程后,初始粒径相差很大的喷雾干燥乳糖和过筛/研磨乳糖形成粒径分布相近的颗粒,但由于颗粒表面性质不尽相同,其流动性和可压性均具有较大差异,直接导致之后压片所得到的片剂中药物含量均匀度出现差异.
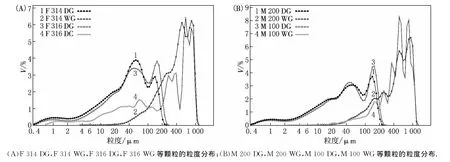
图1 喷雾干燥乳糖和研磨/过筛乳糖制备的干/湿颗粒的粒度分布
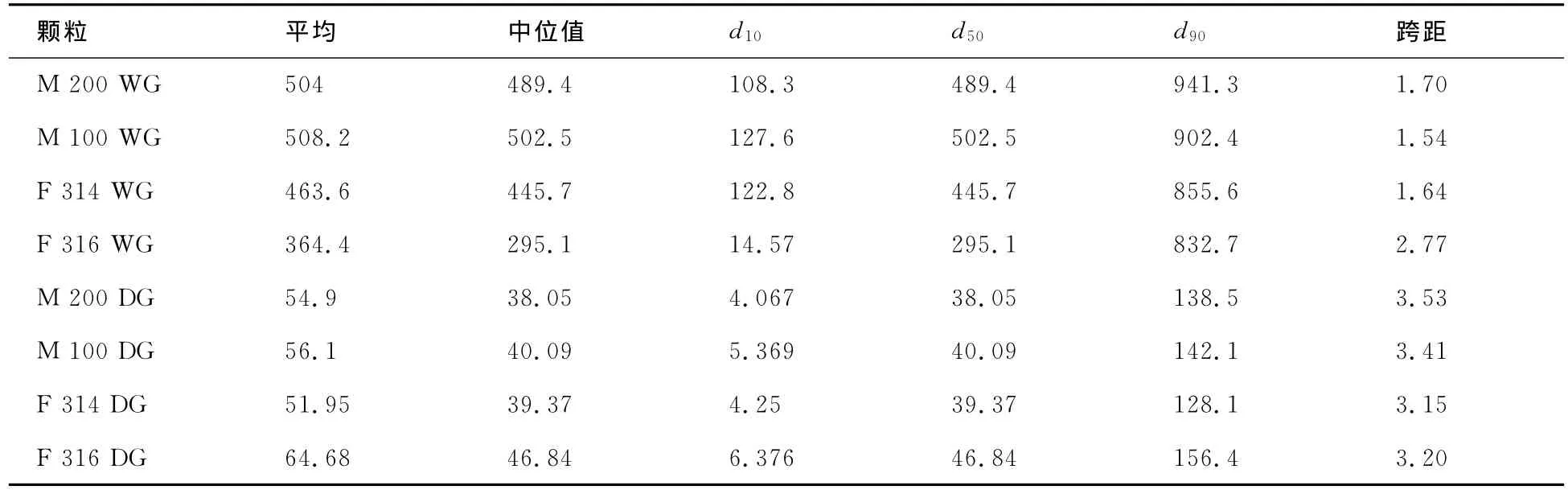
表4 颗粒粒度分布 μm
2.2 干法/湿法制粒对药物及辅料稳定性的影响
经过制粒之后,乳糖与HPMC和药物形成了更为复杂的混合物.正戊立酮盐酸盐的熔点为225℃.DSC结果(见图2)曲线所体现的是占总体绝大多数乳糖的热变化.但是从乳糖曲线上失去结晶水的第一个峰和第二个熔融峰(图2中(A)和(B))在颗粒制备后的峰偏移和变化可以看到,几乎所有干颗粒都有峰形变宽(样品融化并伴随降解,样品纯度低)及向左偏移(熔点温度下降)的现象,并多出现峰分叉(乳糖结晶晶型发生变化),说明经过干法制粒后,乳糖的稳定和均一性较湿颗粒中的乳糖要差.

图2 DSC结果
值得注意的是,M 200DG的第一个失去结晶水的峰形几乎消失不见,缺少乳糖结晶水的干颗粒流动性和可压性极差,且其密度为所有批次压片中最小的,以至于在之后的压片过程中,无法成功压得M 200DG药片.
2.3 颗粒微观表面结构
通过SEM电镜可以直观地观察到所制备颗粒的微观表面结构(见图3).

图3 干/湿颗粒微观表面形态(放大倍数分别为40倍和100倍)
喷雾干燥乳糖因其球形的形态结构,即使经过制粒过程后,少部分未形成颗粒的乳糖可以大大改善整体物料的流动性.研磨/过筛乳糖的湿颗粒为不规则立体形状,且表面孔隙更小、更紧密(见图4).

图4 干/湿颗粒微观表面形态(放大倍数分别为40倍和100倍)
干法制粒后,无论是喷雾干燥乳糖还是研磨/过筛乳糖,都形成了粒径差异极大的不规则立方体,与湿颗粒相比,干颗粒中未制成粒的球形喷雾干燥乳糖也几乎无法观察到,且干颗粒SEM结果中能明显见到未制成粒的棒状HPMC.
2.4 压片相关检查结果
2.4.1 硬度/脆碎度结果
经干法/湿法制粒所得的压片,其硬度差距较大(见表5).使用喷雾干燥乳糖的批次硬度普遍大于使用研磨/过筛乳糖的批次.值得注意的是,M 200DG未能成功压制成片,与其失去结晶水、流动性和可压性极差有关.尽管官方推荐M 200可应用于干法制粒,但对于与HPMC搭配的该处方来说,结果是失败的,需要添加有助于提高流动性的其他辅料,如微晶纤维素等,改善其总体的流动性.
2.4.2 含量均匀度结果
根据中国药典相关要求进行片含量均匀度检测,结果见表6.使用研磨/过筛乳糖的湿法制粒片含量均匀度在第一次抽检(n=10)时均不合格,追加抽检20片(n=30)后检测合格.尽管其M 200WGT和F 314WGT含量均匀度RSD值均小于5%,但含药量检测值均高于设计值(3mg/片).这与M 200 WG和F 314WG的较小的密度有关,压片过程中通过控制片重未达到控制含药量的目的,同样片重,M 200WG和F 314WG填充的颗粒会较多,因此含药量会高于其他批次的压片.
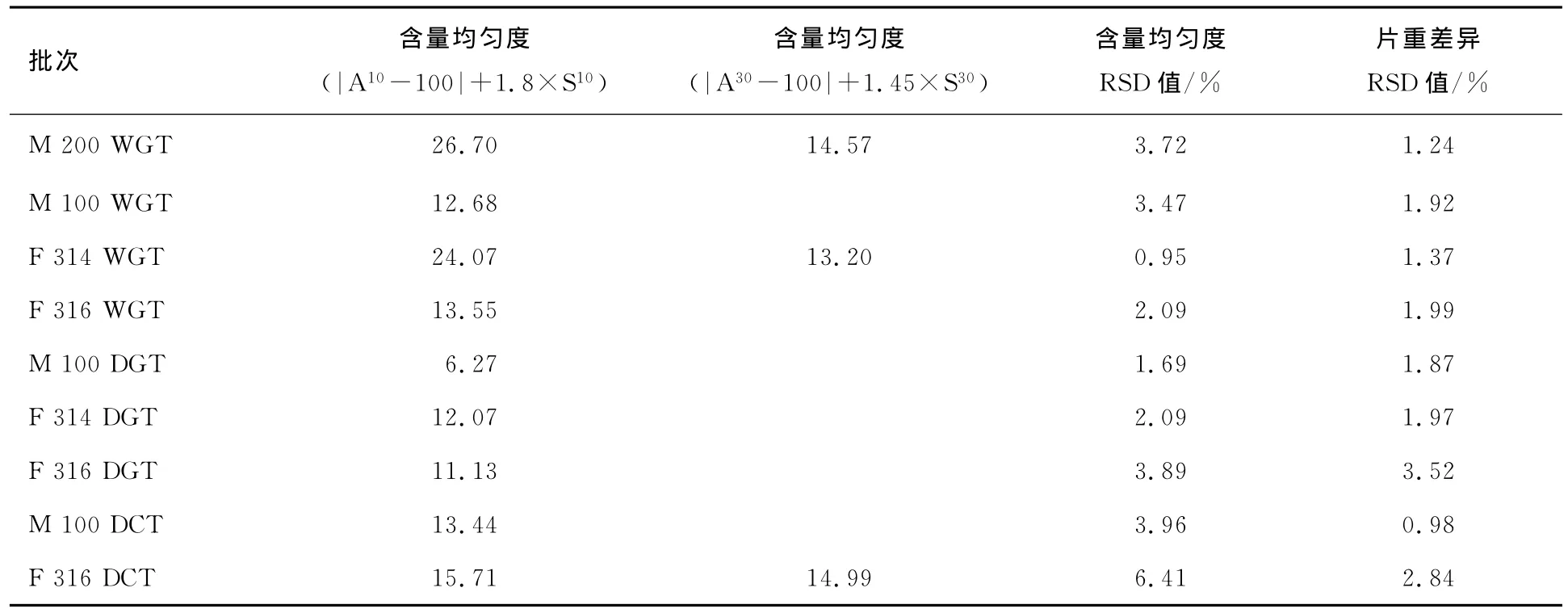
表6 含量均匀度结果
值得注意的是,喷雾干燥乳糖F 316应用于直压时,在第一次抽检(n=10)时未能通过,追加抽检后,勉强合格,但其含量均匀度RSD值显著大于其余批次的药片(P<0.05),这可能与其较大的CAM系数有关,可压性差导致其片重差异较大,也因此导致抽检药片时药物的含量均匀度结果具有一定的随机性,处于及格和不及格的交界处.
2.4.3 体外溶出曲线
体外溶出实验中,在考察了不同溶出介质之后[13],由于正戊立酮盐酸盐在水中具有较好的溶解度,故优选去离子水为药片溶出介质,结果见图5.
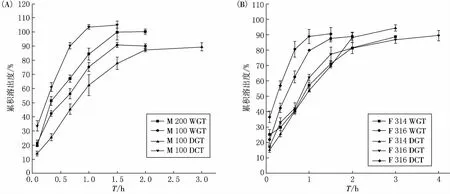
图5 片溶出曲线(溶出介质为去离子水,浆速50r/min,温度37℃)
对比两个品牌乳糖批次压片的溶出结果,可以发现直压片普遍溶出较快(M 100DCT和F 316 DCT),基本在1.5h内可完全溶出,且溶出度均在90%以上,M 100DCT甚至还出现了溶出过度的现象.类似地,M 200WGT溶出度也在1.5h之后达到了100%,其原因可能是因为在含量均匀度检测时,药片内部颗粒包含有药物部分的HPMC遇到溶出介质后形成凝胶态膜,使得药物未能完全彻底地溶于溶出介质(尽管肉眼已无可见残余物),使得实际检测得到的含药量略偏小.在溶出进行时,溶蚀和降解同时进行,使得药片中药物因渗透作用逐渐释放至周围介质中,因此溶出的更加完全和彻底.
描述药物释放机制的方程有多种,如零级释放、一级释放,而大多数情况下,多孔聚合物骨架系统(porous matrix system)药物释放一般符合Fick定律,其释放动力学过程可以用Higuchi方程来进行描述[7].通过方程拟合释放结果,我们发现药片的释放曲线基本符合Higuchi方程,即意味药物释放遵守骨架扩散机制(R2>0.995),但是通过Korsmeyer-Peppas方程的释放系数n的范围[8],M 200WGT和M 100WGT主要控制释放的方式为super case-II transport(n>1),即意味着药物释放主要由骨架溶蚀控制.而对于n<0.5的,则属于quasi-Fickian扩散(case I transport),药物释放主要由浓度梯度驱动的溶出扩散控制.对于0.5<n<1(特别是0.49<n<0.59),药物扩散的主要机制则为Fick扩散和溶出机理的联合作用[9].与湿法制粒批次的药片相比,干法制粒批次的药片,因其在制备过程中HPMC为经过黏合剂黏合形成了凝胶骨架结构,其缓释作用主要是在接触到释放介质后形成水化膜时开始进行[10],因此其释放也更多地受到药片颗粒粒径分布的影响.另一方面,湿法制粒批次的药片,因为经过润湿剂(主要是水)的作用,药物分布于HPMC形成的骨架之中,在释放时基本遵循Higuchi方程.该结果在使用另一品牌乳糖的同处方设计中,得到了证实[3].喷雾干燥乳糖直压法制得的批次药片,其硬度、脆碎度和含量均匀度均与喷雾干燥乳糖湿法制得的批次药片相近,但溶出略快于后者.干法制粒制得的批次药片释放最慢,主要原因是干法制粒所得药片的颗粒粒径小,比表面积大,因此使得HPMC所形成的凝胶骨架更加紧密[10].F 316DGT的溶出在一定时间内符合一级释放模型,可以定义为缓释.综合考虑药片含量均匀度结果和溶出行为曲线,喷雾干燥乳糖湿法制粒片和干法制粒片,结果优于研磨/过筛-水乳糖的片剂(见表7).

表7 药片释放方程拟合结果
3 结论
对于传统剂型片剂来说,低剂量制剂意味着药片中绝大部分为填充剂、稀释剂等药用辅料.乳糖是优良的片剂辅料,品牌繁多、型号各异,用户可根据需要进行选择.而不同品牌粉体性质相似的几种乳糖在同一处方经制备后在流动性、密度以及含量均匀度方面差异明显.喷雾干燥乳糖经湿法制粒后所形成的颗粒混合物其粒度适中,粒径分布跨距小,在实际应用中具有更优越的重分散性.同时,能保持乳糖晶型在制粒过程中的稳定.本研究中的结果为其他低剂量片剂的设计提供了有价值的结果和参考.
[1]KUKKAR V,ANAND V,KATARIA M,et al.Mixing and formulation of low dose drugs underlying problems and solutions[J].Thai J Pharm Sci,2008(32):43-58.
[2]SHI Z,HERMILLER J G,GUNTER T Z,et al.A novel sample selection strategy by near-infrared spectroscopy-based high throughput tablet tester for content uniformity in early-phase pharmaceutical product development[J].J Pharm Sci,2012,101(7):2502-11.
[3]HUANG W,WANG C-H,YU K-T,et al.Using spray-dried lactose monohydrate in wet granulation method for a low-dose oral formulation of a paliperidone derivative[J].POWDER TECHNOL,2013,ACCEPTED.
[4]CARR R L.Evaluation flow properties of solids[J].Chem Eng,1965(72):163-8.
[5]BEDDOW J K.Professor Dr.Henry H.Hausner,1900-1995.[J].Part Part Sysy Char,1995,12(4):213.
[6]袁利佳.帕潘立酮前体衍生物及其凝胶骨架缓释片的研究 [D].吉林:吉林大学生命科学学院,2011.
[7]HIGUCHI T.Rate of release of medicaments from ointment bases containing drugs in suspensions[J].J Pharm Sci,1961(50):874-5.
[8]KORSMEYER R,GUNNY R,PEPPAS N A.Mechanisms of solute release from porous hydrophilic polymers[J].International journal of pharmaceutics,1983(15):25-35.
[9]RAO K,HA C S.pH sensitive hydrogels based on acryl amides and their swelling and diffusion characteristics with drug delivery behavior[J].Polymer Bulletin,2009,62(2):167-81.
[10]SIEPMANN J,PEPPAS N A.Higuchi equation:Derivation,applications,use and misuse[J].Int J Pharm,2011,418(1):6-12.
[11]DASH S,MURTHY P N,CHOWDHURY P,et al.Kinetic modeling on drug release from controlled drug delivery systems[J].Acta Pol Pharm,2010,67(3):217-33.

