重组人血管内皮生长因子(VEGF)单克隆抗体的制备
徐多多,李思静,李芳芊,潘鹏涛,吴 靖,王 丽
(东北师范大学遗传与细胞研究所,吉林 长春 130024)
血管内皮生长因子(VEGF)是一种诱导血管生成及增加血管透性的重要蛋白质,最早是在1989年由Leunq等人在牛的垂体星状细胞培养液中提纯出来的[1],是一种重要的促血管生成因子.研究证明它是一种同源二聚体糖蛋白[2],由两个相同多肽链通过二硫键构成.细胞在生长过程中需要这种生长因子的促进作用,尤其是肿瘤细胞在生长和转移过程中更离不开VEGF的作用.近年来许多学者的研究发现,肿瘤患者血清中VEGF蛋白含量明显高于健康人[3-5];此外,血管的生成及细胞增生程度也与VEGF的表达水平有着密切关系[6],且其过度表达影响肿瘤的转移和侵袭.基于以上理论基础,本文应用杂交瘤技术制备了VEGF单克隆抗体,以为开发检测VEGF的试剂奠定基础.
1 材料与方法
1.1 材料
雌性BALB/c小鼠,购于吉林大学公共卫生基础医学院实验动物中心;小鼠骨髓瘤细胞(SP2/0)、重组质粒pET28a(+)-VEGF、大肠杆菌DH5α、BL21由本实验室保存;Ni-NTA琼脂糖凝胶购自德国QIAGEN公司;IPTG购自鼎国生物有限公司;尿素、Na2HPO4·12H2O、NaH2PO4·2H2O、咪唑、PEG4000购自上海生工;羊抗鼠IgG-HRP二抗购自北京中杉金桥生物公司;弗氏完全佐剂、弗氏不完全佐剂、HAT培养基(50×)、HT培养基(50×)购自美国Sigma公司.
1.2 VEGF蛋白的诱导表达及纯化
将pET28a(+)-VEGF表达质粒转化至大肠杆菌,挑取单菌落,接种至LB培养基中,37℃,100r/min振荡培养过夜.第2天,接种新的LB培养基,200r/min扩大培养4h后,加入IPTG(终浓度1mmol/L),37℃,200r/min诱导表达4h,离心收集菌体并进行超声破碎,8mol/L尿素溶解沉淀,4℃过夜,离心,弃沉淀留上清.将含有目的蛋白的上清液上镍柱,分别用浓度为20,40,100,200,500mmol/L的咪唑(用8mol/L尿素溶液配制,pH=7.4)洗脱,收集各个浓度的洗脱液,电泳分析,选出条带比较单一的样品收集并纯化.
1.3 免疫动物
小鼠免疫按常规方法进行,初次免疫用30μg的VEGF蛋白与等体积的弗氏完全佐剂混合,乳化后免疫BALB/c小鼠.以后每隔2周,采用VEGF蛋白与等体积的弗氏不完全佐剂混合后进行免疫,共免疫3次.
1.4 杂交瘤细胞融合
提前两周复苏SP2/0骨髓瘤细胞,融合前一天取BALB/c小鼠腹腔巨噬细胞制备饲养细胞.加强免疫3d后进行细胞融合,将SP2/0细胞与脾细胞按1∶10的比例(体积比)于50mL离心管中混合,1min内缓慢滴入1mL预热的50%PEG4000,37℃水浴中静置5min,用无血清RPMI-1640培养基终止作用,离心收集细胞.首先将细胞悬于含HAT的选择培养基中,接种于96孔细胞培养板中,每孔加1~2滴细胞悬液使得接种细胞密度为1~2个/孔,培养10d后更换HT培养基,两周后,改用一般培养基.
1.5 杂交瘤细胞筛选及克隆化
待杂交瘤细胞生长至孔底面积1/10以上时,用VEGF(0.5μg/mL)包被ELISA板,用ELISA方法筛选阳性克隆孔.同时设SP2/0骨髓瘤细胞上清液作为阴性对照.D(450)值大于或等于阴性孔的2.1倍即为阳性孔.选取D(450)值相对较高的培养孔进行克隆,采用有限稀释法进行4次亚克隆,获得能够稳定分泌VEGF单克隆抗体的杂交瘤细胞株.
1.6 腹水的制备、纯化、效价测定及特异性验证
1.6.1 腹水制备
按常规方法将0.5mL无菌液体石蜡注射到小鼠腹腔,一周后,再将0.5mL杂交瘤细胞((2~5)×106个/mL)悬液注射到小鼠腹腔.同时用SP2/0细胞制备阴性腹水.10~20d后,当观察到小鼠腹部明显膨隆、波动感明显且小鼠状态较差时,收集腹水.
1.6.2 腹水纯化
采用G蛋白(Protein G)亲和层析法对腹水抗体进行纯化.将磷酸钠盐结合缓冲液装入5mL注射器中,用10mL结合缓冲液洗柱,流速为1mL/min;将腹水与结合缓冲液按照1∶2(体积比)稀释,上样,流速1mL/min,然后用10mL结合缓冲液洗柱;用Bradford试剂检测,直到流出液中没有蛋白为止.用洗脱缓冲液洗柱,收集样品,-40℃保存.
1.6.3 效价测定
采用间接ELISA方法测定纯化的VEGF单克隆抗体效价.用制备的VEGF蛋白包被ELISA板,浓度为0.5μg/mL,每孔100μL,4℃过夜;37℃封闭1h,拍干后加入倍比稀释的抗体100μL,另用骨髓瘤细胞制备的腹水作为阴性对照,用抗体稀释液作为空白对照,37℃孵育1h;洗涤后加入羊抗鼠IgG-HRP,37℃反应45min,加底物显色,最后用2mol/L的硫酸终止反应.用酶标仪测定波长450nm处样品(P)、阴性对照孔(N)及空白对照(B)的D(450)值,计算P/N 比值,并选定P/N≥2.1为阳性,其中P/N≥2.1时阳性血清的最大稀释倍数即为抗体效价.
1.6.4 单克隆抗体特异性验证
用Western blot方法对VEGF单克隆抗体的特异性进行鉴定.首先将VEGF蛋白进行SDS-PAGE,然后将其电转至PVDF膜上,用封闭液进行封闭,洗涤后将纯化的单克隆抗体作为一抗,羊抗鼠IgG-HRP作为二抗,最后用AEC底物显色.
2 结果
2.1 VEGF蛋白SDS-PAGE及Western blot分析
目的蛋白经过NTA-Ni2+亲和层析及咪唑梯度洗脱后,在相对分子质量20000~31000之间出现了一条单一的目的带(见图1),纯度达到90%以上,满足实验要求.纯化后的VEGF蛋白再经过SDS-PAGE进行分离,将凝胶上的纯化蛋白转移至PVDF膜上,利用商品化VEGF单克隆抗体进行特异性分析,结果表明,纯化后的VEGF蛋白在对应位置出现了明显的单一杂交条带(见图1),证实制备的VEGF蛋白具有抗原性能够特异性识别VEGF抗体.
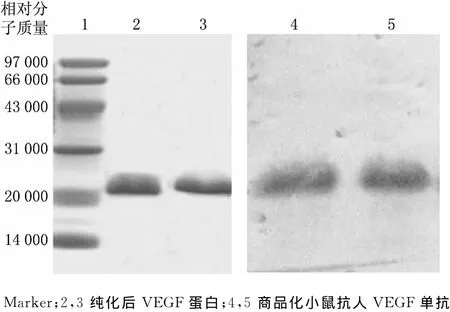
图1 纯化后VEGF蛋白SDS-PAGE及Western blot分析
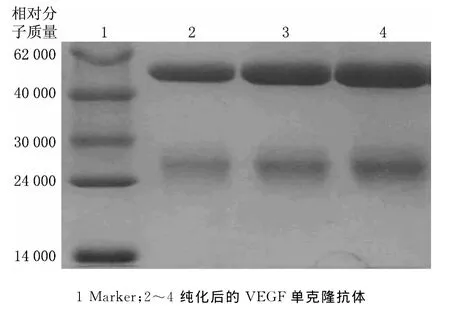
图2 G蛋白亲和纯化后腹水抗体SDS-PAGE
2.2 单克隆抗体制备纯化结果
采用小鼠腹腔注射的方法制备腹水,利用IgG能与G蛋白特异性结合的特性,使IgG先吸附于琼脂糖凝胶上,再使用洗脱缓冲液将IgG洗脱,从而达到对腹水抗体纯化的目的.将洗脱液进行SDS-PAGE分析,结果如图2所示.从图2中可以清晰看到抗体的轻链、重链,且杂蛋白含量非常少,表明纯化后的腹水抗体纯度高,可满足后续实验要求.
2.3 单克隆抗体的效价测定
采用间接ELISA方法对纯化后的腹水抗体进行效价测定,结果见图3.从图3可以看出,纯化后的腹水抗体的D(450)值与阴性对照的D(450)值之比大于或等于2.1的最高稀释倍数为1024.因此,腹水抗体纯化后效价达到1∶1024.
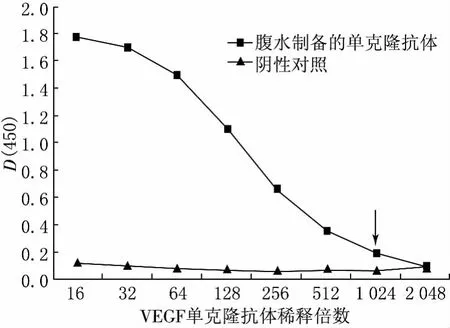
图3 纯化后VEGF单克隆抗体效价检测结果

图4 Western blot鉴定制备的单克隆抗体特异性
2.4 单克隆抗体特异性鉴定
应用Western blot方法对获得的单克隆抗体进行特异性分析,结果见图4.结果显示,单克隆抗体能与VEGF蛋白发生特异性反应,而阴性对照无特异性条带出现,表明纯化后的单克隆抗体能够特异性识别目的蛋白.
3 讨论
VEGF是目前发现的最强烈的血管生成因子,参与促进血管内皮细胞增殖、诱导肿瘤血管生成、维持肿瘤继续生长等诸多生理及病理过程[8].VEGF是肝素结合型二聚体糖蛋白,有5种剪接异构体,分别包括121,145,165,189,206个氨基酸,其中VEGF165是体内最丰富的亚型,具有较强的生物活性[9].因此,本实验选择免疫原时,采用的是VEGF165蛋白.
细胞融合是制备单克隆抗体过程中关键的一步,融合率高低和后续的阳性杂交瘤细胞的筛选密切相关.因此在细胞融合前要做好充足的准备,如提前复苏骨髓瘤细胞使得融合时可生长到最佳状态,提前一天制备饲养细胞以及免疫后的小鼠脾细胞要充分研磨等.
细胞融合后,首先使用HAT培养基进行筛选,杂交瘤细胞生长的同时阻断其他融合细胞或未融合细胞的生长与繁殖.本实验主要采用间接ELISA的方法进行筛选,并获得了特异性及灵敏性较高的细胞株.细胞融合后选择适合的检测时间也是很重要的,过早会因阳性细胞少而出现假阳性,过晚可能会使检测细胞株中混有不分泌抗体的阴性克隆细胞,而这些细胞具有代谢上的优势,它会与阳性细胞竞争营养成分,进而导致阳性细胞死亡.本研究是在融合后的第10天,观察到部分杂交瘤细胞生长至孔底面积的1/10时,开始对其进行检测.为避免阳性细胞株转变成阴性,应该在筛选出阳性孔后尽快进行亚克隆.另外,由于初次筛选出的杂交瘤细胞中的染色体极不稳定,易丢失,从而丧失分泌抗体的能力,所以,一般要经过3~4次的克隆、亚克隆才能筛选出能够稳定分泌抗体的阳性杂交瘤细胞.
本研究以高纯度的VEGF作为抗原反复免疫小鼠,按常规单克隆抗体制备技术筛选出1株可分泌VEGF抗体的杂交瘤细胞,并通过制备腹水的方法成功获得了高纯度的VEGF单克隆抗体.经ELISA和Western blot检测,抗体具有高特异性,效价达到1∶1024,为下一步开发基于血清VEGF蛋白的检测试剂奠定了基础.
[1]LEPELLETIER Y,CAMARA-CLAYETTE V,JIN H,et al.Prevention of mantle lymphoma tumor establishment by routing transferrin receptor toward lysosomal compartments[J].Cancer Res,2007,67(3):1145-1154.
[2]FERRARA N,HENZEL W.Pituitary follicular cells secret a novel heprin-binding growth factor specific for vascular endothelial cells[J].Biochem Biophys Res COMMUN,1989,161:851-858.
[3]YAMAMOTO Y,TOI M,KONDO S,et al.Concentrations of vascular endothelial growth factor in the sera of normal controls and cancer patients[J].Clin Cancer Res,1996,2(5):821 -826.
[4]HASEGAWA Y,TAKANASHI S,OKUDERA K,et al.Vascular endothelial growth factor level as a prognostic determinant of small cell lung cancer in Japanese patients[J].Intern Med,2005,44(1):26-34.
[5]SHIMADA H,TAKEDA A,NABEYA Y,et al.Clinical significance of serum vascular endothelial growth factor in esophagcal squamous cell carcinoma[J].Cancer,2001,92(3):663-689.
[6]PAULOVICH A G,HARTWELL L H.A checkpoint regulates the rate of progression through S phase in S.cerevisiae in response to DNA damage[J].Cell,1995,82(5):841-847.
[7]KOHLER G,MILSTEIN C.Continuous cultures of fused cells secreting antibody of predefined specificity[J].Nature,1975(256):495-497.
[8]王彦敏.血管生因子 VEGF研究进展 [J].河北医药,2010,32:1456-1458.
[9]石琦,单冰,高晨,等.血管内皮生长因子(VEGF)单克隆抗的制备及鉴定[J].细胞与分子免疫学杂志,2008,24(2):142-146.

