白蚁肠道木质素及纤维素分解菌的分离鉴定及产酶条件优化*
高云航,王 巍,李秋菊,马红霞,娄玉杰
(1.吉林农业大学动物科技学院,吉林长春 130118;2.吉林农业大学动物生产与产品质量安全教育部重点实验室,吉林长春 130118)
木质素和纤维素是植物细胞壁的重要组成成分,二者与半纤维素构成一个结构复杂,难于降解的整体,在秸秆等农作物中,木质素会缔结成木质素鞘,与纤维素和半纤维素环绕在一起,使得秸秆等作物难于降解,甚至变为废物。目前全球每年可产生木质素及纤维素的数量庞大,主要以农作物废弃秸秆形式存在[1],因此如何加速分解利用此类对解决环境问题和维持生态平衡等方面意义重大。
随着科技不断发展,微生物的多样性研究日益受到科学工作者的广泛关注[2]。白蚁是自然界木质素和纤维素类物质的重要分解者,特别是白蚁后肠的微生物在木质素及纤维素生物循环中发挥举足轻重的作用[3]。本研究从白蚁肠道分离筛选出具有木质素和纤维素双重降解功能菌株,选取功能最强的菌株进行形态、生理生化特性和16S rRNA序列分析并对最适产酶条件进行了优化,以期为木质素及纤维素废物资源化研究提供参考。
1 材料与方法
1.1 材料
1.1.1 供试白蚁 黑胸散白蚁 (购自浙江大学)。
1.1.2 培养基 羧甲基纤维素钠 (CMC-Na)培养基:CMC-Na 20 g,Na2HPO42.5 g,KH2PO41.5 g,蛋白胨2.5 g,酵母膏0.5 g,琼脂15 g,蒸馏水定容至1 000 mL,pH 7.0~7.2,121℃灭菌30 min。
苯胺蓝 (Azure-B)培养基:木质素 10 g,(NH4)2SO44.3 g,MgSO4·7H2O 0.3 g,KH2PO44.3 g,CaCl20.3 g,苯胺蓝0.1 g,琼脂18 g,蒸馏水1 000 mL。
摇瓶复筛培养基:CMC-Na 5 g,牛肉膏5 g,蛋白胨1 g,秸秆粉5 g,NaCl 5 g,pH7.0,121℃灭菌15~30 min。
产酶发酵基础培养基:羧甲基纤维素钠(w/%)0.5,蛋白胨 (w/%)1,牛肉膏 (w/%)0.5,NaCl(w/%)0.5,调 pH 7.0,121℃高压灭菌20 min。
1.1.3 引物 采用细菌16S rRNA通用引物。上游:5'-AGAGTTTGATCCTGGCTCAG-3';下游:5'-GGTTACCTTGTTACGACTT-3'。
1.1.4 主要试剂及主要仪器 Azure-B、刚果红、DNS(酒石酸钾钠、3,5-二硝基水杨酸、亚硫酸钠、NaOH、苯酚)(北京鼎国生物技术公司),藜芦醇 (Sigma公司),胶回收试剂盒 (杭州维特洁生化技术有限公司)。恒温培养箱DHP-9082;气浴恒温振荡器SH2-82;低温冷冻离心机;凝胶成像系统;三恒电泳仪、DYYIll33B水平平板电泳槽;紫外可见分光光度计Gene Amp PCR System9700。
1.2 方法
1.2.1 木质素、纤维素分解菌的初筛 将数只成年黑胸散白蚁 (液氮保存)经消毒、去除头胸部后,制成白蚁腹部匀浆,并将其梯度稀释至10-6级。分别取 10-4、10-5、10-6级的样品 100 μL 涂布于CMC-Na平板上,37℃倒置培养48 h;用三区划线法得到单菌落后将其点种于CMC-Na培养基上,37℃倒置培养48 h;待长出菌落,用1 mg/mL刚果红浸染15 min,倾去染液,并以1 mol/L NaCl水溶液脱色,观察水解圈大小。
同时分别取不同稀释度的样品100 μL接种于以木质素为碳源的培养基上,37℃培养5 d。将平板置于白色背景下,观察有无透明圈。挑取单菌落至含苯胺蓝 (Azure-B)的培养基中,37℃避光培养7 d,每天观察记录,以Azure-B培养基中菌落的脱色圈的有无及脱色圈的大小定性筛选出产酶快、产酶活高的菌株。
1.2.2 木质素、纤维素分解菌的复筛 将活化的菌株接种到液态种子培养基中,置37℃摇床中恒温振荡培养24 h;按1%接种到摇瓶发酵培养基中,37℃,150 r/min振荡培养48 h;取上述发酵液于4 500 r/min离心10 min,取上清液,即为粗酶液。纤维素降解酶活力测定采用DNS法[4],木质素过氧化物酶活力测定采用藜芦醇法[5]。
1.2.3 菌株形态学观察及生化鉴定 经初筛、复筛得到酶活力较高的菌株,观察其菌落形态,并经革兰氏染色后观察菌体形态和染色特征。细菌生化鉴定参考文献 [6]进行。
1.2.4 菌株16S rRNA鉴定 细菌基因组DNA的提取按照文献[7]进行。PCR反应采用25 μL体系:DNA模板 0.5 μL;上下游引物各 0.5 μL;dNTP 2 μL;10 × Ex Taq Buffer 2.5 μL;Ex Taq 酶0.3 μL;无菌去离子水补足25 μL。PCR扩增条件依次为94℃5 min;94℃1 min;50℃1 min;72℃1 min;30个循环;72℃延伸10 min;4℃保存,w=1%琼脂糖凝胶电泳检测扩增结果。回收扩增产物与pMD18-T载体连接后送生物公司测序。用BLAST软件对测序结果进行同源性分析,获取相近典型菌株基因序列,利用DNAStar中MegAlign软件构建16S rRNA系统进化树。
1.2.5 菌株产酶条件优化
1)碳源对产酶活力的影响。
改变产酶发酵基础培养基中的碳源,分别以羧甲基纤维素钠,葡萄糖,秸秆,木质素、秸秆混合物,乳糖,羧甲基纤维素钠、秸秆混合物,木质素为碳源,编号设为1~7。按1%接种量接种,37℃,150 r/min振荡培养48 h后测定酶活力,根据测定结果分析不同碳源对酶活力的影响。
2)氮源对产酶活力的影。
在确定了碳源的基础上,分别以牛肉膏,蛋白胨,酵母粉,酒石酸铵,硫酸铵,酵母粉、硫酸铵混合物,牛肉膏、蛋白胨混合物为氮源,编号设为1~7,按1%接种量接种,37℃,150 r/min振荡培养48 h后测定酶活力,根据测定结果分析不同碳源对酶活力的影响。
3)初始pH对产酶活力的影响。
在确定碳源、氮源基础上,将产酶发酵基础培养基中的初始pH分别调至3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,将种子液按1%接种量接种,37℃,150 r/min振荡培养48 h后测定酶活力。
4)发酵温度对产酶活力的影响。
在确定最佳碳源、氮源和最适初始pH基础上,发酵温度分别设置为27、32、37、42、47和52℃。将种子液按1%接种量接种,37℃下150 r/min振荡培养48 h后测定酶活力。
5)发酵时间对产酶活力的影响。
在确定最佳碳源、氮源以及最适初始pH和发酵温度基础上,将种子液按1%接种量接种,37℃下150 r/min振荡培养,培养24 h后间隔12 h取样1次,进行酶活力测定。
6)接种量对酶活的影响。
在确定了最佳碳源、氮源、初始pH以及最适发酵温度和发酵时间基础上,将种子液按1%,3%,5%,7%,11%不同浓度接种,观察不同接种量对酶活力的影响。
2 结果
2.1 木质素、纤维素分解菌初筛结果
利用刚果红培养基和Azure-B培养基,从白蚁肠道内筛选出5株在两种培养基上均有明显反应圈(图1)的细菌,可初步说明分离菌株对纤维素和木质素均有一定的分解作用。
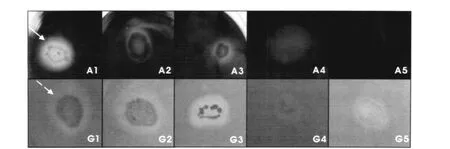
图1 菌株在筛选培养基上的脱色圈及水解圈Fig.1 The clear hydrolytie zone on the screening plate
2.2 木质素、纤维素分解菌复筛结果
将5株同时具有木质素及纤维素分解功能的菌株分别进行摇瓶培养,测定酶活力,其中菌株MX5产纤维素酶活力最高,其酶活为12.404 U/mL。且其木质素过氧化物酶活力达102 U/L。
2.3 菌株形态学观察和生化鉴定结果
2.3.1 形态学观察结果 菌株MX5为需氧菌,肉眼可见该菌在普通培养基上生长良好,菌落扁平,边缘不整齐且不光滑,表面有皱褶,菌落不透明。经革兰氏染色于显微镜下观察呈单生,革兰氏阳性芽孢杆菌 (图2)。

图2 菌株MX5的革兰氏染色 (1 000×)Fig.2 The Gram staining of stain MX5(1 000×)
2.3.2 生化鉴定 参照菌株MX5生化试验结果(表1)和伯杰氏细菌分类手册,此分离菌株符合芽孢杆菌属地衣芽孢杆菌Bacillus licheniformis的生化试验特性。

表1 菌株MX5生化试验结果1)Table 1 The results of biochemistry test for MX5
2.4 菌株16S rRNA鉴定
2.4.1 菌株16S rRNA序列扩增 以提取的基因组DNA为模板,成功扩增出1 451 bp的16S rRNA,其大小与预期结果相符 (图3)。
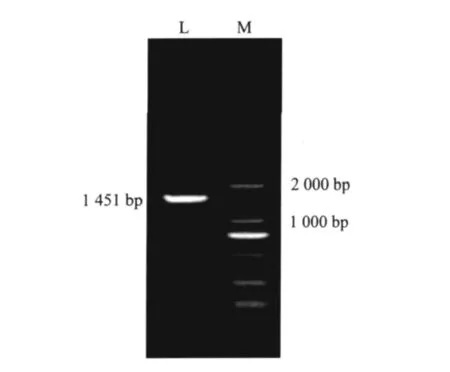
图3 PCR产物电泳结果Fig.3 The electrophoresis result of PCR product

图4 菌株MX5系统进化树Fig.4 The phylogenetic tree of stain MX5
2.4.2 序列比对及系统进化树构建 将菌株MX5阳性质粒送生物公司测序,结果为1 451 bp(登录号JX027378)。用NCBI中BLAST软件对菌株MX5 16S rRNA测序结果进行分析:MX5与Bacillus licheniformisstrain GD3a的相似性最高,达99%。用DNAStar中MegAlign软件构建系统进化树 (图4),可知MX5与Bacillus licheniformisstrain DQgbc4的亲缘关系最近,同源性为97.1%,最终确定菌株MX5为芽孢杆菌属的地衣芽孢杆菌Bacillus licheniformis。
2.5 菌株产酶条件的优化结果
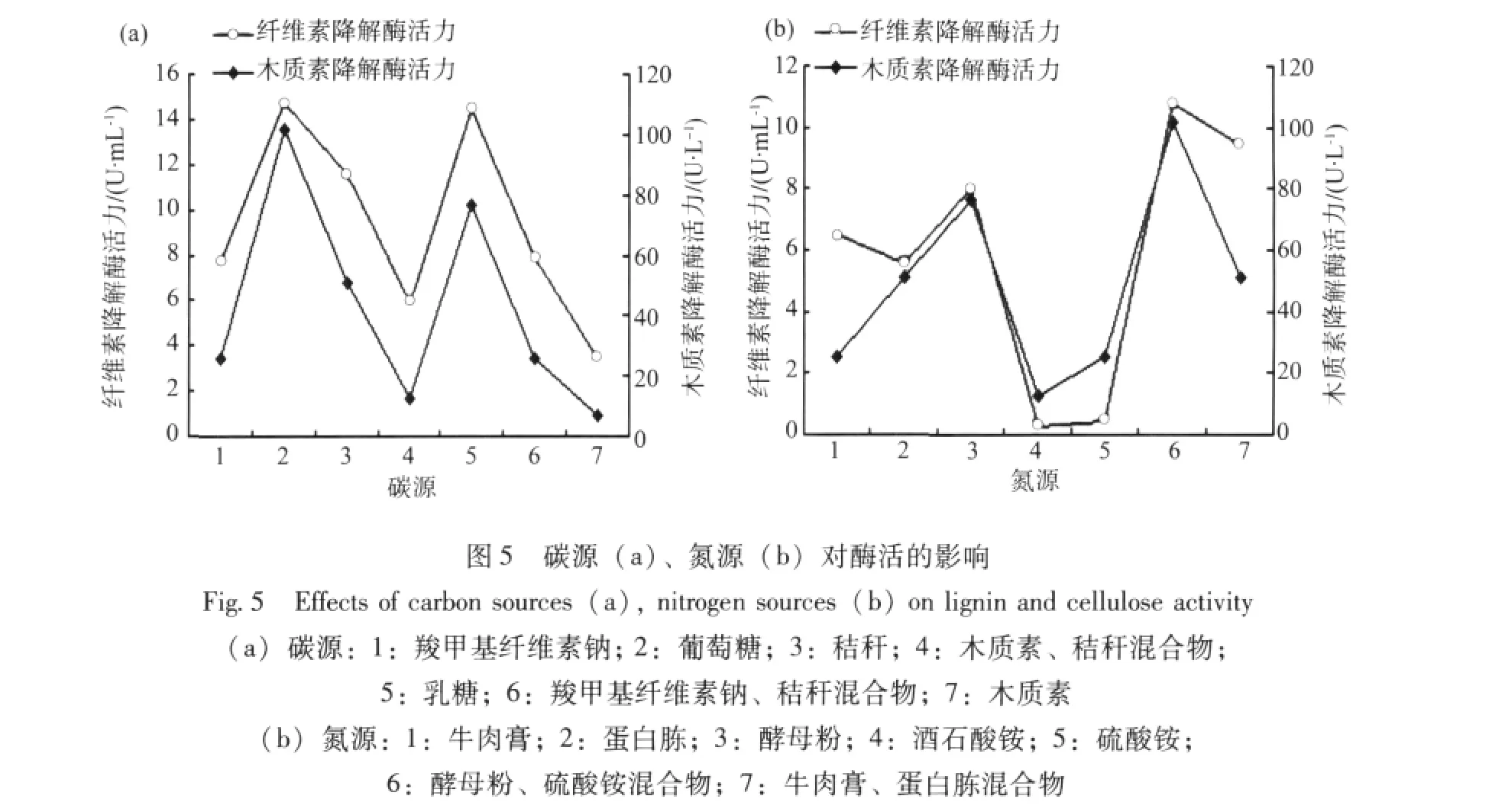
2.5.1 碳源和氮源对菌株酶活的影响 由图5(a)可知,菌株MX5以葡萄糖、乳糖为碳源时产生的酶活力最高。但是在实际应用中,由于葡萄糖、乳糖均属于分析纯制剂,价格较昂贵,因此采用价格廉价,产酶能力比葡萄糖、乳糖稍低的秸秆作为最佳碳源进行深入研究。
由图5(b)可知,产酶活力最高的是以酵母粉和硫酸铵混合物为氮源,产酶活力最低的是硫酸铵和酒石酸铵,所以本试验选用酵母粉和硫酸铵混合物为氮源进行下一步研究。
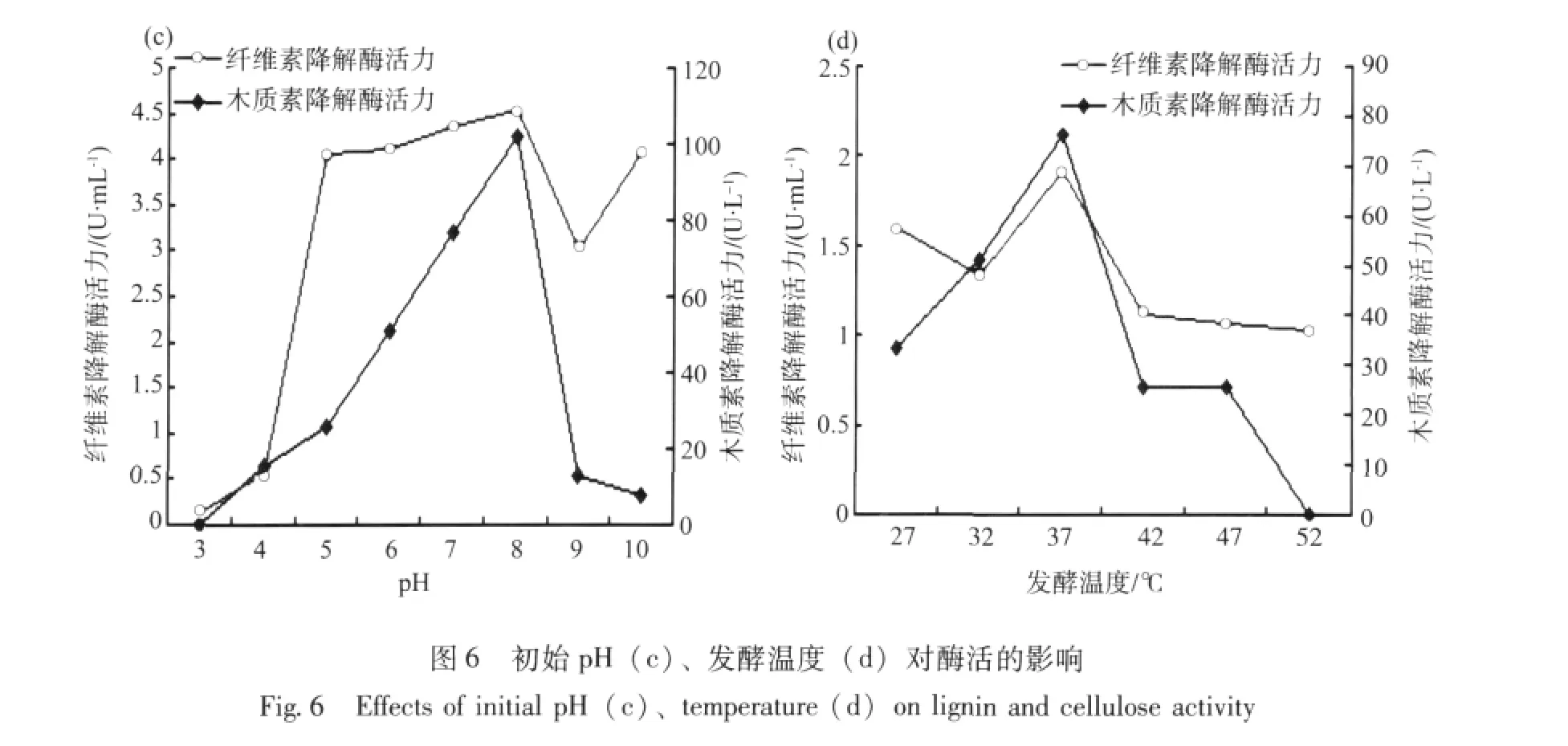
2.5.2 初始pH和发酵温度对菌株酶活的影响由图6(c)可知,当pH3.0时菌株MX5产酶活力较低,纤维素酶活力为0.13 U/mL,木质素酶活力为0。随着pH值升高酶活逐渐升高,在pH8.0时,酶活性达到最高,纤维素酶活力为4.54 U/mL,木质素酶活力为102 U/L。在pH10时,纤维素酶活力略有上升,木质素酶活力呈下降趋势。由图6(d)可知,菌株MX5的酶活在37℃达到顶峰。随着温度继续升高,菌株MX5酶活较大幅度的降低,因此选择37℃作为最佳发酵温度。
2.5.3 发酵时间和接种量对菌株酶活的影响 由图7(e)可知,将种子液接种24 h后,随着发酵时间的延长,酶活逐渐升高,并于96 h达到最高,随后呈下降趋势。由图7(f)可知,接种量为1%时,产酶活性最高,纤维素酶活力为9.35 U/mL,木质素酶活力为76.5 U/L。
3 讨论
产酶条件优化方面,由于菌株不同,最适产酶条件一般会存在差异。本试验菌株在pH8.0时酶活力最强。不同的菌株对初始pH要求差异很大,如白腐菌basidiomiceteTrametes trogii(MYA 28-11)在pH4.5时,产木质素酶活力最强[8]。假单胞菌Pseudomonas sp.PKE117在pH5.5时,产木质素酶活力最强[9]。粗壮脉纹孢菌Neurospora crassa在pH4.8时,产纤维素酶活力最强[10]。即使同为芽孢杆菌属细菌,其最适pH也存在差异。短小芽孢杆菌Bacillus pumilusE2在pH6.0时,产纤维素酶活力最强[11],Bacillus velezensisCXB001 产纤维素酶活力的最适pH为5.0[12]。
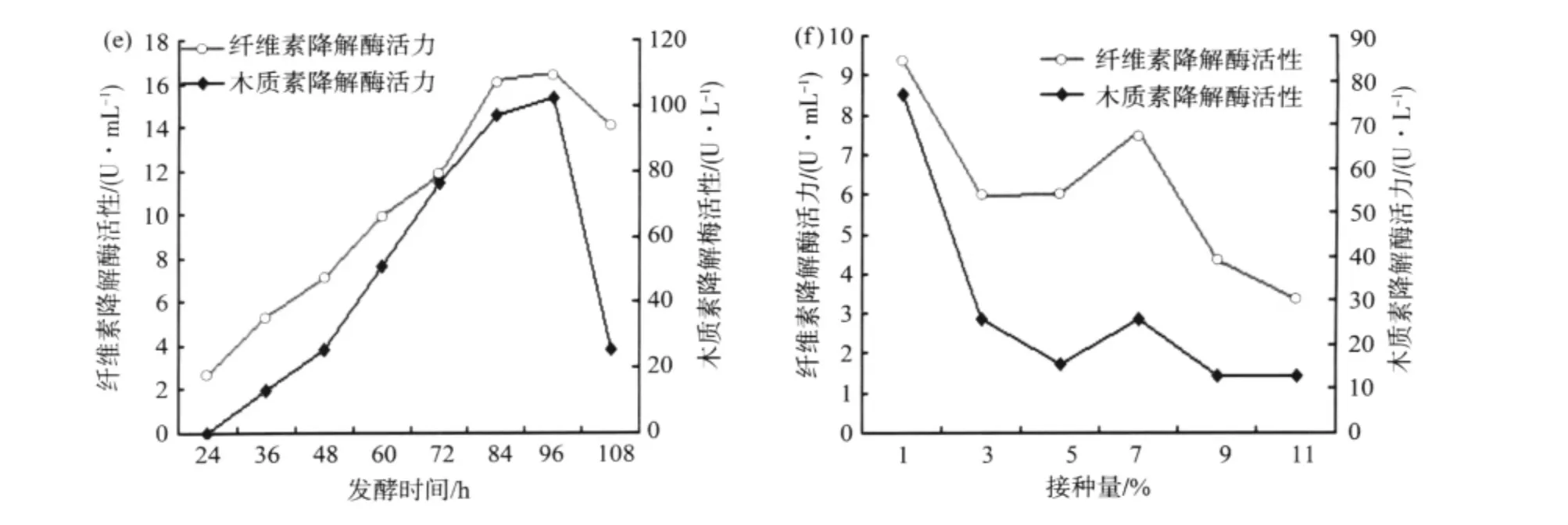
图7 发酵时间 (e)和接种量 (f)对酶活的影响Fig.7 Effects of time(e)、inoculum size(f)on lignin and cellulose activity
在本试验中,pH对同一株菌产生的木质素酶及纤维素酶活力不尽相同。本试验结果表明,木质素酶活力受pH影响较大,pH8.0时菌株生长良好,但pH9.0时菌株酶活力急剧下降,而纤维素酶活力在pH5.0~8.0时,活力较稳定。由此可知,不同酶对pH的要求不同,即使是同一株菌所产生酶类对pH要求也有差异。但本试验菌株两种酶的最适pH均为8.0,这可能与两种酶的活性中心氨基酸组成有关,但目前并无相关报道,其原因有待进一步研究。
本试验采用Azure-B平板法及刚果红培养基法筛选白蚁肠道中的木质纤维素分解菌,生化试验结合16S rRNA方法对菌株种属进行鉴定,达到了快速、有效的鉴定分类的目的。本试验同时测定了不同碳源、氮源、初始pH、发酵温度、发酵时间及接种量等对酶活最强菌株MX5产酶活力影响,通过改变条件使菌株产酶量增加,这将对提高木质纤维素的利用率具有十分重要的意义。
目前,对于白蚁肠道中纤维素酶基因的克隆已有相关报道[13],但对于木质素酶基因的克隆还鲜有报道,故从白蚁肠道中获得降解木质素的相关基因,并对其开展深入研究,充分利用木质素酶分解自然界中广泛存在的木质纤维素类物质,发展第三代生物质能源,意义深远。
[1]SÁNCHEZ C.Lignocellulosic residues:Biodegradation and bioconversion by fungi[J].Biotechnol Adv,2009,27:185-194.
[2]ROTHSCHILD N,NOYOTNY,VÁCLAV Š,et al.Ligninolytic enzymes of the fungusIrpex lacteus(Polyporus tulipiferae):Isolation and characterization of lignin peroxidase[J].Enzyme MicrobTechnol,2002,31:627-633.
[3]VARMA A,KOLLI B K,PAUL J,et al.Lignocellulose degradation by microorganisms from termite hills and termite guts:A survey on the present state of art[J].FEMS Microbiol Rev,1994,15(1):9-28.
[4]周刚.白蚁内生菌的分离及其纤维素酶/木质素酶高产菌株的鉴定[D].哈尔滨:黑龙江大学,2006:22-35.
[5]金剑,康文丽,生吉萍,等.云芝(Coriolus versicolor)木质素过氧化物酶(LiP)酶学性质分析[J].食品科学,2010,31(17):224-227.
[6]姚火春.兽医微生物学实验指导[M].北京:中国农业出版社,2002:36-42.
[7]张桂山.吉林白鹅肠道纤维分解菌分离鉴定的研究[D].长春:吉林农业大学,2007:9-21.
[8]LEVIN L,HERRMANN C,PAPINUTTI V L.Optimization of lignocellulolytic enzyme production by the whiterot fungusTrametes trogiiin solid-state fermentation using response surface methodology[J].Biochem Eng J,2008,39:207-214.
[9]杨金水,袁红莉,李宝珍,等.假单孢菌PKE117木素过氧化物酶的酶学性质及基因克隆[J].北京大学学报:自然科学版,2007,43(4):567-571.
[10]吴丹,邓泽元,范亚苇,等.一株纤维素分解菌的分离、鉴定及产酶条件优化[J].食品科学,2008,29(06):218-221.
[11]高云航,张喜宏,刘佳丽,等.鹅肠道纤维素分解菌的分离鉴定及其产酶条件的优化[J].动物营养学报,2011,23(3):466-472.
[12]邓先余,邹谋勇,黄志坚,等.一株产纤维素酶细菌的分离鉴定及其酶学特性研究[J].中山大学学报:自然科学版,2012,51(5):93 -99.
[13]ZHOU X G,SMITH J A,Oi F M,et al.Correlation of cellulase gene expression and cellulolytic activity throughout the gut of the termiteReticulitermes flavipes[J].Gene,2007,395(1/2):29 -39.

