高糖环境对小鼠细胞免疫功能的影响
李思敏,杨 静
近来糖尿病被认为是一种慢性低度促炎症状态,表现为循环中的单核细胞及炎症因子水平升高,并且认为细胞因子如肿瘤坏死因子-α(TNF-α)、白介素-6(IL-6)与糖尿病动脉粥样硬化及心脑血管疾病有着密切联系[1]。很多实验表明高糖可以引起体内细胞因子水平的变化,但是在高糖环境下细胞因子的浓度如何变化,不同的研究结果不尽一致。有研究表明糖尿病患者血中免疫细胞分泌的Th1型细胞因子[如干扰素-γ(IFN-γ)、白介素-12(IL-12)]浓度比正常糖浓度者血中免疫细胞分泌的 Th1型细胞因子浓度高,而Th2型细胞因子(如IL-4、IL-10)的浓度是降低的[2]。但也有研究表明1型糖尿病(TIDM)患者外周血中的CD4+、CD8+T细胞产生的IFN-γ与正常糖浓度者相比是显著降低的[3]。而有关小鼠脾细胞的研究报道较少,本实验采用体外培养小鼠脾细胞,以不同糖浓度刺激,检测细胞因子的表达情况,探求高糖环境对免疫细胞功能的影响。
1 材料与方法
1.1 主要材料及试剂 C57BL/6雌性清洁级小鼠(6周龄)购自北京大学医学部-北京华阜康生物科技股份有限公司;RPMI 1640培养基、胎牛血清(FBS)、谷氨酰胺及青霉素、链霉素购自美国 GIBCO公司;HEPES、D-葡萄糖、PMA、Ionomycin、脂多糖(LPS)及刀豆凝集素(ConA)购自美国SIGMA公司;CytoTox 96®非放射性细胞毒性检测试剂盒购自美国PROMEGA公司;ELISA检测试剂盒与流式细胞术检测试剂盒均购自美国BD公司。
1.2 分离小鼠脾细胞 颈椎脱臼法处死小鼠,用75%酒精消毒腹部皮肤及四肢,无菌条件下剖开小鼠腹腔取出脾脏,置于不含FBS的RPMI 1640培养基中,并去除周围结缔组织,待所有脾脏均取出后,用2.5mL注射器内芯通过40μm细胞过滤网研磨,收集细胞悬液于15mL离心管中,并加入含5%FBS的RPMI 1640培养基将细胞吹打混匀,离心后裂解红细胞并用RPMI 1640培养基清洗2遍,最后细胞重悬于RPMI 1640无糖培养基中。
1.3 细胞培养及实验分组 调整细胞浓度为3×106/mL,培养于含5%FBS、2mmol/L谷氨酰胺、100U/mL青霉素、0.1mg/mL链霉素及25mmol/L HEPES的RPMI 1640培养基中,加入LPS(1μg/mL)及ConA(5μg/mL)为刺激T、B淋巴细胞增殖。实验分为3组:5.5mmol/L糖浓度组(5.5mmol/L组)、11.1mmol/L糖浓度组(11.1mmol/L组)和25mmol/L 糖浓度组(25mmol/L组),置于37℃、5%CO2培养中孵育。
1.4 非放射性细胞毒性检测 定量检测乳酸脱氢酶(LDH),LDH是一种稳定的胞质酶,在细胞裂解时会释放至培养基上清中,分别于6h、24h、48h收集各孔培养基,离心后各取150μL上清加到96孔板中,每孔50μL,每个样品设3个复孔,然后通过30min偶联的酶反应来检测,用BioTek-ELX808酶标仪在490nm处读板。所有操作均按试剂盒说明书进行,以RPMI 1640培养基为阴性对照孔,靶细胞最大释放量采用反复冻融法。
1.5 细胞因子检测 ELISA法检测6h、24h、48h培养细胞上清中IFN-γ、TNF-α、IL-6及IL-10的浓度,所有操作均按试剂盒说明书进行,用BioTek-ELX808酶标仪在450nm处读板。
1.6 流式细胞术 提前4h在每孔细胞中加入PMA(终浓度为5ng/mL)与Ionomycin(终浓度为500ng/mL),置于37℃、5%CO2培养中孵育1h后,每孔加入1μL Protein Transport Inhibitor,继续置于37℃、5%CO2培养中孵育3h。然后将培养24h的细胞分别收集于离心管中,4℃离心(1 400rpm、8 min)后弃上清,每管加100μL的Fc Block,4℃放置15min后进行胞外染色,所有样品加CD3e-FITC抗体,4℃避光放置30 min后每管加1mL的staining buffer清洗细胞,离心后加入200μL的Fixation and Permeabilization重悬细胞,再加1mL的Perm/Wash buffer清洗细胞2遍,加入TNF-αPE单抗,4℃避光放置30min后清洗一遍,将细胞重悬于250μL的staining buffer中,混匀,上机,经FACSCalibur流式细胞仪(美国BD公司)每管分选出CD3+T细胞亚群,收集10 000个细胞,用Cell Quest软件分析数据,以荧光抗体染色阳性细胞的百分率记录结果。所有操作均按试剂盒说明书进行,同时设不加抗体的阴性管与FITC单染管。
2 结 果
2.1 非放射性细胞毒性检测 以5.5mmol/L糖浓度为阴性对照孔,分别检测11.1mmol/L和25mmol/L糖浓度在6h、24 h和48h三个时间点对小鼠脾细胞的细胞毒性,结果显示细胞毒性均小于7%,各组间差异无统计学意义,数据未显示。
2.2 细胞培养上清细胞因子的检测 ELISA定量检测细胞因子的结果表明,TNF-α在高糖刺激6h分泌最高,24h后降低,11.1mmol/L和25mmol/L糖浓度刺激的小鼠脾细胞分泌的TNF-α均显著低于5.5mmol/L组(P<0.01)。在24h和48 h,高糖刺激可显著降低脾细胞分泌的IFN-γ、IL-6与IL-10产量(P<0.05),且呈现明显的剂量-效应关系。详见表1、表2。
表1 不同糖浓度对小鼠脾细胞分泌TNF-α的影响(±s)
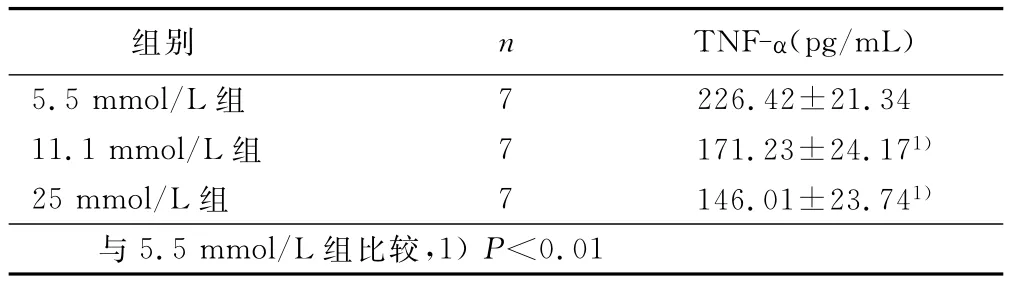
表1 不同糖浓度对小鼠脾细胞分泌TNF-α的影响(±s)
组别 n TNF-α(pg/mL)5.5mmol/L组7 226.42±21.34 11.1mmol/L组 7 171.23±24.171)25mmol/L组 7 146.01±23.741)与5.5mmol/L组比较,1)P<0.01
表2 不同糖浓度对小鼠脾细胞分泌IFN-γ、IL-6、IL-10的影响(±s) pg/mL

表2 不同糖浓度对小鼠脾细胞分泌IFN-γ、IL-6、IL-10的影响(±s) pg/mL
项目 组别 n 24h 48h 9 3 332.06±298.95 6 950.94±885.38 11.1mmol/L组 9 1 434.05±416.182)2 519.53±113.692)IFN-γ 5.5mmol/L组25mmol/L组 9 495.26±35.562) 602.38±95.102)IL-6 5.5mmol/L组 9 160.03±19.70 297.95±25.76 11.1mmol/L组 9 149.60±16.23 173.19±20.502)25mmol/L组 9 135.32±17.681) 84.16±28.292)IL-10 5.5mmol/L组 9 128.80±21.00 278.17±35.77 11.1mmol/L组 9 72.57±5.932) 110.50±12.742)25mmol/L组 9 26.48±3.702) 80.93±8.662)与5.5mmol/L组比较,1)P<0.05,2)P<0.01
2.3 流式细胞术检测24h高糖刺激下小鼠脾细胞内分泌TNF-α的情况 结果表明CD3+T细胞是小鼠脾细胞分泌TNF-α的主要细胞来源。在25mmol/L糖浓度刺激下,CD3+T细胞亚群内TNF-α阳性细胞的百分比显著均低于5.5mmol/L组和11.1mmol/L组(P<0.05)。详见表3。
表3 小鼠脾细胞在不同糖浓度刺激下CD3+T细胞内TNF-α阳性细胞检测结果(±s) %
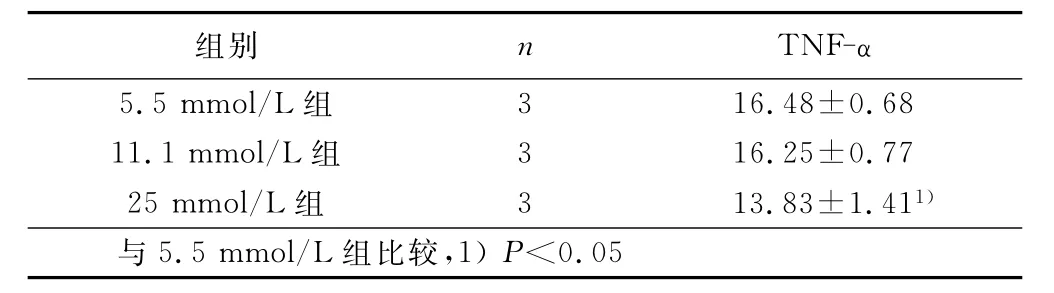
表3 小鼠脾细胞在不同糖浓度刺激下CD3+T细胞内TNF-α阳性细胞检测结果(±s) %
组别 n TNF-α 5.5mmol/L组3 16.48±0.68 11.1mmol/L组 3 16.25±0.77 25mmol/L组 3 13.83±1.411)与5.5mmol/L组比较,1)P<0.05
3 讨 论
糖尿病是以慢性血糖升高为主要表现的代谢性疾病,近来认为糖尿病与免疫功能紊乱有密切联系。高血糖是参与糖尿病免疫发病机制的一个重要因素,通过直接或间接的机制引起生物化学及代谢性的改变从而导致胰腺功能及结构的改变[4-6]。Maedler等[7]通过培养人胰岛细胞发现高血糖可以诱导IL-1β释放,而且糖尿病病人对感染的敏感性增加与血糖控制不好是相关的[8]。有实验表明[9],体外培养人单核细胞株(THP1),在高糖刺激下其分泌 TNF-α、IL-6及IL-1β浓度是升高的。但也有实验表明[10],体外培养THP1,给予高糖刺激后,高糖使IL-1β的表达减弱,且表达降低存在葡萄糖浓度依赖性。而对于在体内发挥重要免疫功能的脾细胞的研究却很少,为了探讨脾细胞在高糖环境下免疫功能会发生怎样的改变,本实验通过体外培养小鼠原代脾细胞,给予不同糖浓度的刺激,用ELISA及流式细胞术检测细胞因子的变化情况,发现随着糖浓度的升高,TNF-α、IFN-γ、IL-6及IL-10四种细胞因子的浓度均降低。这与文献[11]的实验结果一致,他们用高糖培养小鼠脾细胞发现细胞因子 TNF-α、IFN-γ和IL-10的浓度在28mmol/L糖浓度刺激下比2.8mmol/L糖浓度刺激下低,但是并未呈现剂量-效应关系。而本实验通过ELISA法发现在24h和48h,高糖刺激可显著降低脾细胞分泌的IFN-γ、IL-6与IL-10产量,并呈现明显的剂量-效应关系,且进一步通过流式细胞术确认了TNF-α主要来源于T细胞。但是我们的实验都表明了糖尿病的高糖环境可以影响细胞因子的分泌,并且高糖与免疫共同作用导致了糖尿病患者细胞因子的改变。四种细胞因子的浓度随糖浓度的升高而降低,可能是由于高糖可以导致T、B淋巴细胞的增殖降低,细胞的活性下降,同时促进了细胞的凋亡,并且诱导淋巴细胞的氧化应激效应。
IFN-γ主要由活化的T细胞和NK细胞产生,可以激活巨噬细胞并促进其功能,还可激活中性粒细胞和NK细胞杀伤活性,发挥抗感染的作用。此外IFN-γ还是Th1细胞的代表性细胞因子,其功能是增强吞噬细胞介导的抗感染机制,促进细胞免疫,在机体抗胞内病原体感染中发挥重要作用。同时TNF-α、IL-6及IL-10与IFN-γ在对抗病原感染有协同作用。细胞免疫对抵御胞内寄生菌,如结核杆菌、伤寒杆菌、真菌等引起的慢性感染尤为重要。而实验结果表明高糖环境下,脾细胞分泌细胞因子的能力减弱,提示糖尿病患者更易感染可能与细胞免疫功能降低有关。
[1]Yang LB,Qi WB,Lv XH,etal.Intermittent high glucose promotes expression of proinflammatory cytokines in monocytes[J].Inflammation Research,2011,60(4):367-370.
[2]Rabinovitch A,Suarez-Pinzon WL.Role of cytokines in the pathogenesis of autoimmune diabetes mellitus[J].Rev Endocr Metab Disord,2003,4:291-299.
[3]Avanzini MA,Ciardell L,Lenta E.IFN-γlow producyion capacity in type 1diabetes mellitus patients at onset of diabetes[J].Clin Endocrinol Diabetes,2005,113(6):313-317.
[4]The Diabetes Control and Complications Trial Research Group.Intensive diabetes treatment and cardiovascular disease in patients with type 1diabetes[J].N Engl J Med,2005,353:2643-2653.
[5]Brownlee M.Biochemistry and molecular cell biology of diabetic complications[J].Nature,2001,414:813-820.
[6]Stratton IM,Adler AI,Neil H,etal.Association of glycaemia with macrovascular and microvascular complications of type 2diabetes(UKPDS35):Prospective observational study[J].BMJ,2000,321(7258):405-412.
[7]Maedler K,Sergeev P,Ris F,etal.Glucose-induced beta cell production of IL-1beta contributes to glucotoxicity in human pancreatic islets[J].J Clin Invest,2002,110:851-860.
[8]Dasu MR,Devaraj S,Jialal I.High glucose induses IL-1βexpression in human monocytes:Mechanistic insights[J].Am J Physiol Endocrinol Metab,2007,293(1):E337-E346.
[9]陈樱,孟东,孙蓓,等.高糖对THP-1人单核细胞表达iNOS和IL-1β的影响[J].天津医科大学学报,2009,15(4):708-709.
[10]Thorvaldson L,Stalhammar S,Sandler S.Effects of a diabeteslike environment in vitro on cytokine production by mouse splenocytes[J].Cytokine,2008,43(1):93-97.
[11]Rubinstein R,Genaro AM,Motta A,etal.Impaired immune responses in streptozotocin-induced type I diabetes in mice.Involvement of high glucose[J].Clinical and Experimental Immonology,2008,154(2):235-246.

