α-硫辛酸联合甲钴胺治疗糖尿病周围神经病变的临床观察
叶飞 朱亭
糖尿病周围神经病变(diabetic peripheral neuropathy,DPN)是糖尿病最常见的并发症,多为对称性表现,下肢重于上肢,表现为指端感觉异常,往往伴有感觉过敏、疼痛,后期可出现运动神经受累,肌力减低甚至肌萎缩和瘫痪[1],危害性大。本研究收集了在我科住院的2型糖尿病合并周围神经病变患者78例,观察α-硫辛酸联合甲钴胺治疗DPN的疗效。
1 资料与方法
1.1 一般资料 选择在我科自2009年10月至2011年10月住院的2型糖尿病合并周围神经病变患者78例,临床表现主要为四肢麻木疼痛及感觉异常。将患者随机分为观察组和对照组,每组各39例,观察组男19例,女20例,对照组男17例,女22例,2组患者肝肾功能均正常,且在年龄、性别比例、病程、空腹血糖(FBG)水平、糖化血红蛋白(HbA1c)方面比较无统计学差异(P>0.05),具有可比性。见表1。
表1 2组治疗前一般资料比较±s,n=39)
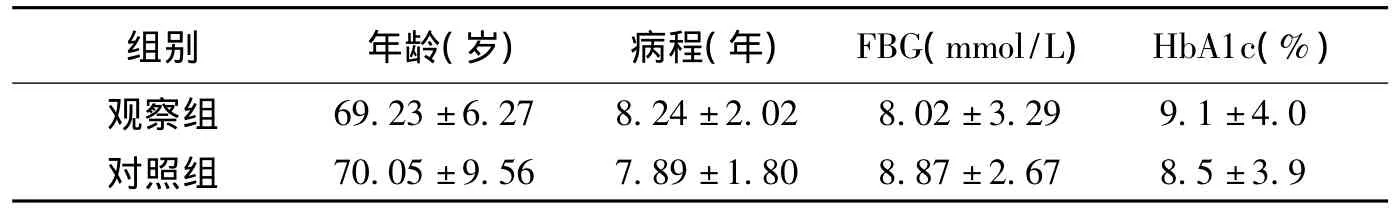
表1 2组治疗前一般资料比较±s,n=39)
组别 年龄(岁) 病程(年) FBG(mmol/L) HbA1c(%)69.23±6.27 8.24±2.02 8.02±3.29 9.1±4.0对照组观察组70.05±9.56 7.89±1.80 8.87±2.67 8.5±3.9
1.2 入组标准 参考美国糖尿病协会(ADA)诊断标准[2],同时符合以下标准的患者入组:(1)四肢感觉异常;(2)膝腱反射减弱或消失;(3)神经电生理检查显示:下肢运动神经传导速度减弱;(4)排除其他周围神经病变;(5)排除肝肾功能异常;(6)妊娠或哺乳期妇女;(7)征得患者本人或家属同意。
1.3 方法
1.3.1 治疗方法:2组患者住院后测定血糖水平,根据FBG情况予以短效胰岛素控制血糖,调整胰岛素用量,控制FBG<7.0 mmol/L,餐后血糖 <10.0 mmol/L。观察组予以α-硫辛酸600 mg+生理盐水250 ml,静脉滴注,每日1次,同时予以甲钴胺1000 μg,静脉推注,每日 1 次,疗程为 2周。对照组:单纯予以甲钴胺1000 μg,静脉推注,每日1次,疗程为2周。
1.3.2 观察指标及疗效判断标准:观察指标:分别于治疗前后测定FBG、肝肾功能,检测正中神经、腓总神经、胫神经运动神经传导速度(motor nerve conduction velocity,MCV)、感觉神经传导速度(sensory nerve conduction velocity,SCV)的变化。疗效判断标准:(1)显效:自觉症状明显好转或消失,腱反射基本恢复正常,MCV和SCV较治疗前加快>5 ms或恢复正常;(2)有效:自觉症状明显减轻,腱反射未完全恢复正常,MCV和SCV较治疗前加快3~5 ms;(3)无效:自觉症状无减轻或加重,腱反射无改善,MCV和SCV无变化。总有效率=显效率+有效率[3]。
1.4 统计学方法 采用SPSS 13.0进行统计学分析,计量资料采用均数±标准差±s)表示,组间比较采用 t检验;计数资料采用百分率表示,组间比较采用卡方检验,以P<0.05为差异有统计学意义。
2 结果
2.1 2组治疗前后运动和感觉神经传导速度比较 治疗前2组MCV和SCV差异无统计学意义(P<0.05)。治疗2周后2组MCV和SCV均较治疗前显著提高,差异均有统计学意义(P<0.05),观察组在治疗后MCV和SCV均高于对照组(P<0.05)。见表2。
表2 2组治疗前后运动和感觉神经传导速度比较±s,ms,n=39)
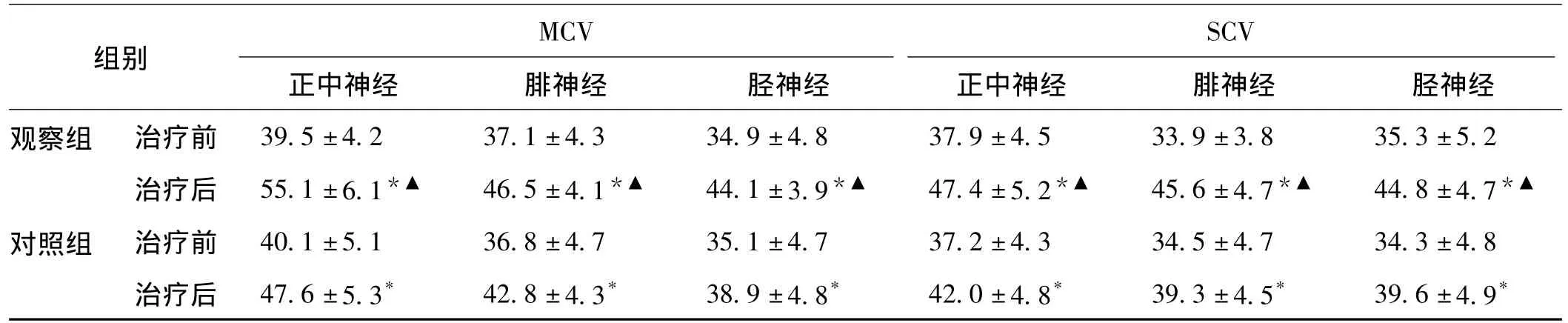
表2 2组治疗前后运动和感觉神经传导速度比较±s,ms,n=39)
注:与治疗前比较,*P<0.05;与对照组比较,▲P<0.05
MCV SCV正中神经 腓神经 胫神经 正中神经 腓神经 胫神经观察组 治疗前 39.5±4.2 37.1±4.3 34.9±4.8 37.9±4.5 33.9±3.8 35.3±5.2治疗后 55.1±6.1*▲ 46.5±4.1*▲ 44.1±3.9*▲ 47.4±5.2*▲ 45.6±4.7*▲ 44.8±4.7组别*▲对照组 治疗前 40.1±5.1 36.8±4.7 35.1±4.7 37.2±4.3 34.5±4.7 34.3±4.8治疗后 47.6±5.3* 42.8±4.3* 38.9±4.8* 42.0±4.8* 39.3±4.5* 39.6±4.9*
2.2 2组疗效比较 观察组显效26例,有效 11例,无效 2例,总有效率达94.87%;对照组显效17例,有效7例,无效15例,总有效率为62.53%,2组相比,观察组明显高于对照组,差异有统计学意义(P<0.01)。
2.3 不良反应 有2例患者在输注过程中感觉局部疼痛,放慢输注速度后,疼痛症状消失。所有入选患者治疗前后肝肾功能均正常。
3 讨论
DPN为2型糖尿病最为常见的并发症,其发病机制尚不明确,目前认为高血糖性代谢紊乱、微血管疾病、神经因子减少是其主要相关因素[4-5]。此外,血糖长期过高,神经末梢组织氧供给不足,高血糖激活多元醇通路,神经细胞内山梨醇的含量增加,氧化应激增强,自由基形成过多,体内高血糖和高氧化状态是末梢神经组织损伤,脱髓鞘变性的主要病因[6]。因而对于DPN的治疗,应在控制血糖的基础上营养神经和改善氧化应激。
α-硫辛酸是一种水溶性或脂溶性的代谢抗氧化物,是丙酮酸脱氢酶的辅助因子,在体内可转化成二氢硫辛酸,清除多种氧化应激产物,螯合重金属离子,再生成还原性谷胱甘肽、维生素C、维生素E、硫氧化蛋白等其他抗氧化剂,进一步清除生理和病理过程中产生的各种自由基[7-8]。研究表明,α-硫辛酸能够抑制细胞中过氧化物诱导的核因子激活,下调细胞黏附因子-1(ICAM-l)、血管细胞黏附分子-1(VCAM-l)的表达,抑制炎症反应,营养周围神经[9]。此外,α-硫辛酸强大的抗氧化效应,能够逆转或阻断各种途径的氧化反应,作用于发病机制的上游途径,直接减少超氧化物的生成,对抗高血糖诱发的氧化应激,改善微循环状态,从而增加神经营养血管的血流量,治疗DPN[10]。
甲钴胺是甲基维生素B12的衍生物,参与体内甲基转移,促进神经细胞的核酸、蛋白质和脂质代谢,并参与神经组织轴突结构蛋白的合成及受伤神经纤维的修复。能够促进髓鞘的形成和轴突的再生,促进损伤的髓鞘修复,改善神经传导速度[11]。
在我们的观察中,α-硫辛酸和甲钴胺联合治疗DPN,2周后运动和感觉神经的传递速度明显提高,患者的自主症状有显著好转,相对于单纯应用甲钴胺效果明显。这提示我们,氧化应激在DPN的发生发展中可能起着关键的作用,抗氧化应激治疗可能成为治疗DPN新的靶点。而α-硫辛酸与甲钴胺联合应用,不仅阻止了神经细胞的进一步损伤,而且还促进神经细胞的修复,对DPN有着显著的效果,值得临床推广。
[1]Pinzur MS.Diabetic peripheral neuropathy[J].Foot Ankle Clin,2011,16(2):345-349.
[2]宁光.糖尿病周围神经病变研究进展[J].中国实用内科杂志,2007,27(7):487-489.
[3]李静.糖尿病周围神经病变药物治疗进展[J].药学与临床研究,2011,19(1):51-54.
[4]Morales-Vidal S,Morgan C,McCoyd M,et al.Diabetic peripheral neuropathy and the management of diabetic peripheralneuropathic pain[J].Postgrad Med, 2012, 124(4):145-153.
[5]樊华,戎娟.老年2型糖尿病合并大血管病变患者血液流变学指标临床观察[J].实用老年医学,2011,25(6):513-515.
[6]Tesfaye S,Selvarajah D.Advances in the epidemiology,pathogenesis and management of diabetic peripheral neuropathy[J].Diabetes Metab Res Rev,2012,28(1):8-14.
[7]辛月颖.α-硫辛酸治疗糖尿病周围神经病变的疗效观察[J].中国现代医生,2009,47(34):45-46.
[8]谷雪静,王燕,樊海英.α-硫辛酸治疗2型糖尿病周围神经病变22例疗效观察[J].实用老年医学,2012,26(1):47-49.
[9]Stevens MJ,Obrosova I,Cac X,et al.Effects of alpha-lipoic acid on peripheral nerve conduction,blood flow,energy metabolism and oxidative stress in experimental diabetic neuropathy[J].Diabetes,2009,49(6):1006-1115.
[10]Han T,Bai J,Liu W,et al.A systematic review and meta-analysis of α-lipoic acid in the treatment of diabetic peripheral neuropathy[J].Eur JEndocrinol2012,167(4):465-471.
[11]Miranda-Massari JR,Gonzalez MJ,Jimenez FJ,et al.Metabolic correction in the management of diabetic peripheral neuropathy: improving clinical results beyond symptom control[J].Curr Clin Pharmacol,2011,6(4):260-273.

