氨基葡萄糖对体外培养人骨关节炎滑膜细胞中炎性细胞因子表达的影响
杨建辉 吕建国 聂会勇 申晓东 (西安交通大学第一医院疼痛科,陕西 西安 710061)
骨关节炎(OA)的发生机制主要是抗炎因子与促炎因子失衡导致的关节软骨破坏和滑膜炎症反应。白细胞介素(IL)-18是近年来人们发现的一种新的致炎细胞因子,其主要生物学功能为介导组织炎症反应,且与一些自身免疫性疾病相关〔1,2〕。氨基葡萄糖不仅可以减轻OA疼痛症状,同时可以延缓OA的病理改变,为改变病情药物〔3〕。本实验通过观察氨基葡萄糖对体外培养人骨关节炎滑膜细胞中白细胞介素(IL)-18、白细胞介素(IL)-1β和肿瘤坏死因子(TNF)-α等炎性细胞因子表达的影响,探讨氨基葡萄糖防治OA的作用机制,为氨基葡萄糖在临床上的应用提供依据。
1 材料与方法
1.1 细胞取材与药品 收集2010年6月至2011年3月在我院行膝关节置换术或关节镜检查OA患者滑膜组织30例,所有患者均符合1986年美国风湿病学会关于OA的临床诊断标准或临床及放射学诊断标准,随机抽取5例用于实验,并签署患者知情同意书。氨基葡萄糖(伊索佳,浙江海正药业生产)。
1.2 主要试剂及器材 D-Hanks液、含10%胎牛血清DMEM培养液(Gibco),0.25%胰蛋白酶(Sigma),25 cm培养瓶,EP管,离心管,倒置相差显微镜(Olympus),CO2细胞培养箱,超净工作台,IL-18酶联免疫吸附试验(ELISA)试剂盒(Uscnlife Science&Technology Company,武汉中美科技有限公司进口组装),TNF-α、IL-1β 酶联免疫吸附试验(ELISA)试剂盒(美国ADL公司生产,天津瀚洋生物有限公司组装)。
1.3 滑膜细胞体外培养 主要采用的是滑膜细胞的组织块培养法〔4〕。用尖刀片仔细分离滑膜组织,将收集来的滑膜组织放入有磷酸盐缓冲液(PBS)的无菌瓶内,在超净台内弃去PBS,用D-Hanks液漂洗滑膜组织3次,剪碎至1 mm×1 mm×1 mm的小块,少量培养液湿润瓶底,将滑膜组织块以间距5 mm左右放入瓶内,将培养瓶放置入培养箱内,待4 h后组织块贴牢。再缓慢加入3 ml培养液覆盖组织小块。培养3 d后更换培养液,除去未贴壁的组织块,每瓶中加入4 ml新鲜培养液。以后隔天换液,倒置相差显微镜下逐日观察细胞形态,待组织块周围细胞铺满50%培养瓶底面,置胰蛋白酶溶液37℃孵育,达氏修正依氏培养基终止消化,按1∶2比例进行传代培养接种,3 d换液1次,约10 d左右可长满瓶底,此为一代滑膜细胞。待布满培养瓶底面90%面积时,即可按1∶3比例再次进行传代培养。用抗vimentin抗体作免疫组织化学染色、鉴定。
1.4 含药血清和正常兔血清的制备 将氨基葡萄糖按体表面积折算动物的等效剂量〔5〕,再用生理盐水配成8 ml溶液给新西兰大白兔灌胃,正常兔血清则以生理盐水8 ml灌胃。连续2次灌胃,中间间隔2 h,在末次灌胃的3 h后,乙醚和氯胺酮复合麻醉下腹主动脉采血,4℃冰箱过液后,离心2 500 r/min×25 min,抽取血清,56℃、30 min 灭活,经 0.45 μm 滤膜抽滤除菌、分装,-20℃保存备用。
1.5 加药培养及上清液收集 第一代滑膜细胞转入12孔的组织细胞培养板,每孔细胞数为1.5×105/L,培养48 h后,用达氏修正依氏培养液清洗2次,吸弃孔中培养液,进行试验分组。实验分为4组:A组(对照组)每孔加入正常兔血清200 μl;B组10%含氨基葡萄糖血清200 μl;C组20%含氨基葡萄糖血清200 μl;D组40%含氨基葡萄糖血清200 μl。每组设4个复孔,连续培养48 h,用胰蛋白酶消化细胞并继续培养1 d后收集培养液上清,编号,-80℃保存待测,滑膜细胞作免疫化学染色。实验重复5次。
1.6 ELISA检测 将-80℃保存的细胞培养上清液放于冰盒完全解冻后,按ELISA检测试剂盒说明操作:加样:分别设空白孔、标准孔、待测样品孔。除空白孔外,余孔分别加标准溶液或待测样品100 μl,注意不要有气泡。轻轻混匀,酶标板加上盖。37℃反应120 min,弃去液体,甩干,不用洗涤。每孔加检测溶液 A 工作液 100 μl,37℃,60 min。洗板 3 次,350 μl每孔,甩干。每孔加检测溶液B工作液100 μl,37℃,60 min,洗板5次,甩干。依序每孔加底物溶液90 μl,37℃避光显色30 min(此时肉眼可见标准品的前3~4孔有明显的梯度蓝色,后3~4孔梯度不明显)。依序每孔加终止溶液50 μl,终止反应(此时蓝色立转黄色)。用酶联仪在450 nm波长依序测量各孔的吸光度(A值)。
1.7 细胞免疫化学染色 免疫组织化学染色采用SABC法,染色方法及免疫组织化学反应阳性颗粒的平均灰度值测定按文献〔6〕进行。具体方法简述如下:将对照组和各加药组培养的滑膜细胞,以1×104/ml接种在放有预处理盖玻片的6孔培养板中进行细胞爬片,贴壁培养,待细胞爬片良好长成单层时,移除孔内的液体。PBS(pH 7.2~7.6)液冲洗3次,每次2 min。防止冲洗掉贴壁的细胞。4%多聚甲醛固定,37℃,30 min。滴加5%BSA封闭液,室温20 min,甩去多余液体,不洗。分别滴加适当稀释(稀释度1∶200)的一抗(兔抗人 IL-18、IL-1β和TNF-α抗体),37℃ 2 h。PBS(pH 7.2~7.6)洗 2 min×3 次。滴加生物素化小鼠抗兔 IgG(二抗),37℃ 20 min。PBS(pH 7.2~7.6)洗2 min×3次。滴加 SABC-AP,37℃ 20 min。PBS(pH 7.2~7.6)洗5 min×4次。显色:用TBS(pH 9.0~9.5)按照1∶20的比例稀释,混匀后加至盖玻片上,37℃显色20 min。蒸馏水洗涤。干燥后水溶性封片剂封片,显微镜下观察。用PBS代替一抗作为阴性对照。
1.8 免疫组织化学图像分析 将滑膜免疫组织化学玻片置Olympus显微镜下(40×),对所测视野进行准确定位后由摄像系统提取数值化细胞图像输入HPIAS-1000高清晰度彩色病理图像分析系统(同济千屏影像公司)进行处理,每组随机选取8个不重叠的视野进行处理,测定免疫组织化学反应阳性颗粒的平均灰度值,灰度值越小,表明免疫组织化学反应越强,反之则表达越弱。
2 结果
2.1 培养细胞的观察、鉴定 培养细胞相差显微镜下观察:组织块原代培养3 d后,细胞从滑膜组织块边缘逸出,7~10 d后,可见大量的细胞从滑膜组织块边缘逸出,呈长梭状极像排列。大部分为成纤维细胞样细胞,也有部分树突样细胞和巨噬细胞样细胞。14~21 d形成密集的单层细胞瓶壁,部分区域呈堆积样或漩涡状生长。细胞长满培养瓶壁后进行传代培养时,成纤维细胞样细胞在0.25%的胰蛋白酶作用下较易于脱离瓶壁;树突样细胞和巨噬细胞样细胞则难以消化,而留于母瓶中,从而获得较单纯的成纤维细胞样细胞。经过2~3次传代后培养的细胞,大部分为成纤维细胞样细胞,经免疫组织化学鉴定可达95%以上。
2.2 ELISA法检测各组滑膜细胞培养上清液中IL-18、IL-1β、TNF-α的含量 A组分别与B组、C组、D组IL-18、IL-1β、TNF-α的含量比较差异有统计学意义(P<0.01),B组与C组、B组与D组、C组与D组IL-18含量比较差异有统计学意义(P<0.05)。随氨基葡萄糖浓度的增加,IL-18含量逐渐降低(D组<C组<B组<A组)。见表1。
表1 各组滑膜细胞培养上清液中IL-18、IL-1β、TNF-α的含量(pg/ml,±s,n=5)

表1 各组滑膜细胞培养上清液中IL-18、IL-1β、TNF-α的含量(pg/ml,±s,n=5)
与A组比较:1)P<0.01;与B组比较:2)P<0.05;与C组比较:3)P<0.05
组别 IL-18 IL-1β TNF-α A组69.9±5.2 96.9±5.2 86.1±6.2 B组 38.4±3.51) 45.9±5.21) 43.9±2.21)C组 23.4±1.51)2) 25.6±3.21)2) 27.2±3.21)2)D组 11.4±1.51)2)3) 12.9±5.21)2)3) 11.2±1.21)2)3)
2.3 各组滑膜细胞IL-18与IL-1β、TNF-α的相关关系分析采用 Pearson相关分析,A、B、C、D 组 IL-1β、TNF-α 含量与 IL-18含量呈正相关(r=0.786,P<0.01)。
2.4 免疫组织化学分析 IL-18、IL-1β、TNF-α阳性结果为滑膜细胞胞质内出现棕黄色深染粒,免疫组化阴性对照仅见滑膜细胞阳性背景着色。B组、C组、D组与A组的IL-18、IL-1β、TNF-α表达率的图像分析即阳性细胞灰度值结果见表2,IL-18、IL-1β、TNF-α在A组表达率较高,于B组、C组、D组表达率相对较低,并随着氨基葡萄糖浓度的增加表达率逐渐降低(A组>B组>C组>D组)(P<0.05,P<0.01)。
表2 各组IL-18、IL-1β、TNF-α表达的免疫组织化学灰度值(±s,n=5)
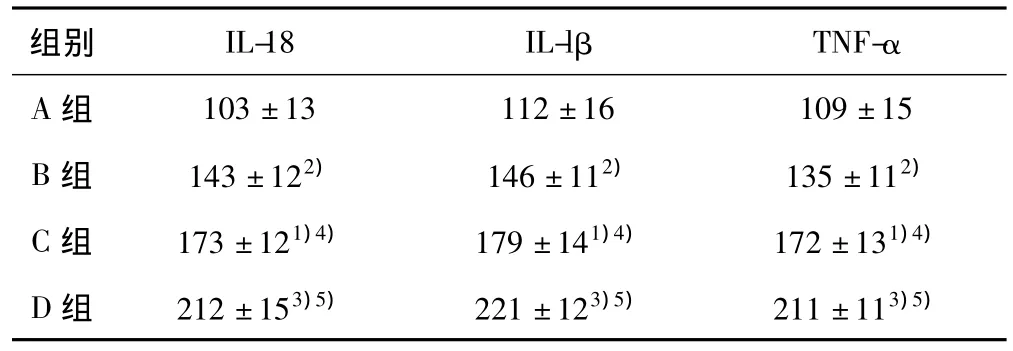
表2 各组IL-18、IL-1β、TNF-α表达的免疫组织化学灰度值(±s,n=5)
与A组比较:1)P<0.01,2)P<0.05;与 B组比较:3)P<0.01,4)P<0.05;与C组比较:5)P<0.05
组别 IL-18 IL-lβ TNF-α A组103±13 112±16 109±15 B组 143±122) 146±112) 135±112)C组 173±121)4) 179±141)4) 172±131)4)D组 212±153)5) 221±123)5) 211±113)5)
3 讨论
OA中关节软骨在致病因素作用下被破坏后,释放碎片进入滑液,刺激滑膜引起滑膜炎,滑膜炎释放炎性介质,进一步降解软骨,周而复始造成恶性循环,故滑膜炎症的存在是OA软骨损伤及OA慢性持续化的重要原因〔7〕。Smith等〔8〕在羊 OA模型中也证实有明显的滑膜炎病变。并有直接证据表明,滑膜炎的严重程度与OA的X线片分级呈明显的相关性〔9〕。减轻滑膜炎症的药物可显著改善关节的活动度,这些都表明滑膜炎是OA病情进展的重要环节。
IL-18的主要生物学功能为介导组织炎症反应,且与一些自身免疫性疾病相关〔10〕。Gracie等〔11〕在 OA的滑液和滑膜中测到的IL-18含量比健康人高,而且IL-18表达水平与关节炎活动期密切相关,并通过体外单独培养非OA患者及OA患者滑膜细胞,对细胞培养上清液进行IL-18检测,证实了IL-18不仅在在OA患者滑液和滑膜组织中含量较高,在OA患者病变滑膜细胞中亦存在高表达,Joosten等〔12〕通过对关节炎滑膜组织中IL-18水平表达的研究表明,OA关节滑膜滑液中的IL-18通过直接接触T淋巴细胞,使单核细胞产生的IL-1β和TNF-α增加,其表达与IL-1、TNF-α、局部滑膜的炎症程度有密切正相关关系,能提高和扩增两者水平,且与疾病急性阶段相平行,表明IL-18是关节炎中最初的一种重要的细胞因子。既往的研究表明炎性细胞因子IL-1β、TNF-α在OA的发生发展中发挥着重要作用,而IL-1β、TNF-α则是存在于OA软骨和滑液中的重要炎性细胞因子,能抑制软骨细胞增殖和代谢,诱导软骨细胞去分化,促进软骨基质降解〔13〕。
氨基葡萄糖是治疗OA的特异性药物,有研究显示氨基葡萄糖除能够刺激软骨细胞产生蛋白多糖,参与透明质酸和多聚氨基葡萄糖的合成外,同时具有抑制肉芽组织增生、血管渗出和细胞游离,有效改善关节炎的症状〔14〕。本文与Joosten等〔12〕的研究相一致,这说明IL-18是关节炎中最初的一种重要的始动细胞因子,氨基葡萄糖能够下调IL-18、IL-1β、TNF-α在OA滑膜细胞中的表达,减轻滑膜炎症,从而抑制软骨降解,达到治疗膝OA的目的。体外培养可以排除体内病变时全身免疫系统及内分泌系统可能对IL-18、IL-1β、TNF-α分泌造成的影响,能更直接地反映在OA病变中IL-18、IL-1β、TNF-α参与了滑膜细胞炎症反应的过程。
1 Brisdelli F,D'Andrea G,Bozzi A.Resveratrol:A natural polyphenol with multiple chemopreventive pro-perties〔J〕.Curr Drug Metab,2009;10(6):530-46.
2 Fabris S,Momo F,Ravagnan G,et al.Antioxidant properties of resveratrol and piceid on lipid peroxidation in micelles and monolamellar liposomes〔J〕.Biophys Chem,2008;135(1-3):7683.
3 皮俊杰,吕志伟,闫志荣,等.前交叉韧带切断诱导兔膝骨关节炎模型:阿仑磷酸钠与盐酸氨基葡萄糖对其关节软骨和软骨下骨的保护作用〔J〕.中国组织工程研究与临床康复,2010;14(28):5151-4.
4 包乐媛,李会强,毕晓阳,等.人滑膜细胞的分离培养与鉴定〔J〕.中国医学检验杂志,2004;5(2):386-8.
5 詹红生,赵咏芳,冯 伟.含药血清方法在中药调节骨与软骨代谢基础研究中的应用〔J〕.中国骨伤,2000;13(11):661-2.
6 司徒镇强,吴军正.细胞培养〔M〕.西安:世界图书出版西安公司,2004:21-3.
7 Haynes MK,Hume JB.Phenotypic characterization of inflammatory cells from osteoarthritic synovium and synovial fluids〔J〕.Clin Immunol,2002;105(23):315.
8 Smith MM,Cake MA,Ghosh P,et al.Significant Synorial pathology in a meniscectomy model of osteo-arthritis:modification by intra-articular hyaluronan therapy〔J〕.Rheumatology(Oxford),2008;47(12):1172-8.
9 Krasnokutsky S,Attur M,Palmer G,et al.Current concepts in the pathogenesis of osteoarthritis〔J〕.Osteoarthritis Cartilage,2008;16(Suppl 3):1-3.
10 Ushio S,Namba M,Okura T,et al.Cloning of the CDNA for human IFN-gamma-inducing factor,expression in Escherichia coli,and studies on the biologic activities of the protein〔J〕.Immunology,1996;156(25):4274.
11 Gracie JA,Foresy RL,Chan WJ,et al.A proinflammatory role for IL-18 in rheumatoid arthritis.Clin Invest,1999;104:1393-401.
12 Joosten L,Radstake TR,Lubberts E,et al.Association of interleukin-18 expression with enhance levels of both interleukin-1 beta and tumor necrosis factor alpha in knee synocial tissue of patients with rheumatoid arthritis〔J〕.Arthritis Rheum,2003;48(15):339-47.
13 Fernandes JC,Martel-Pelletier J,Pelletier JP.The role of cytokines in osteoarthritis pathophysiology〔J〕.Biorheology,2002;39(17):237-46.
14 张伟斌,庄澄宇,李健明,等.盐酸氨基葡萄糖治疗骨性关节炎有效性与安全性评价〔J〕.中华外科杂志,2007;45(14):998-1001.

