花旗松素、槲皮素对LPS诱导流产小鼠子宫巨噬细胞的抑制作用①
贾永芳 吴雷振 张瑞平 王丽霞 刘亚洁 张顺利
(河南师范大学生命科学学院 省部共建细胞分化调控国家重点实验室,新乡453007)
花旗松素和槲皮素专属性强,是水红花子的质量控制标准物,花旗松素是槲皮素的同分异构体,具有调节脂代谢、抗炎、抗氧化、抗辐射、抗病毒和抗肿瘤活性作用[1]。本研究团队已经发现水红花子水煎剂对LPS所致小鼠流产具有保胎作用,但其单体活性成分是否也具有类似的抗感染流产作用及其作用机制目前尚不清楚。而在由细菌感染引起的流产中,细菌脂多糖(LPS)起关键作用,它可以通过激活子宫巨噬细胞释放 TNF-α,而导致流产[2,3]。同时CD14是巨噬细胞重要的模式识别受体,又是介导LPS激活巨噬细胞的受体,在清除LPS过程中发挥重要作用[4]。本实验旨在通过观察花旗松素、槲皮素对LPS诱导流产小鼠子宫中非特异性酯酶阳性巨噬细胞和CD14阳性巨噬细胞数量和分布,分泌TNF-α含量的变化,从细胞、分子水平上阐明花旗松素和槲皮素的免疫抑制作用,从免疫药理学角度探讨其保胎机理,为其药效的进一步开发和寻找抗感染流产的新途径提供依据。
1 材料与方法
1.1 实验药品和器材 花旗松素(Taxifolin)和槲皮素(Quercetin)均购自南京泽朗医药有限公司;LPS(Sigma,美国,127k4048)购自北京鼎国生物技术有限公司;兔抗鼠 CD14抗体 (Santa Cruze,美国);生物素化的羊抗兔IgG和辣根过氧化酶标记链酶卵白素(Vector,美国);小鼠肿瘤坏死因子(TNF-α)ELISA试剂盒(R&Dsystems,美国);冰冻切片机(Reichert Histo,美国);酶标仪(ST-360,上海科华实验系统有限公司);LPS:用0.01 mol/L pH7.4的PBS 配制浓度为0.5 μg/ml的溶液。
1.2 实验动物 8周龄昆明种清洁级小鼠体重20~22 g,常规饲养,自由取食饮水。以阴道涂片法进行动情周期鉴定。取动情期雌鼠与雄鼠2∶1合笼过夜,次日清晨检出阴栓者定为孕1天。
1.3 动物分组及处理 孕鼠随机分为对照组(简称A组)和实验组。实验组又分为LPS处理流产模型组(简称B组)、低浓度花旗松素及LPS双处理组(简称C1组)、高浓度花旗松素及LPS双处理组(简称C2组)、低浓度槲皮素及LPS双处理组(简称D1组)、高浓度槲皮素及LPS双处理组(简称D2组)。每组小鼠15只。A、B组于孕2天开始每天灌胃PBS 0.4 ml,1 次/天;其中,A 组于孕 6 天尾静脉注射 PBS 0.2 ml;B组于孕 6天尾静脉注射 LPS 0.2 ml[5,6];C1 组于孕 2 天开始每天灌胃花旗松素50 mg/kg,连续灌胃至孕8天,其中在孕6天尾静脉注射LPS 0.2 ml;C2组:孕2天开始灌胃花旗松素250 mg/kg,连续灌至孕8天,其余同C1组;D1组:孕2天开始灌胃槲皮素50 mg/kg,连续灌至孕8天,其余同 C1组;D2组:孕 2天开始灌胃槲皮素250 mg/kg,连续灌至孕8天,其余同C1组。所有小鼠均于孕9天处死取子宫。每只小鼠左侧子宫角用于制备冰冻切片,右侧子宫角用于ELISA检测。
1.4 非特异性酯酶染色 左侧子宫角冰冻切片,横切6 μm,晾干。参照文献[7]进行非特异性酯酶(α-ANE)染色。
1.5 免疫组织化学染色 左侧子宫角冰冻切片6 μm,多聚甲醛固定 20分钟,分别用 0.3% 的H2O2,10%正常羊血清封闭非特异性染色。滴加1∶200兔抗鼠CD14一抗,按试剂盒要求进行免疫组织化学染色,镜检、照相。
1.6 子宫组织匀浆液制备和ELISA方法 将右侧子宫角置预冷PBS中剥去胚胎,冰浴匀浆,12 000 r/min,4℃离心15分钟,分装上清液,-20℃冻存。TNF-α检测按ELISA试剂盒说明书操作,酶标仪450 nm处读取OD值,标准曲线确定TNF-α含量。
1.7 胚胎吸收率计算、细胞计数和统计学分析 胚胎吸收率 =[死亡胚胎数/(死亡胚胎数+正常胚胎数)]×100%。每只动物取5张切片,细胞计数于10×40倍光镜下,每张切片随机选取6个视野,用CIS图像分析软件测量免疫组化阳性细胞数量、灰度值和阳性面积。数据以±s表示,统计分析采用SPSS13.0软件和组间t检验。
2 结果
2.1 花旗松素和槲皮素对小鼠胚胎发育的影响孕9天解剖孕鼠,A组15只中有2只出现明显流产迹象,胚胎形态明显小于正常胚胎,胎盘和胚胎有出血或坏死,呈黑褐色;而正常胚胎大小均匀,呈粉红色。B组孕鼠全部流产,胚胎吸收率100%,胎盘坏死,子宫内严重淤血,造模成功。C1、C2和D1组流产率和胚胎吸收率均略高于A组(P>0.05),D2组流产率较A组略有增加,胚胎吸收率显著高于A组(P<0.01);各双处理组流产率与B组相比下降,胚胎吸收率极显著降低(P<0.01)。结果详见表1。
2.2 花旗松素和槲皮素对小鼠子宫α-NAE+巨噬细胞的影响
2.2.1 花旗松素和槲皮素对小鼠子宫α-NAE+巨噬细胞数量和分布的影响 B组小鼠子宫内膜和肌层α-NAE+巨噬细胞数量均显著多于A组(P<0.01,图1A、B);C1组与A组相比,外膜巨噬细胞显著减少(P<0.05),但内膜及肌层已接近 A组(P>0.05,图1C)。C2组与 A组、B组相比,子宫各层 α-NAE+巨噬细胞数量均显著减少(P<0.05),内膜和肌层达到极显著水平(P<0.01)。D1组与A组相比,外膜显著降低(P<0.05),其他部位差异不显著;三层组织结构中巨噬细胞均显著低于B组(P<0.05)。D2组子宫内膜和肌层巨噬细胞数目显著高于A组,低于B组(P<0.01)。详见表2。
2.2.2 花旗松素和槲皮素对小鼠子宫α-NAE+巨噬细胞灰度值的影响 与A组相比,B组子宫内膜和肌层灰度值显著减少(P<0.05),外膜灰度值与A组无差异;D2组肌层灰度值显著降低(P<0.05);其他双处理组内膜与肌层和A组相比无显著差异,外膜较A组显著增加(P<0.05)。双处理组和B组相比均显著增加(P<0.05)。详见表2。
2.2.3 花旗松素和槲皮素对小鼠子宫巨噬细胞α-NAE+阳性反应面积的影响 与A组相比,B组子宫内膜和肌层巨噬细胞α-NAE+阳性反应面积显著增加(P<0.01)。C1、D1组内膜和肌层与A组相比差异不显著,较 B组显著下降(P<0.01)。C2组内、外膜阳性面积较A组显著减少,肌层降低(P<0.01)。D2组内膜和肌层较A组和其他双处理组极显著增加(P<0.01);内膜较B组极显著下降(P<0.01),肌层下降不显著。详见表2。
2.3 花旗松素和槲皮素对小鼠子宫CD14+巨噬的影响
2.3.1 花旗松素和槲皮素对小鼠子宫CD14+巨噬细胞数量和分布的影响 B组小鼠CD14+巨噬细胞数量与A组相比,内膜、肌层均显著增多(P<0.01),外膜与 A 组相似(图2A、B)。C1组、D1组与A组相比,肌层显著升高(P<0.01),外膜显著降低(P <0.05),内膜接近 A 组(P >0.05,图 2C)。C2组子宫内膜和外膜CD14+巨噬细胞数量均显著低于A组,肌层极显著高于A组 (P<0.01)。D2组内膜和肌层CD14+巨噬细胞均极显著高于A组(P<0.01),外膜低于 A 组(P <0.05)。各双处理组与B组相比,3层巨噬细胞数量均显著低于B组(P<0.05),内膜和肌层达到极显著水平(P<0.01)。详见表3。
2.3.2 花旗松素和槲皮素对小鼠子宫CD14+巨噬细胞灰度值的影响 B组子宫内膜和肌层CD14+巨噬细胞灰度值较A组显著减少(P<0.05),外膜差异不明显。C2组内膜和外膜均显著高于A组(P<0.05),肌层无显著差异。其它各双处理组内膜和肌层变化与A组近似,显著高于B组(P<0.05);外膜较A组和B组显著增加(P<0.05)。详见表3。
2.3.3 花旗松素和槲皮素对小鼠子宫CD14+巨噬细胞免疫反应阳性面积的影响 B组子宫内膜和肌层CD14+巨噬细胞阳性面积率较A组显著增加(P<0.01)。D2组肌层极显著高于A组和其它双处理组,低于B组(P<0.01),内膜和外膜与A组无显著差异。其他双处理组3层结构与B组相比均显著降低,其中内膜和肌层达到极显著水平(P<0.01);与A组相比内膜极显著降低(P<0.01),外膜显著降低(P <0.05),肌层显著升高(P <0.01);组间差异不显著。详见表3。

表1 各组小鼠的妊娠结果Tab.1 Pregnancy outcome of each group mice
表2 LPS、花旗松素和槲皮素对各组小鼠子宫α-NAE+巨噬细胞的影响(±s)Tab.2 Effect of LPS,taxifolin and quercetin on the α-NAE+macrophages in the uterine of each group mice(x±s)

表2 LPS、花旗松素和槲皮素对各组小鼠子宫α-NAE+巨噬细胞的影响(±s)Tab.2 Effect of LPS,taxifolin and quercetin on the α-NAE+macrophages in the uterine of each group mice(x±s)
Note:Data with different letters significantly differ(capitals means P <0.01,lowercase means P <0.05)among treatments.
Quantity Gray value Positive cell area Groups Endometrium Myometrium Perimetrium Endometrium Myometrium Perimetrium Endometrium Myometrium Perimetrium A 6.12 ±0.71A 2.81 ± 0.82A16.54 ±1.67a66.64 ±7.71a70.62 ±1.67a43.76 ±5.44a1.09% ± 0.001 1A0.95% ± 0.001 5A1.86% ±0.004 4a B 26.23 ±2.65B32.84 ±3.33B14.34 ±0.35a45.71 ±2.21b54.61 ±2.23b46.60 ±1.52a3.25% ± 0.008 3B2.87% ± 0.004 4B1.49% ±0.003 8ab C1 6.20 ± 1.18A2.88 ± 0.84A10.40 ±1.14bc64.64 ±7.71a69.56 ±2.14a61.32 ±5.58b0.89% ± 0.001 5A0.75% ± 0.001 9A1.37% ±0.003 1b C2 3.40 ± 0.91C1.40 ± 0.55C 8.24 ± 0.45c68.41 ±1.57a76.13 ±6.64a69.67 ±4.24b0.61% ± 0.001 9C0.51% ±0.002 3C1.32% ±0.003 4b D1 9.44 ± 1.14A2.54 ± 0.83A11.56 ±0.12b63.65 ±11.15a73.15 ±3.05a62.55 ±3.34b1.01% ± 0.002 1A0.88% ±0.001 9A1.48% ±0.002 3ab D2 20.58 ±2.52D16.25 ±3.22D12.75 ±0.15b58.45 ±2.61a61.00 ±3.32c63.75 ±8.91b2.49% ± 0.006 5D2.46% ±0.005 5B1.89% ±0.001 4a
2.4 花旗松素和槲皮素对小鼠子宫TNF-α含量的影响 子宫TNF-α含量(pg/ml;蛋白)在B组含量为45.36 ± 6.89,显著高于 A 组 25.38 ± 2.89(P<0.05)。C1 组为 26.23 ± 4.71,C2 组为29.25 ± 0.46,D1 组为 28.15 ± 3.84,D2 组为34.05±3.08,与A组相比无显著性差异;与B组相比均显著降低(P<0.05)。
表3 LPS、花旗松素和槲皮素对小鼠子宫CD14+巨噬细胞的影响(±s)Tab.3 Effect of LPS,taxifolin and quercetin on the CD14+macrophages in the uterine of each group mice(x±s)
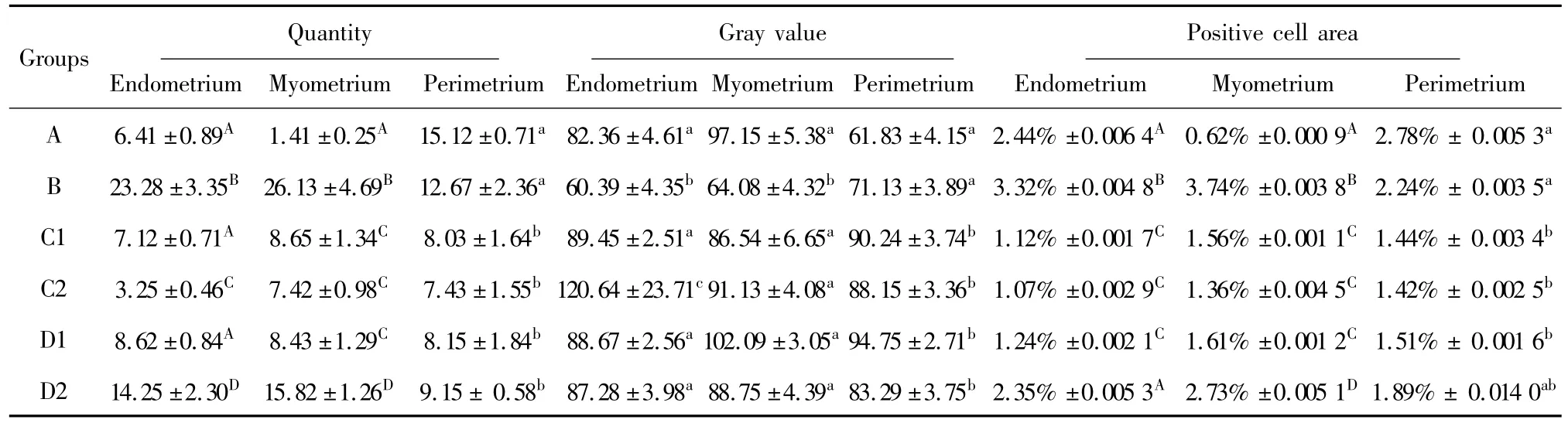
表3 LPS、花旗松素和槲皮素对小鼠子宫CD14+巨噬细胞的影响(±s)Tab.3 Effect of LPS,taxifolin and quercetin on the CD14+macrophages in the uterine of each group mice(x±s)
Note:Data with different letters significantly differ(capitals means P <0.01,lowercase means P <0.05)among treatments.
Quantity Gray value Positive cell area Groups images/BZ_258_233_538_2242_600.pngA 6.41 ±0.89A 1.41 ±0.25A 15.12 ±0.71a82.36 ±4.61a97.15 ±5.38a61.83 ±4.15a2.44% ±0.006 4A0.62% ±0.000 9A2.78% ± 0.005 3a B 23.28 ±3.35B 26.13 ±4.69B 12.67 ±2.36a60.39 ±4.35b64.08 ±4.32b71.13 ±3.89a3.32% ±0.004 8B3.74% ±0.003 8B2.24% ± 0.003 5a C1 7.12 ±0.71A 8.65 ±1.34C 8.03 ±1.64b 89.45 ±2.51a86.54 ±6.65a90.24 ±3.74b1.12% ±0.001 7C1.56% ±0.001 1C1.44% ± 0.003 4b C2 3.25 ±0.46C 7.42 ±0.98C 7.43 ±1.55b120.64 ±23.71c91.13 ±4.08a88.15 ±3.36b1.07% ±0.002 9C1.36% ±0.004 5C1.42% ± 0.002 5b D1 8.62 ±0.84A 8.43 ±1.29C 8.15 ±1.84b 88.67 ±2.56a102.09 ±3.05a94.75 ±2.71b1.24% ±0.002 1C1.61% ±0.001 2C1.51% ± 0.001 6b D2 14.25 ±2.30D 15.82 ±1.26D 9.15 ± 0.58b87.28 ±3.98a88.75 ±4.39a83.29 ±3.75b2.35% ±0.005 3A2.73% ±0.005 1D1.89% ± 0.014 0ab

图1 流产小鼠子宫非特异性酯酶染色Fig.1 Non-specific esterase staining in the uterine of abortion mice
3 讨论
LPS是革兰氏阴性菌细胞壁的重要组成成分,可诱发大鼠和小鼠的胚胎吸收[8,9]。王晓丹[5]报道,每只孕鼠在孕7天静脉注射0.1 μg LPS引起小鼠流产,本课题组在孕6天注射LPS即可引起小鼠全部流产,胚胎吸收率为100%,认为造模成功。而在孕2~8天预先灌胃孕鼠花旗松素或槲皮素,再注射LPS,孕鼠的流产率与流产模型组相比下降,胚胎吸收率极显著降低(P<0.01),说明花旗松素和槲皮素对LPS诱导的小鼠流产具有抑制作用。
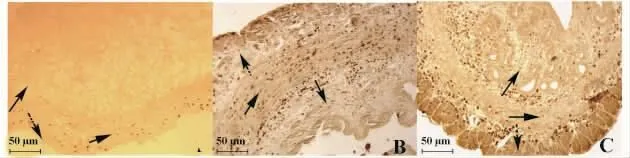
图2 流产小鼠子宫免疫组化染色Fig.2 Immunohistochemistry staining in the uterine of abortion mice
妊娠是一个免疫耐受的过程,小鼠胚胎着床和维持与子宫巨噬细胞的分布变化有关[10]。外源性LPS通过血浆中脂多糖结合蛋白(LBP)转运至单核/巨噬细胞膜表面,与CD14结合,启动LPS信号的细胞内转导[11],引起预致敏的巨噬细胞释放TNF-α[3],后者可直接引起胎盘滋养层细胞的凋亡[12],导致小鼠流产,提示 CD14是介导 LPS激活巨噬细胞的关键因素。本文实验结果显示,A组孕9天时,子宫内的CD14+巨噬细胞主要分布在外膜和内膜,在肌层内几乎没有分布。B组子宫内膜和肌层的CD14+巨噬细胞数和阳性面积显著的高于A组,灰度值显著小于A组,说明在LPS刺激后巨噬细胞CD14分子的表达增多,高表达的CD14分子作为巨噬细胞的重要的模式识别受体进一步介导LPS激活巨噬细胞,促进巨噬细胞释放大量的TNF-α。同时实验结果证实,B组小鼠子宫巨噬细胞CD14表达增加的同时伴随着TNF-α含量显著升高。B组外膜CD14+巨噬细胞数目与A组无显著差异,推测LPS有诱导巨噬细胞从子宫外部向子宫内膜迁移的作用,而各双处理组的内膜、肌层CD14+巨噬细胞数和阳性面积,TNF-α含量均极显著的低于B组,Daolin Tang[13]用 100 mg/kg 槲皮素处理由 LPS引起的脓毒症小鼠也发现血清TNF-α也下降显著(P<0.05)。提示一定剂量花旗松素和槲皮素对孕鼠的前期处理可以减少巨噬细胞CD14分子的表达,可能通过阻断LPS-LBP/CD14系统,在一定程度阻断抗原呈递,达到减弱LPS对巨噬细胞的激活作用。推测花旗松素和槲皮素对LPS导致的小鼠流产的保护作用与降低巨噬细胞CD14+的表达、巨噬细胞从子宫外向子宫内膜的迁移能力并抑制TNF-α的分泌有关。值得关注的是,用高浓度槲皮素处理的D2组的作用没有其它双处理组显著,尤其是在对内膜巨噬细胞迁移和CD14分子表达的抑制作用较其他双处理组明显降低,而高浓度花旗松素对C2组小鼠子宫内膜巨噬细胞CD14分子表达的抑制作用较其他双处理组明显增强,证实这种活性单体对LPS诱导流产小鼠子宫巨噬细胞有抑制作用,但其作用效果有差别,剂量是其原因之一。中药具有双向调节作用,在一定的剂量范围内,随着剂量的增加有的疗效会相应提高,有的疗效反而下降,甚至显示出相反的治疗作用。此外,除单味药的剂量对治疗功效的影响外,方剂中君臣佐使的配伍及其剂量比例也是中医处方的关键所在,因此,就槲皮素和花旗松素对巨噬细胞的抑制作用的分子机理以及与其他有效活性成分配伍之药效仍需深入研究,对其作为新型免疫抑制剂提供更详实的依据。
De等[14]的观察表明,与子宫腺区相邻的基蜕膜中,正常妊娠8天很少见到巨噬细胞,本实验也观察到相同的结果。实验结果表明,B组与A组相比,子宫内膜和肌层的α-NAE+巨噬细胞数量和阳性面积都极显著增加,说明LPS刺激后子宫内巨噬细胞非特异性酯酶的活性显著增强,使巨噬细胞水解能力增强,吞噬防御功能增强,而在这过程中也会产生大量的炎性细胞因子而导致流产。除D2组肌层外,其他双处理组子宫内膜和肌层的α-NAE+巨噬细胞数量和阳性面积与B组相比都极显著减少,说明预先口服不同浓度的花旗松素和槲皮素可以不同程度地阻止α-NAE+巨噬细胞由外膜向内膜迁移,降低非特异性酯酶的活性,从而减弱由巨噬细胞引起的炎症反应对胚胎的不利影响。
综上所述,花旗松素和槲皮素对子宫中巨噬细胞的抑制作用可能是通过阻止细胞的迁移、降低其α-NAE+活性和TNF-α的分泌,阻断LPS-LBP/CD14系统,进而在一定程度阻断抗原呈递,从而改变子宫免疫耐受的微环境实现的。
1 肖培根主编.新编中药志[M].北京:化学工业出版社,2007:760-760.
2 Clark D A,Chaouat G,Banwatt D et al.Ecology of danger-dependent cytokine-boosted spontaneous abortion in the CBA x DBA/2 mouse model:II Fecal LPS levels in colonies with different basal abortion rates[J].Am J Reprod Immunol,2008;60(6):529-533.
3 Beutler B,Greenwald D,Hulmes J D et al.Identity of tumour necrosis factor and the macrophage-secreted factor cachectin[J].Nature Lond,1985;316:552-554.
4 Van Der Laan L J,Dopp E A,Haworth R et al.Regulation and functional involvement of macrophage scavenger receptor MARCO in clearance of bacteria in vivo[J].J Immuno1,1999;15(162):939-947.
5 王晓丹,马爱团,姜国均et al.石菖蒲对LPS致流产小鼠的保胎作用及子宫免疫细胞的影响[J].中国兽医学报,2009;29(7):889-893.
6 王卫华,闫 坤,王丽霞et al.红藤对LPS诱导流产小鼠的保胎作用及子宫巨噬细胞的影响[J].中国免疫学杂志,2011;27(4):325-329.
7 陈啸梅.组织化学手册[M].北京:人民卫生出版社,1982:170-172.
8 Hunt J S.Cytokine networks in the uteroplacental unit:macrophages as pivotal regulatory cells[J].J Reprod Immunol,1989;16(1):1-17.
9 Aisemberg J,Vercelli C,Wolfson M et al.Inflammatory agents involved in septic miscarriage[J].Neuroimmunomodulation,2010;17(3):150-152.
10 贾永芳,李 莉,张顺利et al.妊娠早期小鼠子宫巨噬细胞分布和活性的变化[J].解剖学杂志,2009;32(1):49-51.
11 Gifford G E,Lohmann-Matthes M L.Gamma interferon priming of mouse and human macrophages for induction of tumor necrosis factor production by bacterial lipopolysaccharide[J].J Natl Cancer Inst,1987;78(1):121-124.
12 Otun H A,Lash G E,Innes B A et al.Effect of tumour necrosis factor-α in combination with interferon-γ on first trimester extravillous trophoblast invasion[J].J Reprod Immunol,2011;88(1):1-11.
13 Daolin Tang,Rui Kang,Weimin Xiao et al.Quercetin prevents LPS-induced high-mobility group Box 1 release and proinflammatory function[J].Am J Respir Cell Mol Biol,2009;41(6):651-660.
14 De M,Wood G W.Analysis of the number and distribution of macrophages,lymphocytes,and granulocytes in the mouse uterus from implantation through parturition[J].J Leukocyte Biol,1991;50(3):381-392.

