聚丙烯酰胺凝胶电泳分离恶性疟原虫pfs25膜蛋白的免疫原性研究
陈 勇 李 萍 张予超 雷 清 蒋 琳
(国药集团兰州生物制品研究所有限责任公司,兰州730046)
疟疾是通过蚊叮咬传播的寄生虫病,其病原体为疟原虫。pfs25蛋白质是位于恶性疟原虫子孢子囊表面的膜蛋白,该蛋白质在实验动物体内诱导产生抗体以阻断动合子的形成,是传播阻断型疟疾疫苗的候选靶抗原。美国NIH以pfs25蛋白质作为抗原制备的疫苗已经完成I期临床试验。
制备针对pfs25蛋白质的单克隆抗体,进而建立ELISA检测方法是研制基于pfs25蛋白的阻断型疟疾疫苗所必需的。本研究中,作者尝试用聚丙烯酰胺凝胶电泳纯化的方式获得pfs25蛋白纯品,免疫小鼠。用荧光光谱分析、酶联免疫吸附实验,分析了纯化过程中,pfs25蛋白的构像与免疫原性间的关系,并对引起免疫原性改变的原因进行了初步的探讨。
1 材料与方法
1.1 材料与仪器 标准蛋白质分子量购自GE公司。抗pfs25单克隆抗体4B7和标准pfs25蛋白由美国MR4惠赠;HRP标记兔抗鼠IgG购自Sigma公司;pfs25/pGAPZαA/GS115重组酵母菌为本室构建;多功能酶标仪Spectra Max M2e(MD公司)。硫酸铵及其它试剂为进口或国产分析纯。
1.2 实验方法
1.2.1 pfs25/pGAPZαA/GS115 重组酵母菌表达pfs25蛋白质[1]挑取阳性酵母重组菌 pfs25/pGAPZαA/GS115转接到3 ml BMGY液体培养基中,20 ml三角瓶,30℃、250 r/min摇床培养,每隔24小时取样,8 000 r/min离心 3分钟,取上清-20℃保存。目的基因表达时间截止到96小时。阴性对照菌株pGAPZαA/GS115同步培养并留样。
1.2.2 聚丙烯酰胺凝胶电泳纯化pfs25蛋白质及小鼠免疫 用6 000 r/min,15分钟离心重组菌的培养液,收集上清,加入硫酸铵至80%饱和度,4℃盐析,12小时。8 000 r/min,30分钟离心收集沉淀的蛋白质,进行常规SDS-PAGE制备电泳,分离胶的浓度为10%,浓缩胶的浓度为5%,考马斯亮蓝染色。刀片切除目的蛋白质条带,捣碎后加到垂直电泳管中。以50 mmol/L Tris-HCl,pH7.4 作为电泳缓冲液,120V电泳2小时。将纯化的pfs25蛋白质,以2.5 μg/只的剂量接种NIH小鼠,免疫程序:0、2、4周。
1.2.3 间接ELISA 三针免疫后一个月采集小鼠血样,用间接 ELISA检测血清抗体。即用 0.1 mol/L(pH9.6)的碳酸氢钠缓冲液10倍稀释小鼠血清后,4℃过夜;以含20%牛血清的0.02 mol/L PBS 37℃封闭1小时;依次加入pfs25单抗4B7、辣根过氧化物酶标记的兔抗小鼠IgG,其它按常规操作。TMB显色后终止反应,用酶标仪测其450 nm/630 nm双波长OD值。
1.2.4 双抗体夹心 ELISA[2]在用 2 μg/ml 的pfs25单抗4B7包被板中,加入电泳纯化的pfs25蛋白,浓度为 1.0 μg/ml,37℃,1.5 小时;洗板后,加入2 000倍稀释的辣根过氧化物酶标记pfs25单抗1B4作为二抗,37℃反应1小时;洗板后,TMB显色后终止反应,用酶标仪测其450 nm/630 nm双波长OD值。1.2.5 荧光光谱实验 用 pH7.4,50 mmol/L Tris-HCl溶解pfs25标准蛋白和电泳纯化的pfs25蛋白,浓度为0.1 mg/ml。用多功能酶标仪将以上两种pfs25蛋白质样品进行荧光光谱测定,以280 nm的激发光激发,记录样品在300~550 nm之间的发射光谱。
2 结果
2.1 聚丙烯酰胺凝胶电泳纯化pfs25蛋白质 首先按照文献[1]成功地进行了pfs25重组蛋白的表达,对表达的培养基上清进行80%饱和度硫酸铵沉淀后,pfs25蛋白得到了有效的浓缩。通过凝胶电泳纯化后,获得了纯度为93%的pfs25蛋白质纯品,结果见图1。
2.2 ELISA分析 采用双抗体夹心ELISA方法分析了电泳纯化的pfs25蛋白。图2的结果表明,电泳纯化的pfs25蛋白与抗体呈明显的阳性反应,这证明了制备电泳的纯化方式保留了该蛋白的抗原性。采用了间接ELISA方法分析了pfs25免疫小鼠的血清抗体效价,在对受试小鼠血清稀释10倍后,ELISA结果阴性(结果未列)。这说明经过聚丙烯酰胺凝胶电泳纯化pfs25蛋白质已经丧失了其免疫原性。

图1 SDS-PAGE分析重组pfs25蛋白质Fig.1 Analysis of recombinant pfs25 protein by SDS-PAGE
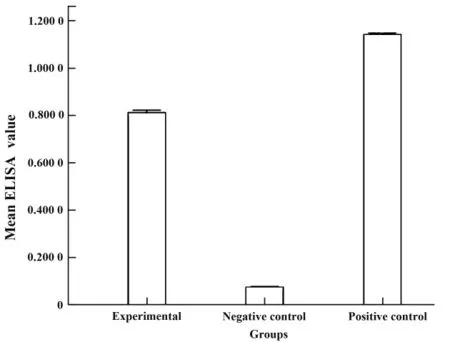
图2 双抗体夹心ELISA检测电泳纯化的pfs25蛋白Fig.2 Isolated pfs25 protein was identified by ELISA

图3 pfs25蛋白质在280 nm激发波长的荧光光谱Fig.3 Fluorescence emission spectra of pfs25 protein excited at 280 nm
2.3 荧光光谱 对pfs25标准品和经聚丙烯酰胺凝胶电泳纯化的pfs25蛋白质同时进行荧光光谱分析。如图3所示,pfs25标准品在25℃时,自身荧光强度最高。凝胶纯化电泳的pfs25蛋白质荧光响应,60℃时高于120℃,表现出对温度的负相关。同时也可以看到,由这两种蛋白质制备的三个样品,均在320~350 nm之间存在最高的荧光信号。
3 讨论
聚丙烯酰胺凝胶电泳是在上世纪六十年代应用于蛋白质研究,是一种常用的蛋白质分析技术。但在单克隆抗体制备或生物药物研发的早期摸索阶段,尤其是抗原来源困难的情况下,利用SDS-PAGE电泳作为蛋白质纯化手段,已在很多研究中得到应用[3-6],这主要是利用了电泳纯化目标蛋白质的快速、简便和有效的特点。但是,该方法的最大缺陷就是操作过程中造成的目标蛋白的变性。所以,该方法仅适合化学性质稳定的蛋白质。
蛋白质分子中能发射荧光的三种氨基酸残基为色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)。其中,Trp在280~290 nm的激发光下,发射的荧光强度最大。本研究中的目标蛋白质pfs25,由171个氨基酸组成,其中,不含有Trp,仅含3个 Tyr和3个Phe。能够产生荧光的氨基酸仅占pfs25蛋白总体的3.5%(6/171),若按照20种氨基酸的平均组成计算,3种氨基酸(Trp、Tyr和 Phe)应该有:3 ×(171 × 0.05)=25.65个,显然,pfs25蛋白是一种自身产生荧光很弱的蛋白质。由于该蛋白的一级序列中不存在荧光强度最大的色氨酸,就造成了该蛋白在280 nm处荧光强度很低,即在荧光光谱分析中标准pfs25的荧光强度也达不到200单位。此外,该蛋白质虽然不大,但在三维结构上,却包含9对二硫键,四个“EGF样结构域”。以上结构组成使得pfs25蛋白质的三级结构极为致密,肽链的扭曲程度高。通过SWISS-MODEL软件模拟的pfs25蛋白的空间结构分析,可以看出多数酪氨酸和苯丙氨酸位于分析内部的疏水区域,这样的分布有利于稳定荧光生色基团。而通过电泳纯化后的pfs25蛋白质中,空间分子结构趋于解离,这造成荧光产生氨基酸受到保护的疏水区域被破坏,使得酪氨酸和苯丙氨酸过多地暴露在溶剂中,降低了荧光强度。从荧光光谱分析中也可以看出,电泳纯化的pfs25蛋白在经过了120℃的加热处理后,荧光强度仅为标准品的30%。
本研究中,经电泳分离的毕赤酵母重组表达的pfs25蛋白质免疫小鼠后,受试动物没有获得预期的免疫效果,小鼠血清抗体阴性。初步认为:经过聚丙烯酰胺凝胶电泳纯化pfs25蛋白质虽保留了原蛋白的抗原的反应性,但丧失了免疫原性。对此,作者认为在电泳纯化pfs25蛋白质的样品制备过程时,加热和SDS的理化作用导致了该蛋白质结构改变和表位的破坏,丧失了其免疫原性。Wu的研究也表明[7],天然pfs25蛋白自身的免疫原性就不强,也从侧面证实了电泳分离的pfs25蛋白可能丧失免疫原性。
不同的蛋白质抗原,因性质差异在理化处理后可能对其免疫原性有不同的影响。在经过同样的高温处理后的大豆球蛋白和β-伴大豆球蛋白,前者的免疫原性完全丧失,而β-伴大豆球蛋白的免疫原性却仅是稍微下降[8]。可见蛋白质的免疫原性对蛋白质的结构特征有很强的要求,尤其是空间构像。此外,抗全长 Tat蛋白血清可以与艾滋病毒Tat蛋白N末端合成肽反应性,并非所有含N末端的 Tat抗原都能够诱导抗该区抗体[9]。同时,免疫原性是在整体动物水平进行的,影响实验的因素大为增加。而对于蛋白质的抗原性,只要保持与特异性抗体反应的氨基酸组成,ELISA检测多表现为阳性结果。况且,抗原性的检测通常是在体外进行,反应的可控性强,干扰因素较少。
1 陈 勇,雷 清,刘 晓et al 恶性疟原虫膜蛋白Pfs25在毕赤酵母中的组成型表达[J] 生物技术通讯,2011;22(6):785-788.
2 李 萍,马亚茹,陆 俭et al.Pfs25蛋白单克隆抗体的制备及双抗体夹心ELISA的建立[J].细胞与分子免疫学杂志,2011;27(12):1330-1334.
3 时永全,韩者艺,王 新et al.利用聚丙烯酰胺凝胶电泳纯化的微量蛋白制备抗血清[J].细胞与分子免疫学杂志,2002;18(6):621-623.
4 石丽媛,杨光璨,董珊珊 et al.SDS-PAGE制备凝胶纯化鼠疫菌Pla蛋白[J].医学动物防治,2008;24(12):906-907.
5 蔡 瑜,向本春,席德慧et al.苹果褪绿叶斑病毒库尔勒分离物外壳蛋白基因的克隆、原核表达及特异抗血清的制备[J].农业生物技术学报,2005;13(4):533-537.
6 Guinee P A M,Jansen W H,Agterberg C M.Detection of the K99 antigen by means of agglutination and immunoelectrophoresis in Escherichia coli isolates from calves and its correlation with enterotoxigenicity[J]Infection and Immunity,1976;13(5):1369-1377.
7 Yimin Wu,Ellis R D,Donna Shaffer et al.Phase 1 trial of malaria transmission blocking vaccine candidates Pfs25 and Pvs25 formulated with montanide ISA 51[J].PLoS ONE,2008;3(7):e2636.
8 孙 鹏,秦贵信.蒸汽处理对纯化大豆抗原含量及免疫原性的影响[J].中国兽医学报,2006;26(5):551-554.
9 张华群,廖文婷,陈秋莉et al.人类免疫缺陷病毒1型Tat蛋白N末端缺失突变体融合蛋白的表达及其免疫原性分析[J].病毒学报,2011;27(6):580-586.

