胃癌组织VEGF表达及血清VEGF浓度与DCs浸润及其活性的关联分析①
肖炜明 吴克艳 龚卫娟 丁岩冰 王 艳 卜 平
(扬州大学第二临床医学院消化内科,扬州225001)
血管内皮生长因子(Vascular endothelial growth factor,VEGF)被认为是一种重要的促肿瘤生长因子。其不仅通过旁分泌途径刺激肿瘤血管内皮细胞增生、迁移,诱导血管形成而促进肿瘤生长;还具有增强血管通透性,促进单核细胞、成纤维细胞及内皮细胞浸润,有利于肿瘤基质形成,促进肿瘤转移的活性[1,2]。另外,VEGF 还具有免疫调节功能,可通过降低体内免疫监视功能而促进免疫逃逸[3,4]。树突状细胞(Dendritic cells,DCs)作为体内功能最强的抗原递呈细胞,具有很强的摄取、加工、递呈抗原的能力,从而激发抗原特异性的T细胞免疫反应,既往研究也已经证实DCs的浸润及其功能与胃癌的预后、TNM 分期等密切相关[5,6]。因此,本文试图观察胃癌组织VEGF表达强度、血清VEGF浓度分别与胃癌组织内DCs浸润密度的关系,胃癌组织内VEGF阳性DCs浸润频率与胃癌发生与发展的关联;胃癌患者与健康个体外周血单核来源DCs表面HLA-DR和CD86的表达,从而深入揭示VEGF调节DCs活性参与胃癌发病及转移的分子机制。
1 材料与方法
1.1 临床资料 收集2009年4月至2012年7月经我院外科手术,病理证实为胃癌的组织标本142例,其中男性101例,女性41例,平均年龄(61.94±10.23)岁。所有入选病例均无长期使用非甾体消炎药和糖皮质激素类药,术前均未接受过放疗或化疗。肿瘤组织学类型按WHO分级,高中分化腺癌76例,低/未分化腺癌66例;肿瘤大小:<5 cm者81例,≥5 cm者61例;发生局部淋巴结转移者97例,无局部淋巴转移者45例;未侵及浆膜层者60例,侵及浆膜层者82例;根据2010年国际抗癌联盟(UICC)颁布的第7版胃癌TNM分期系统进行临床分期:Ⅰ期/Ⅱ期74例,Ⅲ期/Ⅳ 期68例。随机选取37例癌旁组织作为对照组,并经过病理检查排除累及肿瘤。随机取20例患者血清,其中男性13例,女性7例,平均年龄(57.90±12.43)岁;健康个体20例,其中男性 12例,女性 8例,平均年龄(56.91±9.68)岁。随机取5例胃癌患者和5例健康个体外周血单个核细胞(PBMC),经体外诱导为DCs。
1.2 实验材料 鼠抗人VEGF单克隆抗体(mAb)购自Santa Cruz公司;Alex488标记的驴抗鼠、羊抗兔抗体购自Invitrogen公司;兔抗人CD11c抗体购自武汉博士德公司;APC-CD11c mAb、FITC-HLA-DR mAb、PE-CD86 mAb来自 Biolegend公司;人 VEGF ELISA检测试剂盒购自深圳达科为公司;DAPI封片剂购自 VECTASHIELD公司;重组人 GM-CSF、IL-4购自PeproTech公司;重组人VEGF蛋白(rhVEGF)购自R&D公司;外周血淋巴细胞分离液(Ficoll)购自挪威Axis-shield公司。
1.3 方法
1.3.1 免疫荧光法检测肿瘤组织 VEGF表达及DCs密度 肿瘤组织经10%甲醛溶液固定,石蜡包埋,常规切片,厚4 μm。石蜡切片脱蜡后,梯度酒精水化,95~99℃水浴抗原修复,自然冷却至室温,2%驴或山羊血清室温封闭30分钟。然后孵育鼠抗人VEGF(1∶50 稀释)及兔抗人 CD11c(1∶50 稀释)抗体4℃过夜。PBS洗涤后,同时孵育驴抗鼠、羊抗兔荧光二抗(1∶1 000稀释)37℃避光孵育30分钟,PBS洗涤,自然晾干后,滴加DAPI封片,荧光显微镜观察。
1.3.2 CD11c阳性细胞判断标准 细胞形态完整且不规则,胞浆有明显突起,分布在肿瘤细胞间和(或)肿瘤间质内。红色荧光特异地定位于胞膜内的细胞为阳性细胞。染色结果按参考文献[7]判断:阴性(-)没有或仅有少许染色细胞;阳性(+)散在的染色细胞;阳性(++)癌巢多个染色细胞;阳性(+++)弥散的染色细胞。
1.3.3 VEGF阳性细胞判断标准 细胞形态完整,胞浆着绿色荧光,染色结果判断分别按阳性染色细胞百分数及染色强度计分[8]。阳性细胞数为0,计0分;1%~10%计1分;11% ~50%计2分;51%~75%计3分;>75%计4分。染色阴性计0分;淡绿色计1分;绿色计2分;深绿色计3分。两种积分相加,积分为0~2分,表示阴性(-);积分≥3分为阳性。其中积分为3分,表示阳性(+);积分为4~5分,表示阳性(++);积分为6~7分,表示阳性(+++)。
1.3.4 酶联免疫吸附试验(ELISA)检测血清VEGF浓度 按试剂盒提供的操作说明进行,主要步骤:加血清至各检测孔,室温孵育2小时;洗板3次,加检测抗体;混匀后盖上封板膜,室温孵育2小时;洗板3次,加酶标记底物。盖上封板膜,室温孵育20分钟;洗板3次;加入TMB显色,室温避光温育20分钟终止反应;10分钟内在波长450 nm读值。根据标准品绘制标准曲线,计算各检测孔内VEGF浓度。
1.3.5 外周血单核细胞诱导为DCs 利用Ficoll分离外周血单个核细胞,调整细胞密度为2×106ml-1。将细胞铺于 24 孔板中培养,每孔 500 μl,约1×106个细胞/孔,并加细胞因子 GM-CSF(100 ng/ml)、IL-4(40 ng/ml),37℃,5%CO2孵箱培养。隔日半量换液,培养5天诱导成DCs。
1.3.6 DCs表面 HLA-DR和 CD86表达的检测
取外周血单核细胞诱导而来的细胞悬液,经PBS洗涤后加入 APC-CD11c mAb、FITC-HLA-DR mAb、PECD86 mAb 4℃避光孵育30分钟后,PBS洗涤后400 μl重悬。利用FACS Calibur流式细胞仪,Cellquest软件计数104个细胞,选取CD11c阳性细胞,进而分析HLA-DR及CD86的表达。
1.3.7 重组VEGF(rhVEGF)对DCs表达HLA-DR、CD86的影响 将正常个体和胃癌患者PBMC诱导为未成熟DC后,实验分组加rhVEGF 100 ng/ml,对照组不加药物,两组分别刺激未成熟DC 24小时后,FCM检测DC表达CD86的情况。
1.4 统计学分析 胃癌与癌旁组织VEGF表达、DCs浸润密度的比较采取χ2检验分析;VEGF表达强度与DCs浸润密度的关联采取Spearman等级相关分析;VEGF、DCs双阳性细胞与TNM及淋巴结转移的关联性分析采用秩和检验;胃癌患者血清VEGF浓度与健康个体的比较、HLA-DR及CD86阳性DCs频率的比较均采取t检验。P<0.05有统计学意义。
2 结果
2.1 胃癌组织VEGF表达与DC浸润密度的关联分析 首先对胃癌组织和癌旁组织分别用VEGF和CD11c的抗体进行免疫荧光染色,发现胃癌组织VEGF阳性表达率 56.33%(图 1)、而癌旁组织VEGF阳性表达率仅为18.91%。另外,胃癌组织内CD11c+细胞的表达阳性率为60.56%(图1)、而癌旁组织的阳性表达率为62.16%。结果显示胃癌组织中VEGF阳性表达率明显高于癌旁组织(χ2=16.452,P <0.001);而 CD11c+细胞表达率略低于癌旁组织(χ2=0.032,P=0.859),但统计学无意义。为进一步明确肿瘤组织VEGF表达是否与DCs浸润密度有相关性,对胃癌组织VEGF表达情况和DCs浸润情况分别判定为“-、+、++、+++”4个等级,利用Spearman等级相关分析,发现VEGF表达强度与 DCs浸润程度呈反向关联(表1,rS=-0.426,P <0.001),提示胃癌细胞可通过分泌VEGF抑制肿瘤组织内DCs的浸润。

图1 免疫荧光法检测胃癌组织内VEGF和CD11c阳性的细胞(×200)Fig.1 VEGF and CD11c staining in gastric cancer tissues detected by immunofluorescence technique(×200)

表1 胃癌细胞VEGF表达水平与DC密度相关性分析Tab.1 Correlation study of VEGF expression level in cancer cells and density of tumor-infiltrating DCs
2.2 胃癌组织VEGF阳性DCs浸润的频率与胃癌分期及淋巴结转移的关联分析 国内外研究发现,肿瘤组织内DCs可分泌VEGF、内皮素-1等参与肿瘤血管生成,特别是肿瘤局部微环境PGE2和钙三醇的刺激可诱导DCs分泌大量的VEGF,进而介导肿瘤血管生成和免疫逃逸[9]。因此本研究分析了胃癌组织和癌旁组织内CD11c+VEGF+双阳性细胞的密度(图 2),结果发现,胃癌组织中 CD11c+VEGF+双阳性细胞频率为43.66%,癌旁组织双阳性细胞率为10.81%,胃癌组织中双阳性细胞表达率明显高于癌旁组织(表 2,χ2=14.112,P=0.001)。另外,我们分析了CD11c+VEGF+细胞密度与TNM分期、淋巴结转移的关联性(表3:Z=-2.367,P=0.018;表 4:Z= - 2.574,P=0.010),结果显示CD11c+VEGF+细胞密度与疾病的进展、局部淋巴结转移均正相关。

图2 双色荧光标记检测胃癌组织内VEGF和CD11c双阳性细胞(×200)Fig.2 Immunofluorescent staining of VEGF and CD11c double positive cells in gastric cancer tissues(×200)
2.3 血清VEGF浓度及肿瘤组织内DC浸润密度的关联分析 为分析胃癌患者血清VEGF浓度和肿瘤组织内DC浸润密度是否关联,我们首先比较20例胃癌患者和20例健康个体血清内VEGF水平。结果发现,胃癌患者血清内 VEGF浓度均值为(354.98 ±231.11)pg/ml,而健康个体 VEGF 浓度均值为(66.11 ±62.86)pg/ml,胃癌患者血清内 VEGF浓度显著增高(图3,t=5.394,P <0.001)。进一步分析胃癌患者血清VEGF浓度与肿瘤组织内DCs密度的关联,发现二者没有明显的关联性(rS=0.114,P=0.63)。提示血清VEGF浓度对肿瘤组织内DCs迁移没有影响。
2.4 胃癌外周血单核细胞来源DCs表面HLA-DR及CD86表达的检测 为观察胃癌患者体内DCs细胞的活性状态,分离5例胃癌和5例健康个体外周血单核细胞,经GM-CSF和IL-4诱导为DCs,分别检测CD11c细胞表面MHCⅡ类分子(HLA-DR)和共刺激分子CD86的表达。HLA-DR在健康个体及胃癌患者表达率分别为(99.86 ±0.06)%、(84.44 ±8.73)%(t=4.241,P=0.003);CD86 在健康个体及胃癌患者表达率分别为(62.48±10.46)%、(40.82 ±5.42)%(t=4.111,P=0.003)(图 4 ~6)。结果显示,与健康个体相比,胃癌患者外周血单个核细胞来源DCs表面HLA-DR和CD86的表达均降低。为分析DCs表面CD86表达的降低是否与胃癌血清高水平VEGF有关,我们将rhVEGF作用胃癌患者来源的DCs细胞,测得rhVEGF组的CD86表达为(37.94±6.36)%,对照组为(56.70±7.80)%,(t=5.104,P=0.001);而 rhVEGF 作用健康个体来源的 DCs细胞,rhVEGF组的 CD86为(54.30 ±3.81)%,对照组为(57.08 ±6.43)%,(t=0.832,P=0.430)(图 7)。结果证实重组VEGF可直接下调胃癌患者 DCs表面 CD86的表达。

表2 胃癌与癌旁组织内CD11c+VEGF+细胞密度比较Tab.2 Comparative analysis of density of CD11c+VEGF+cells in gastric cancer tissues and adjacent tissues

表3 肿瘤组织内CD11c+VEGF+细胞密度与TNM分期关联性分析Tab.3 Correlation study of density of CD11c+VEGF+cells in tumor tissues with TNM stages

表4 肿瘤组织内CD11c+VEGF+细胞密度与淋巴结转移关联性分析Tab.4 Association correlation study of densitiesof CD11c+VEGF+cells in tumor tissues with lymph node metastasis

图3 胃癌患者血清VEGF浓度较正常个体显著增高Fig.3 Serum level of VEGF is higher in gastric cancer patients than healthy controls
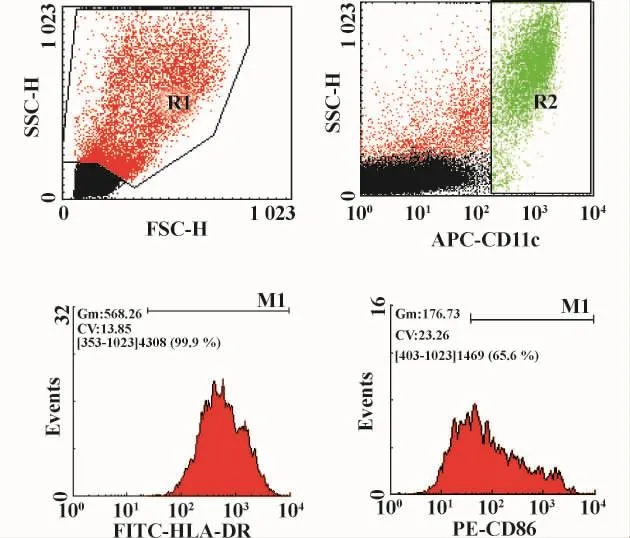
图4 外周血单核细胞诱导而来DCs表面HLA-DR和CD86的检测Fig.4 Detection of HLA-DR and CD86 expression on peripheral blood monocyte-derived DCs by flow cytometry
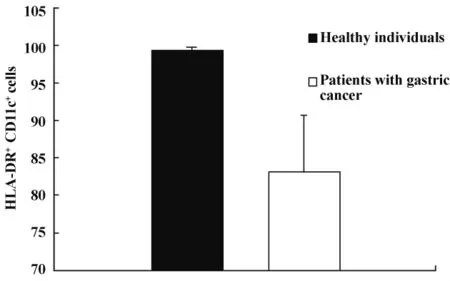
图5 胃癌患者外周血单核细胞来源DCs表面HLA-DR的表达降低Fig.5 Decreased expression of HLA-DR on peripheral monocyte-derived DCs in gastric cancer

图6 胃癌患者外周血单核细胞来源DCs表面CD86的表达降低Fig.6 Decreased expression of CD86 on peripheral monocyte-derived DCs in gastric cancer

图7 重组VEGF下调胃癌患者外周血单核细胞来源DCs表面表达HLA-CD86Fig.7 Recombinant VEGF down-regulated CD86 expression on DCs in gastric cancer
3 讨论
本研究基于胃癌临床标本,首先利用免疫荧光和ELISA方法分别分析了肿瘤组织内胃癌细胞VEGF表达、血清VEGF浓度与肿瘤组织内DCs浸润密度的关联,发现胃癌细胞原位表达VEGF与DCs浸润存在明显的负相关,而血清VEGF浓度对肿瘤DCs浸润无明显影响,提示肿瘤微环境内高浓度VEGF表达可通过抑制DCs的迁移或分化,从而介导免疫逃逸。另外,本研究比较了胃癌组织与癌旁组织分泌VEGF的DCs频率,发现癌组织内DCs分泌VEGF的频率显著高于癌旁组织,提示肿瘤组织内浸润的DCs可能通过分泌VEGF来促进肿瘤血管生成而参与疾病进展。最后,本研究证实外周血单核细胞来源DCs表面HLA-DR和CD86的表达均降低,且重组VEGF可直接抑制DCs表达CD86,说明胃癌患者体内DCs处于低活性或负向免疫调节状态。因此,本研究为VEGF参与胃癌进展及免疫逃逸提供了直接依据。
肿瘤细胞在低氧状态时分泌大量VEGF,促进肿瘤局部新生血管的生成,且同时抑制局部DCs的功能。国外研究证实VEGF在体外和体内抑制DCs细胞的分化、以及抑制LPS诱导的DCs成熟,抑制DCs分泌 IL-12[10,11]。给小鼠注射重组 VEGF 蛋白可拮抗FILT3对DCs的刺激作用[12]。在肿瘤细胞和DCs共培养体系中,加入 VEGF抗体,可促进CD34+细胞向DCs的分化[13]。本研究证实胃癌细胞分泌VEGF与DCs浸润呈负相关,但胃癌细胞来源的VEGF是直接抑制DCs的浸润还是抑制DCs源自造血干细胞的分化发育过程,尚需深入研究。
血清高水平VEGF促进肿瘤患者的进展,与外周血循环DCs的密度呈负相关[14]。本研究则显示血清VEGF水平与肿瘤浸润DCs无关,这提示肿瘤组织内DCs活性主要受局部肿瘤细胞来源VEGF的影响。另外,胃癌患者外周血单核细胞来源的DCs表面HLA-DR和CD86均降低,而重组VEGF直接抑制DCs表达CD86,但VEGF是否直接影响DCs对CD4+T/CD8+T细胞的活化,或发挥调节性DCs的活性,促进调节性T细胞(Treg)的产生、增殖及活性,需要深入分析。
肿瘤组织内肿瘤细胞和局部浸润的DCs之间存在相互作用(Crosstalk),特别在肿瘤晚期,肿瘤细胞来源的IL-10、TGF-β、PGE2往往诱导局部DCs具有免疫调节和耐受活性,而不是免疫激活功能,主要表现为低表达 TLR4、MHC Ⅱ类分子、CD40、CD80、CD86 和 IL-12,而分泌较多 IL-10[15]。我们在胃癌组织内发现了较高频率VEGF阳性的DCs细胞,且其与临床分期及淋巴结转移均呈正相关性,提示该群DCs具有免疫调节活性,但这群DCs在胃癌组织内如何被诱导产生以及其他表型特点需要深入研究,进而对筛选有效抑制该群DCs活性或诱导DCs向免疫激活方向分化的药物具有重要意义。
综上所述,胃癌细胞VEGF的表达强度与肿瘤组织DCs浸润密度负相关,而胃癌患者血清高浓度VEGF与其外周血单核细胞来源的DCs表面HLADR和CD86表达降低有关,肿瘤组织内分泌VEGF的DCs频率与胃癌进展呈正相关,提示采取靶向抑制肿瘤细胞分泌VEGF和增强DCs功能的治疗方法,将有望取得较好的抗肿瘤治疗效果。
1 Tie J,Desai J.Antiangiogenic therapies targeting the vascular endothelia growth factor signaling system[J].Crit Rev Oncog,2012;17(1):51-67.
2 Eichmann A,Simons M.VEGF signaling inside vascular endothelial cells and beyond[J].Curr Opin Cell Biol,2012;24(2):188-193.
3 Kim H,Kataru R P,Koh G Y.Regulation and implications of inflammatory lymphangiogenesis[J].Trends Immunol,2012;33(7):350-356.
4 Sheng K C,Wright M D,Apostolopoulos V.Inflammatory mediators hold the key to dendritic cell suppression and tumor progression[J].Curr Med Chem,2011;18(36):5507-5518.
5 黄海力,吴本俨,龙伟缔et al.树突状细胞浸润对进展期胃癌生物学行为和预后的影响[J].中华肿瘤学杂志,2003;25(5):468-471.
6 Nat sugoe S,Tokuda K,Nakajo A et al.Clinical impact of intratumoralnatural killer cell and dendritic cell infiltration in gastric cancer[J].Cancer Lett,2000;159(1):103-108.
7 Ohashi S,Okamura S,Urano F et al.Clinicopathological variables associated with lymph node metastasis in submucosal invasive gastric cancer[J].Gastric Cancer,2007;10(4):241-250.
8 Blanchot-Jossic F,Jarry A,Masson D et al.Up-regulated expression of ADAM17 in human colon carcinoma:co-expression with EGFR in neoplastic and endothelial cells[J].J Pathol,2005;207(2):156-163.
9 Sozzani S,Rusnati M,Riboldi E et al.Dendritic cell-endothelial cell cross-talk in angiogenesis [J].Trends Immunol,2007;28(9):385-392.
10 Bennaceur K,Chapman J,Brikci-Nigassa L et al.Dendritic cells dysfunction in tumour environment[J].Cancer Lett,2008;272(2):186-196.
11 Lissoni P,Malugani F,Bonfanti A et al.Abnormally enhanced blood concentrations of vascular endothelial growth factor(VEGF)in metastatic cancer patients and their relation to circulating dendritic cells,IL-12 and endothelin-1[J].J Biol Regul Homeost Agents,2001;15(2):140-144.
12 Ohm J E,Shurin M R,Esche C et al.Effect of vascular endothelial growth factor and FLT3 ligand on dendritic cell generation in vivo[J].J Immunol,1999;163(6):3260-3268.
13 Michielsen A J,Hogan A E,Marry J et al.Tumour tissue microenvironment can inhibit dendritic cell maturation in colorectal cancer[J].PLoS One,2011;6(11):e27944.
14 Huang A,Gilmour J W,Imami N et al.Increased serum transforming growth factor-beta1 in human colorectal cancer correlates with reduced circulating dendritic cells and increased colonic Langerhans cell infiltration [J].Clin Exp Immunol,2003;134(2):270-278.
15 Ma Y,Shurin G V,Gutkin D W et al.Tumor associated regulatory dendritic cells[J].Semin Cancer Biol,2012;22(4):298-306.

