布鲁生诱导人胶质瘤SHG-44细胞凋亡的机制
王光明 吴雪梅 王睿君 杨福伟 赵洪卫 付双林 (吉林大学第一医院神经外科,吉林 长春 3002)
虽然胶质瘤的发病率较低,但它存在着较高的病死率。目前常规的治疗手段仍然是手术及术后辅以放、化疗,但并不能完全去除或杀死颅内的肿瘤细胞。因此,找到一种合理有效的治疗药物成为神经外科医生急需解决的问题〔1〕。布鲁生是中药马钱子有效成分之一,具有镇痛、免疫抑制、抗炎和抑制血小板聚集等多种药理活性。近年来人们研究发现,布鲁生具有明显抑制胃癌、肺癌、前列腺癌生长的作用,并诱导其凋亡〔2,3〕。本实验探讨布鲁生的抗胶质瘤作用机制及环氧合酶(COX)-2表达的关系,为布鲁生的临床应用提供必要的理论依据。
1 材料与方法
1.1 试剂 布鲁生购自美国Bellancom公司。DMEM培养液和胎牛血清购自美国Invitrogen公司。MTT为美国Sigma公司产品。吖啶橙(AO)/溴乙啶(EB)均购于碧云天公司。PI、Annexin V-FITC细胞凋亡检测试剂盒为美国Sigma公司产品。抗BCL-2、BAX、COX-2鼠单抗IgG、辣根过氧化物酶(HRP)标记的抗兔、抗鼠二抗均购自碧云天生物研究所。ECL化学发光检测试剂盒购自美国Pierce公司。
1.2 方法
1.2.1 细胞培养 人胶质瘤SHG-44细胞购自中科院上海细胞研究所,予含10%胎牛血清的DMEM培养液,在5%CO2饱和湿度的37℃孵箱中培养,细胞长满后经胰酶消化法传代。
1.2.2 MTT法测细胞成长抑制率 取对数生长期的SHG-44细胞,消化、计数,调整密度为6×104/ml,接种于96孔培养板,每孔100 μl。每组分别设6个复孔,细胞贴壁生长18 h后,更换DMEM培养液。分别培养12、24、48 h,实验组加入含不同浓度布鲁生的培养液,终浓度为0.125、0.25、0.5、1.0、1.5 mmol/L,对照组加入等量DMEM培养液。分别培养12、24、48 h。每孔加入 MTT溶液(5 mg/ml)20 μl。4 h后吸取孔内的培养液。加入DMSO后,振荡10 min使其内甲瓒充分溶解。在酶标仪上检测各孔的吸光度(490 nm激发波长)值,重复检测3次,取平均值。与对照组比较,计算各组细胞生长抑制率。生长抑制率(%)=(1-实验组 OD值/对照组 OD值)×100%。
1.2.3 吖啶橙(AO)/溴乙啶(EB)染色观察 取对数生长期的SHG-44细胞,消化、计数,调整密度为6×104/ml接种于96孔培养板,每孔100 μl。每组分别设6个复孔,细胞贴壁生长18 h后,更换DMEM培养液。分别培养24 h,实验组加入含不同浓度布鲁生的培养液,终浓度为0.25、0.5、1.0 mmol/L,对照组加入等量DMEM培养液,继续培养24 h。吸净DMEM培养液,50 μl PBS液洗一遍,再加入50 μl PBS液后,加入预配好的AO、EB(10 mg/ml)各1 μl,避光2 min 后,荧光显微镜下以蓝色激发光观察细胞形态及颜色并照相。
1.2.4 流式细胞仪分析细胞周期变化 取对数生长期SHG-44细胞,消化、计数,调整密度为2×105/ml,培养瓶每瓶接种细胞1 ml,37℃培养18 h后更换实验用培养液。实验组加入含0.25、0.5、1.0 mmol/L布鲁生的培养液,对照组加入等量DMEM培养液,作用24 h后分别终止培养。用胰酶消化细胞,预冷PBS洗涤2遍,加入FITC标记的Annexin V(2 μl),冰上温育20 min,迅速加入PI(1 μg/ml),于流式细胞仪 FACS Calibur(Becton Dickson,USA)上检测细胞凋亡情况,Annexin V阴性/PI阴性为正常细胞;Annexin V阳性/PI阴性为早期凋亡细胞;Annexin V阳性/PI阳性为晚期凋亡细胞。
1.2.5 Western蛋白印迹法检测细胞中BCL-2、BAX、COX-2的表达情况 取对数生长期SHG-44细胞,消化、计数,调整密度为106/ml,培养瓶每瓶接种细胞1 ml,37℃培养18 h后更换培养液。实验组加入含0.25、0.5、1.0 μmol/L布鲁生的培养液,对照组加入等量DMEM培养液,作用24 h后分别终止培养。用细胞刮刀刮取贴壁细胞,连同培养液一同离心收集细胞。蛋白抽提方法和Western蛋白印迹法参照碧云天公司说明书。使用BCA法测定蛋白浓度,β-actin作为参照。
1.3 统计学处理 应用SPSS11.0统计软件,多组比较进行单因素方差分析,两两比较进行Student t检验。
2 结果
2.1 MTT法检测细胞存活率 不同剂量(0.125、0.25、0.5、1.0、1.5 mmol/L)布鲁生分别处理 SHG-44 细胞12、24、48 h 后,细胞存活率呈现时间依赖性和剂量依赖性地降低。0.5 mmol/L的布鲁生对SHG-44细胞作用24 h的存活抑制率达到66.8%,说明SHG44细胞的生长能被布鲁生有效的抑制。见图1。
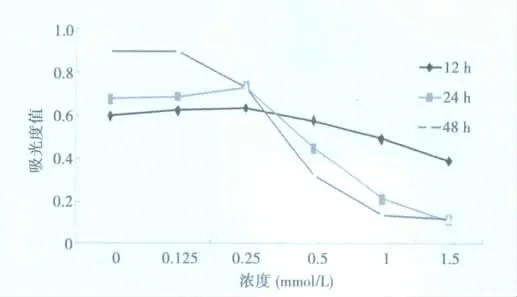
图1 MTT显示不同浓度/时间的布鲁生对SHG-44细胞生长和增殖的影响

图2 AO/EB染色显示不同浓度的布鲁生作用SHG-44细胞24 h
2.2 AO/EB染色和流式细胞术检测细胞凋亡 实验组与对照组经AO/EB染色后均在电子荧光显微镜下经BV滤片激发,可观察到对照组核染色质着绿色荧光并呈正常结构;实验组出现凋亡细胞,早期凋亡细胞(VA)核染色质着绿色呈固缩状或圆珠状;非凋亡的死亡细胞(NVN)核染色质着橘红色并呈正常结构;晚期凋亡细胞(NVA)核染色质为橘红色并呈固缩状或圆珠状。可以发现布鲁生呈剂量性的诱导SHG-44细胞的凋亡,见图2。为进一步验证上述结果,再采用流式细胞仪,Annexin V/PI双染法检测布鲁生对A549细胞膜PS外翻情况及细胞膜完整情况,结果显示经不同浓度布鲁生处理24 h后,SHG44细胞晚期凋亡呈现剂量依赖性地增强,见图3。
2.3 布鲁生对SHG-44细胞作用24 h后BCL-2、BAX、COX-2的表达情况 布鲁生能剂量依赖性地降低SHG-44细胞抗凋亡蛋白BCL-2蛋白的表达,相应的剂量性地升高促凋亡BAX蛋白的表达。与此同时,布鲁生还呈剂量性地降低SHG44细胞中COX-2蛋白的表达(图4)。
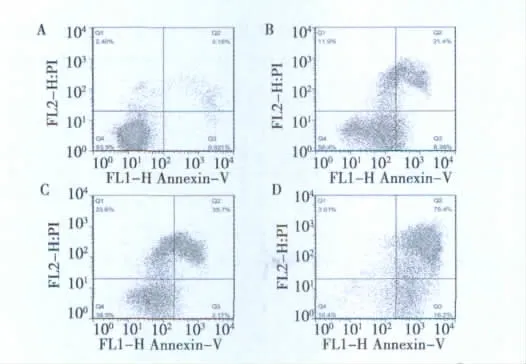
图3 流式细胞仪检测不同浓度的布鲁生作用SHG-44细胞24 h

图4 Western印迹检测不同浓度布鲁生对SHG-44细胞的BCL-2、BAX、COX-2表达的影响
3 讨论
布鲁生是从中药马钱子中提取的吲哚型结构的生物碱,是马钱子发挥药效的主要成分之一。近年来,布鲁生的抗肿瘤活性逐渐成为人们关注的焦点。有研究报道,布鲁生能明显抑制肝癌、肺癌、前列腺癌等多种肿瘤细胞的生长〔4,5〕。本实验结果显示,布鲁生在体外对SHG-44细胞的生长具有显著的抑制作用,并与药物浓度及作用时间明显相关,显示良好的时间/剂量效应关系,与文献〔6〕报道一致。证实马钱子碱可诱导SHG44细胞凋亡,且在一定范围内呈剂量效应关系,随药物作用浓度的增加,凋亡率也逐渐上升。为了进一步证实布鲁生对胶质瘤SHG44细胞凋亡的影响,本文通过Western印迹实验发现布鲁生可以明显上调BAX蛋白的表达、下调BCL-2蛋白的表达,同时布鲁生可以剂量性地升高COX-2蛋白的表达。综上,本文从不同侧面、不同水平证实布鲁生通过细胞内途径诱导胶质瘤细胞SHG44诱导凋亡。
COX-2在大多数正常组织中均不表达,而在多种肿瘤组织中呈高表达,与肿瘤的发生发展密切相关。COX-2主要通过促进细胞增殖、抑制细胞凋亡、促进肿瘤血管形成、增强肿瘤细胞侵袭转移和抑制免疫功能等机制导致或促进肿瘤的发生发展。有文献报道,特异性的COX-2抑制剂等非甾体抗炎药如塞来昔布、尼美舒利、阿司匹林等具有明显的抗肿瘤活性〔7〕。本实验结果提示布鲁生可能通过对COX-2蛋白表达的抑制而促进胶质瘤细胞的凋亡,但对肿瘤的作用可能并不局限于对COX-2表达的抑制。
本实验初步研究表明,马钱子碱有明显抑制胶质瘤SHG44细胞生长的作用,并且该抑制作用可能是通过诱导细胞凋亡实现的。这为今后在临床上应用马钱子碱治疗肿瘤提供了一定的实验理论依据。但细胞凋亡的过程是复杂多途径的,马钱子碱诱导SHG-44细胞凋亡的可能途径和相关基因尚需进一步研究。布鲁生虽具有明显的抗肿瘤效果,但同时应该注意其诱导细胞凋亡的用量较大,与实际布鲁生的体内用量可能有些偏差。在以后的研究中,以期发现毒性小、效果显著的化合物〔8〕。
1 Ge PF,Ji XM,Ding YC.Celastrol causes apoptosis and cell cycle arrest in rat glioma cells〔J〕.Neurol Res,2010;32(1):94-100.
2 王海丽,魏 武,纪爱芳.马钱子碱对人白血病细胞株K562细胞的诱导凋亡作用〔J〕.中国实验血液学杂志,2011;19(3):630-3.
3 Gong Z,Sun LR,Cao X.Strychnos alkaloids inhibit the proliferation of adult rat neuroprogenitor cells〔J〕.Food Chem Toxicol,2009;47(2):283-8.
4 Lazareno S,Gharagozloo P,Kuonen D,et al.Subtype-selective positive cooperative interactions between brucine analogues and acetylcholine at muscarinic receptors:radio ligand binding studies〔J〕.Mol Pharmacol,1998;53(3):573-9.
5 Deng X,Yin F,Lu X,et al.The apoptotic effect of brucine from the seed of strychnos nux-vomica on human hepatoma cells is mediated via Bcl-2 and Ca2+involved mitochondrial pathway〔J〕.Toxicol Sci,2006;91(1):59-69.
6 Rao PS,Ramanadham M,Prasad MN.Anti-proliferative and cytotoxic effects of strychnos nux-vomica root extract on human multiple myeloma cell line〔J〕.Food Chem Toxicol,2009;47(2):283-8.
7 徐美虹,吴开春,吴汉平.非甾体类抗炎药对胃癌细胞增殖的抑制作用〔J〕.中华消化杂志,2002;22(4):199-202.
8 朱国民,殷放宙,邓旭坤.布鲁生抑制非小细胞肺癌细胞环氧化酶2表达的研究〔J〕.中国癌症杂志,2009;19(9):671-7.

